Abstracts
Résumé
Les corégulateurs de transcription sont des protéines essentielles à l’activation de l’expression des gènes. Ces corégulateurs ne se lient pas à l’ADN ; associés aux facteurs de transcription, ils servent de pont avec la machinerie basale de transcription ou sont impliqués dans le remodelage de la chromatine. PGC-1α est le premier co-activateur à présenter une relative spécificité tissulaire d’expression. Exprimé dans le tissu adipeux brun, le muscle squelettique, le foie et le pancréas, il joue un rôle majeur dans le contrôle des métabolismes énergétique et glucidique. Sur le plan moléculaire, PGC-1α présente également la particularité de coupler la transcription des gènes à l’épissage des pré-ARNm.
Summary
Transcriptional coactivators can be important targets for physiologic regulation. PPARγ coactivator-1α (PGC-1α), in cooperation with several transcription factors, has emerged as a key regulator of several aspects of mammalian energy metabolism including mitochondrial biogenesis, adaptive thermogenesis in brown adipose tissue, glucose uptake, fiber type-switching in skeletal muscle, gluconeogenesis in liver and insulin secretion from pancreas. Recent studies have shown a reduced expression of PGC-1α in skeletal muscle of diabetic and prediabetic humans. Moreover, expression of PGC-1α in white fat cells activates a broad program of adaptive thermogenesis characteristic of brown fat cells. PGC-1α could be a target for antiobesity or diabetes drugs. The aim of this article was to summarize the molecular mechanisms and biological programs controlled by the transcriptional coactivator PGC-1α.
Article body
Les récepteurs nucléaires se fixent à l’ADN, le plus souvent sous forme de dimères, et activent la transcription de gènes en réponse à la fixation de ligands spécifiques. L’interaction avec le ligand induit un changement de conformation du récepteur et permet le recrutement de co-activateurs de transcription tels que les protéines de la famille p160 (SRC-1, steroid receptor coactivator1), TIF2 (transcriptional intermediary factor2), p/CIP… [1]. Ces co-activateurs sont impliqués dans le remodelage de la chromatine, le recrutement d’autres cofacteurs et l’activation de la machinerie transcriptionnelle. La plupart présentent peu de spécificité tissulaire d’expression, à l’exception notable de PGC-1α (peroxisome proliferator activator receptor γ coactivator-1α), exprimé dans un nombre restreint de tissus. Identifié en 1998 dans le tissu adipeux brun comme co-activateur du récepteur nucléaire PPARγ (peroxisome proliferator activator receptor γ) [2], PGC-1α est également présent dans le coeur, les muscles squelettiques, le rein, le foie, le pancréas et le cerveau, chez l’homme comme chez les rongeurs [2-6]. Il est aujourd’hui clair que PGC-1α est un modulateur important du métabolisme. Dans cet article, nous aborderons dans un premier temps les mécanismes moléculaires d’activation de PGC-1α pour proposer ensuite une synthèse de ses principaux rôles.
Structure et fonction de PGC-1α
PGC-1α est une protéine nucléaire de 91 kDa appartenant à une petite famille de co-activateurs comprenant PERC/PGC-1β (PGC-1 related estrogen receptor coactivator) et PRC (PGC-1 related coactivator) [7], toutes ces protéines présentant un fort degré d’homologie à leurs extrémités amino- et carboxyterminales. Pour co-activer la transcription d’un gène, PGC-1α doit être recruté par un facteur de transcription capable de se lier sur le promoteur du gène concerné. Le recrutement du co-activateur dépend du promoteur considéré : par exemple, le complexe PGC-1α/PPARγ active le promoteur du gène codant pour la protéine découplante UCP1 (uncoupling protein1) dans le tissu adipeux brun, mais pas celui du gène ALBP (adipocyte lipid binding protein), qui est une cible connue de PPARγ dans les adipocytes [2, 8].
Outre PPARγ, plusieurs autres récepteurs nucléaires interagissent avec PGC-1α [7] : PPARα, le récepteur des oestrogènes ERα, le récepteur des glucocorticoïdes, le récepteur de l’acide rétinoïque RXRα, les récepteurs des hormones thyroïdiennes, le liver X receptor LXRα [9], le farnesoid X receptor FXR [10] et les récepteurs orphelins ERRα et ERRγ (estrogen-related receptor) [11]. PGC-1α peut également interagir avec les facteurs de transcription MEF2C (myocyte enhancer factor2) dans le muscle [12], HNF4α (hepatocyte nuclear factor4) [4] et Foxo1 (forkhead box O) [13] dans le foie, et NRF1 (nuclear respiratory factor1) dans les muscles et le tissu adipeux brun [14].
La plupart des récepteurs nucléaires se lient à un motif LXXLL présent à l’extrémité aminoterminale de PGC-1α (Figure 1). Trois de ces motifs (L1, L2 et L3) ont été identifiés [15] ; dans la plupart des cas, la liaison au motif L2 dépend de la fixation d’un ligand par le récepteur. Généralement, lorsque l’interaction de PGC-1α avec un récepteur est dépendante du motif L2, PGC-1α se lie sur la région AF2 (activation function 2) du récepteur située dans le domaine de liaison au ligand, à l’extrémité carboxyterminale. Lorsque ce motif n’est pas impliqué, PGC-1α interagirait préférentiellement avec la partie centrale ou aminoterminale du récepteur. Certains facteurs de transcription interagissent avec d’autres régions de PGC-1α : le facteur musculaire MEF2C, par exemple, interagit avec une région de PGC-1α située entre les acides aminés 400 et 550 [12]. PPARγ, quant à lui, possède deux sites de fixation indépendants sur PGC-1α, le motif L2 et la région comprenant les acides aminés 200 à 400 [16]. L’interaction entre PGC-1α et PPARγ est indépendante de la fixation d’un ligand sur PPARγ.
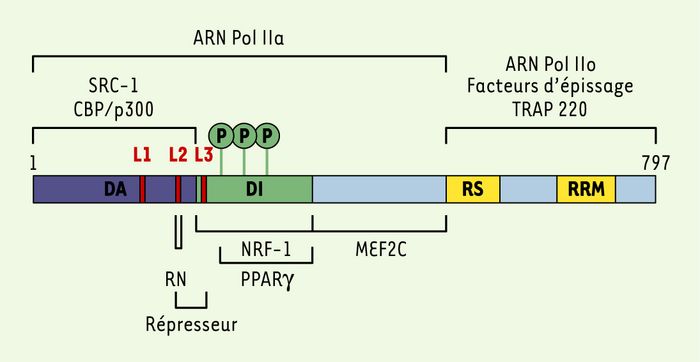
Figure 1
Structure de la protéine PGC-1α.
Les sites de liaison des récepteurs ou des facteurs de transcription, PPARγ (acides aminés 292 à 338), NRF1 (acides aminés 180 à 403) et MEF2C (acides aminés 403 à 570), sont indiqués, ainsi que les zones d’interaction avec les co-activateurs (SRC-1, CBP/p300, TRAP 220…) et les sites de phosphorylation par la p38 MAP-kinase (Thr-262, Ser-265 et Thr-298). Le répresseur se lie principalement au motif L3, mais également au motif L2. DA : domaine d ’activation (acides aminés 1 à 170) ; DI : domaine inhibiteur (acides aminés 170 à 350) ; RS : arginine-serine-rich domain (acides aminés 565 à 631) ; RRM : RNA recognition motif (acides aminés 677 à 709) ; L1, L2, L 3 : motifs LXXLL (acides aminés 88 à 92, acides aminés 144 à 148, acides aminés 210 à 214) ; ARN Pol II : ARN polymérase II ; RN : récepteurs nucléaires.
Répression de l’activité de PGC-1α
PGC-1α possède un domaine inhibiteur qui réprime son activité transcriptionnelle [17]. Ce domaine contient un motif LXXLL (L3) qui se lie à une ou plusieurs protéines répresseurs [15, 18]. Ainsi, la surexpression de la protéine de liaison p160 myb (p160MBP) dans des myoblastes en culture réprime la fonction co-activatrice de PGC-1α. Cette interaction entre p160MBP et PGC-1α est réglée par la protéine p38 de la voie des MAP-kinases (mitogen-activated protein kinases). La phosphorylation de PGC-1α entraînerait le relargage de p160MBP et stabiliserait PGC-1α [18, 19], lui permettant alors d’interagir avec un facteur de transcription. Le récepteur orphelin ERRα pourrait également se comporter comme un répresseur de PGC-1α [20] : la surexpression de ERRα∈réprime l’activité transcriptionnelle de PGC-1α indépendamment de sa régulation par la p38 MAP-kinase. Ce résultat est inattendu dans la mesure où PGC-1α augmente les niveaux d’ARNm d’ERRα et interagit avec ERRα pour co-activer la transcription de gènes impliqués dans le métabolisme énergétique mitochondrial [21-23]. ERRα pourrait représenter un élément d’une boucle de rétrocontrôle dont le rôle varierait en fonction du contexte cellulaire.
Mécanismes d’action de PGC-1α à l’échelle moléculaire
PGC-1α est impliqué dans le remodelage de la chromatine, l’activation de la transcription et la régulation de l’épissage des ARNm (Figure 2) [7]. Une fois recruté, PGC-1α mobilise, par son extrémité aminoterminale, d’autres co-activateurs tels que SRC-1 ou CBP/p300, qui possèdent un domaine HAT (histone acetyl transferase) dont PGC-1α est dépourvu. Cette activité HAT modifie la structure de la chromatine par acétylation des histones et permet à la machinerie de transcription d’accéder au gène. PGC-1α s’associe également à l’ARN polymérase II (Pol II) et à la sous-unité TRAP 220 du complexe TRAP/mediator (thyroid hormone receptor-associated proteins) dans le complexe de pré-initiation de la transcription [16]. En coopération avec TRAP/mediator, PGC-1α potentialise fortement l’activité transcriptionnelle de PPARγ-RXRα.
Figure 2
Activités de PGC-1α à l’échelle moléculaire.
A. La protéine p38 MAP-kinase (mitogen-activated protein kinase) activée permet le relargage du répresseur (R) par phosphorylation de PGC-1α. B. Une fois recruté par un récepteur nucléaire (RN), PGC-1α change de conformation pour se lier à des co-activateurs dotés d’une activité histone acétyltransférase (HAT) tels que SRC-1 ou CBP/p300. PGC-1α∈s’associe également par son extrémité aminoterminale à la sous-unité Pol IIa de l’ARN polymérase II, impliquée dans la pré-initiation de la transcription, et par son extrémité carboxyterminale à la sous-unité TRAP 220 du complexe TRAP/mediator (thyroid hormone receptor-associated proteins). C. Le domaine carboxyterminal de Pol II est ensuite phosphorylé (Pol IIo) et se dissocie des partenaires du complexe d’initiation, dont le mediator. Une nouvelle série de protéines, incluant les protéines de la machinerie d’élongation (F. élongation) et d’épissage (F. épissage), se rallie à la forme activée de Pol II. PGC-1α s’associe à ce nouveau complexe d’élongation par son extrémité carboxyterminale. D. Enfin, PGC-1α se dissocie du facteur de transcription ou récepteur nucléaire et progresse avec le complexe d’élongation et d’épissage le long de l’ARNm pour participer, selon toute vraisemblance, à l’épissage du pré-ARNm.
PGC-1α se lie également à la forme activée de Pol II et à des facteurs d’élongation et d’épissage dans le complexe d’élongation. L’extrémité carboxyterminale de PGC-1α comprend un motif de reconnaissance et de liaison à l’ARN et un domaine riche en résidus arginine et sérine, caractéristique de protéines régulatrices de l’épissage. En présence de l’hétérodimère PPARγ-RXRα, PGC-1α induit l’expression et l’épissage d’un mini-gène placé sous contrôle du promoteur du gène de la β-actine et de la séquence PPRE (peroxisome-proliferator-responsive element) du promoteur UCP1. PGC-1α établit donc un lien entre le récepteur nucléaire et la machinerie d’élongation et d’épissage. Les facteurs de transcription, par l’intermédiaire de co-activateurs tels que PGC-1α, pourraient ainsi moduler l’épissage des ARNm.
Principaux rôles de PGC-1α
Métabolisme énergétique mitochondrial
Certaines situations physiologiques (naissance, exposition au froid et exercice physique) impliquent une adaptation du métabolisme mitochondrial dans les tissus sollicités. Ainsi, la thermogenèse adaptative en réponse au froid entraîne, dans le tissu adipeux brun, une augmentation du nombre de mitochondries, l’augmentation de la respiration mitochondriale et l’induction du découplage de la respiration. Dans le muscle, consécutivement à un exercice, et dans le coeur, après la naissance, l’augmentation de la mitochondriogenèse et de la respiration mitochondriale s’accompagnent d’une synthèse accrue d’ATP. Les niveaux d’ARNm de PGC-1α sont augmentés dans ces deux situations [2, 24, 25]. Une surexpression de PGC-1α dans des pré-adipocytes blancs [2], dans des myotubes [14] ou dans des myocytes cardiaques en culture [25] augmente les niveaux de gènes Oxphos impliqués dans la phosphorylation oxydative (ATP synthase, cytochrome oxydase et cytochrome c) ; cette même surexpression de PGC-1α augmente l’expression du gène UCP1 dans les pré-adipocytes et du gène UCP2 dans les myotubes. UCP1 permet le découplage entre la consommation d’oxygène et la synthèse d’ATP et contribue à la dissipation d’énergie sous forme de chaleur dans le tissu adipeux brun. UCP2, quant à elle, possède aussi des propriétés découplantes, mais son rôle physiologique n’est pas clairement établi. Les cellules exprimant PGC-1α présentent également une augmentation de la biogenèse mitochondriale. La respiration couplée à la synthèse d’ATP est augmentée dans les myotubes et les cardiomyocytes, tandis que le découplage de la respiration n’est augmenté que dans les myotubes. Ces travaux suggèrent que PGC-1α règle l’expression des gènes Oxphos dans le muscle squelettique et le tissu adipeux brun et exerce une régulation des UCP différente selon le tissu. Les fondements de cette régulation spécifique des UCP ne sont pas connus ; l’interaction avec divers types de facteurs de transcription constitue toutefois un mécanisme moléculaire plausible.
Un modèle d’action de PGC-1α en coopération avec différents facteurs de transcription, dont ERRα∈[21-23], NRF1, NRF2 [14] et les récepteurs nucléaires PPAR, est proposé dans la Figure 3. PGC-1α apparaît comme un gène clé dans la mise en place d’un programme transcriptionnel lié au métabolisme énergétique mitochondrial. Sur le plan physiopathologique, une diminution de l’expression de PGC-1α dans les muscles et le coeur pourrait contribuer respectivement au développement d’un diabète de type 2 et d’une insuffisance cardiaque [26-28].
Figure 3
Implication de PGC-1α dans la biogenèse et la respiration mitochondriales, et dans l’oxydation des acides gras.
Dans le tissu adipeux brun, la transcription de PGC-1α est induite après activation des récepteurs β3-adrénergiques (β3-AR). Dans les muscles, l’expression de PGC-1α serait augmentée via les kinases dépendantes de l’AMP (AMPK) ou du calcium et de la calmoduline (CAMK IV). Une fois recruté par un facteur de transcription, PGC-1α induit l’expression de NRF-1, NRF-2 (nuclear respiratory factor1 et 2) ou ERRα estrogen-related receptor α), d’une part, et d’une UCP (uncoupling protein), d’autre part (UCP1 dans le tissu adipeux brun, UCP2 dans les muscles). Le couple PGC-1α-ERRα active seul, ou en synergie avec NRF-1 et NRF-2, selon le tissu considéré, la transcription de gènes de la chaîne respiratoire (Oxphos) et du facteur mtTFA (mitochondrial transcription factor) qui contrôle la transcription et la réplication de l’ADN mitochondrial. PGC-1α peut également interagir directement avec NRF-1 pour co-activer la transcription de ses gènes cibles. Enfin, PGC-1α active la transcription des gènes de l’oxydation des acides gras, en coopération avec les récepteurs PPARα ou ERRα. Prot G : protéine G ; AC : adénylyl cyclase ; PKA : protéine kinase A ; CREB : cAMP responsive element binding protein ; Fact. transcr. : facteurs de transcription ; PPAR : peroxisome proliferator-activated receptor ; TR : thyroïd hormone receptor ; Cox IV : cytochrome oxydase 4 ; Cyt c : cytochrome c ; MCAD : medium chain acyl coenzyme A dehydrogenase ; CPT-1 : carnitine palmitoyl transferase 1.
Oxydation des acides gras
PGC-1α est induit dans des situations où les acides gras deviennent le substrat énergétique préférentiel (naissance, jeûne et exercice). L’expression de PGC-1α dans des myocytes cardiaques, dans des pré-adipocytes 3T3-L1 ou dans des adipocytes blancs humains sous-cutanés entraîne une augmentation des taux d’ARNm de la medium chain acyl coenzyme A dehydrogenase (MCAD) et de la carnitine palmitoyl transferase 1 (CPT-1), qui contrôle l’étape limitante de l’oxydation des acides gras [8, 25, 29]. PGC-1α∈interagirait avec PPARα ou ERRα pour induire l’expression de ces gènes selon les types cellulaires [21-23, 29]. Dans le foie, PGC-1α co-active la transcription de l’isoforme hépatique de CPT-1 en coopération avec le facteur de transcription HNF4α∈[30]. Dans les pré-adipocytes murins et dans les adipocytes blancs humains sous-cutanés, PGC-1α augmente les taux d’oxydation du palmitate [8, 29].
Transition entre les types de fibres musculaires et transdifférenciation des adipocytes
PGC-1α serait impliqué dans la conversion des fibres musculaires de type II rapides glycolytiques en fibres de type I lentes oxydatives. L’expression de PGC-1α à des niveaux physiologiques dans les muscles glycolytiques de souris induit l’expression de protéines contractiles caractéristiques des fibres de type I (troponine I et myoglobine) et des enzymes de la chaîne respiratoire, et confère aux cellules une plus grande résistance à la fatigue lors d’une stimulation électrique [31]. Chez l’homme, l’entraînement physique induit l’expression de PGC-1α dans les fibres de type II du muscle vastus lateralis, une élévation des taux d’ARNm de la troponine I et de la cytochrome oxydase IV, et une augmentation de la proportion de fibres de type I [24]. PGC-1α participerait donc au contrôle de la conversion des fibres de type II en type I, chez l’homme comme chez la souris.
PGC-1α pourrait également être impliqué dans la conversion des adipocytes blancs matures en adipocytes bruns. En effet, la surexpression de PGC-1α dans les adipocytes blancs humains sous-cutanés traités par des thiazolidinediones (agonistes synthétiques de PPARγ) induit l’acquisition par ces cellules de caractéristiques d’adipocytes bruns. Les concentrations d’UCP1, du cytochrome c et de la protéine Cox IV, de protéines marqueurs des adipocytes bruns (mitofusine 2, glycérol kinase) et la capacité oxydative des cellules sont augmentés [8]. Ce travail suggère une nouvelle stratégie thérapeutique dans le traitement des obésités fondée sur l’induction de l’expression ou de l’activité de PGC-1α dans le tissu adipeux blanc [32].
Métabolisme du glucose
Transport du glucose dans les muscles
Une concentration élevée d’acides gras libres plasmatiques entraîne une insulinorésistance dans les muscles et le foie. Chez l’homme, une baisse de l’expression de PGC-1α dans les muscles pourrait être à l’origine d’une diminution de l’expression des gènes Oxphos et d’une diminution de l’oxydation des acides gras entraînant une accumulation de lipides intracellulaires et le développement d’une insulinorésistance [26, 27]. Par aillleurs, dans le muscle, PGC-1α, en coopération avec MEF2C, augmente l’expression du transporteur de glucose Glut4 et, en conséquence, le transport de glucose [12]. Cette étude est en accord avec ce qui est observé lors d’un exercice physique dans les muscles : la sensibilité à l’insuline est améliorée tandis que les niveaux de PGC-1α et de Glut4 sont augmentés [33].
Néoglucogenèse hépatique
Dans le foie des souris soumises à un jeûne ou développant un diabète, l’augmentation de la néoglucogenèse et de l’oxydation des acides gras sont liées à une élévation de l’expression de PGC-1α (Figure 4) [4]. Les trois enzymes clés de la néoglucogenèse sont la phosphoénol-pyruvate carboxykinase (PEPCK), la fructose-1,6-biphosphatase (F-1,6-BPase) et la glucose-6-phosphatase (G-6-Pase). Leur expression est inhibée par l’insuline et activée par le glucagon, les glucocorticoïdes et les catécholamines. PGC-1α est induit dans le foie en réponse au glucagon ou à l’adrénaline, par le biais de la protéine CREB, elle-même activée par l’AMPc [4, 34]. PGC-1α est également induit via une levée de l’inhibition exercée indirectement par l’insuline sur le promoteur de PGC-1α via le facteur de transcription Foxo1 [35]. PGC-1α augmente la production de glucose dans les hépatocytes in vitro ou in vivo et coactive la transcription des enzymes PEPCK, F-1,6-BPase et G-6-Pase, en coopération avec les facteurs de transcription Foxo1 [13], HNF-4α ou le récepteur des glucocorticoïdes [4, 36]. Le co-activateur semble également contribuer au développement de l’insulinorésistance dans cet organe, c’est-à-dire à l’atténuation de l’inhibition de la production hépatique de glucose par l’insuline. En partenariat avec PPARα, PGC-1α induit l’expression de TRB-3, un inhibiteur de la protéine kinase B qui relaie l’action de l’insuline [37].
Figure 4
Rôle de PGC-1α dans la néoglucogenèse hépatique.
PGC-1α amplifie l’effet des glucocorticoïdes, du glucagon et de l’adrénaline sur la transcription des enzymes de la néoglucogenèse. PGC-1α est induit en réponse au glucagon ou à l’adrénaline, par le biais d’une augmentation de la concentration d’AMPc et l’activation de la protéine CREB. PGC-1α est également induit via une levée de l’inhibition exercée par l’insuline sur le promoteur de PGC-1α. Le promoteur de PGC-1α possède trois éléments de réponse à l’insuline (IRS), cibles du facteur de transcription Foxo1 qui active la transcription de PGC-1α. En présence d’insuline, Foxo1 est phosphorylé par la protéine kinase B, elle-même activée par le récepteur de l’insuline : Foxo1 est alors redirigé vers le cytosol, et la transcription de PGC-1α est réprimée. Cependant, PGC-1α, en coopération avec PPARα, peut induire l’expression de TRB-3, un inhibiteur de la protéine kinase B. Foxo1 peut également interagir avec la protéine PGC-1α au même titre que le facteur de transcription hépatique HNF-4α ou le récepteur des glucocorticoïdes, pour coactiver la transcription des gènes de la néoglucogenèse. L’interaction de PGC-1α avec HNF-4α∈serait inhibée par le facteur de transcription SREBP-1. Prot G : protéine G ; AC : adénylyl cyclase ; AMPc : AMP cyclique ; PKA : protéine kinase A ; PI3K : phosphatidyl inositol 3 kinase ; CREB : cAMP responsive element binding protein ; Foxo1 (ou FKHR) : forkhead transcription factor 1 ; GR : glucocorticoid receptor ; HNF-4α : hepatocyte nuclear factor-4α ; PKB : protéine kinase B (Akt) ; SREBP-1 : sterol regulatory element-binding transcription factor 1 ; PEPCK : phosphoénolpyruvate carboxykinase ; F-1,6-BPase : fructose-1,6-biphosphatase ; G-6-Pase : glucose-6-phosphatase.
PGC-1α et sécrétion d’insuline dans le pancréas
Le diabète de type 2 s’accompagne d’une réduction de la sécrétion d’insuline par les cellules β du pancréas. La sécrétion d’insuline est sous le contrôle du rapport ATP/ADP. L’oxydation du glucose, capté par la cellule β via le transporteur de glucose Glut2, entraîne une augmentation du rapport ATP/ADP, la fermeture des canaux K+, une dépolarisation membranaire et une activation de canaux Ca2+. L’influx de calcium dans la cellule induit alors l’exocytose d’insuline. Les cellules β d’animaux diabétiques présentent un défaut d’oxydation du glucose associé à une réduction de l’expression de Glut2, d’enzymes du catabolisme du glucose (glucokinase, glycérol-3-phosphate déshydrogénase) et à une augmentation de l’expression de la G-6-Pase. Il en résulte une diminution du rapport ATP/ADP et de la libération d’insuline. PGC-1α serait associé au contrôle de la sécrétion d’insuline dans le pancréas. Une étude révèle une augmentation des niveaux de PGC-1α dans le pancréas d’animaux diabétiques et montre qu’une surexpression physiologique de PGC-1α dans le pancréas in vitro ou in vivo entraîne une réduction, chez la souris, de la sécrétion d’insuline en réponse au glucose [5]. Cette réduction s’accompagne de modifications géniques semblables à celles observées dans le pancréas d’animaux diabétiques tandis que la concentration d’ATP est diminuée. PGC-1α pourrait donc être impliqué dans une diminution de la sécrétion d’insuline. Une deuxième étude suggère que PGC-1α diminue le rapport ATP/ADP et la sécrétion d’insuline via l’induction de l’expression d’UCP2 dans le pancréas chez le rat [6]. En effet, une augmentation du découplage de la respiration dans les mitochondries, via UCP2, peut également entraîner une réduction du rapport ATP/ADP et de la sécrétion d’insuline.
Conclusions
Le co-activateur transcriptionnel PGC-1α présente donc une grande diversité de fonctions. Dans le cadre du traitement du diabète de type 2, il pourrait y avoir un intérêt à inhiber l’activité de PGC-1α dans le foie ou le pancréas. En revanche, dans les muscles et le tissu adipeux blanc, la stratégie inverse serait plus appropriée. Les stratégies thérapeutiques potentielles reposent donc sur des voies d’activation de PGC-1α spécifiques de chaque tissu, ou sur le ciblage des interactions entre PGC-1α et les facteurs de transcription impliqués.
Appendices
Références
- 1. Xu J, Li Q. Review of the in vivo functions of the p160 steroid receptor coactivator family. Mol Endocrinol 2003 ; 17 : 1681-92.
- 2. Puigserver P, Wu Z, Park CW, et al. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis. Cell 1998 ; 92 : 829-39.
- 3. Larrouy D, Vidal H, Andreelli F, et al. Cloning and mRNA tissue distribution of human PPARgamma coactivator-1. Int J Obesity 1999 ; 23 : 1327-32.
- 4. Yoon JC, Puigserver P, Chen G, et al. Control of hepatic gluconeogenesis through the transcriptional coactivator PGC-1. Nature 2001 ; 413 : 131-8.
- 5. Yoon JC, Xu G, Deeney JT, et al. Suppression of beta cell energy metabolism and insulin release by PGC-1alpha. Dev Cell 2003 ; 5 : 73-83.
- 6. De Souza CT, Gasparetti AL, Pereira-da-Silva M, et al. Peroxisome proliferator-activated receptor gamma coactivator-1-dependent uncoupling protein-2 expression in pancreatic islets of rats : a novel pathway for neural control of insulin secretion. Diabetologia 2003 ; 46 : 1522-31.
- 7. Puigserver P, Spiegelman BM. Peroxisome proliferator-activated receptor-gamma coactivator 1 alpha (PGC-1 alpha) : transcriptional coactivator and metabolic regulator. Endocrinol Rev 2003 ; 24 : 78-90.
- 8. Tiraby C, Tavernier G, Lefort C, et al. Acquirement of brown fat cell features by human white adipocytes. J Biol Chem 2003 ; 278 : 33370-6.
- 9. Oberkofler H, Schraml E, Krempler F, et al. Potentiation of liver X receptor transcriptional activity by peroxisome-proliferator-activated receptor gamma co-activator 1 alpha. Biochem J 2003 ; 371 : 89-96.
- 10. Zhang Y, Castellani LW, Sinal CJ, et al. Peroxisome proliferator-activated receptor-gamma coactivator 1alpha (PGC-1alpha) regulates triglyceride metabolism by activation of the nuclear receptor FXR. Genes Dev 2004 ; 18 : 157-69.
- 11. Huss JM, Kopp RP, Kelly DP. Peroxisome proliferator-activated receptor coactivator-1alpha (PGC-1alpha) coactivates the cardiac-enriched nuclear receptors estrogen-related receptor-alpha and -gamma. Identification of novel leucine-rich interaction motif within PGC-1alpha. J Biol Chem 2002 ; 277 : 40265-74.
- 12. Michael LF, Wu Z, Cheatham RB, et al. Restoration of insulin-sensitive glucose transporter (GLUT4) gene expression in muscle cells by the transcriptional coactivator PGC-1. Proc Natl Acad Sci USA 2001 ; 98 : 3820-5.
- 13. Puigserver P, Rhee J, Donovan J, et al. Insulin-regulated hepatic gluconeogenesis through FOXO1-PGC-1alpha interaction. Nature 2003 ; 423 : 550-5.
- 14. Wu Z, Puigserver P, Andersson U, et al. Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1. Cell 1999 ; 98 : 115-24.
- 15. Knutti D, Kressler D, Kralli A. Regulation of the transcriptional coactivator PGC-1 via MAPK-sensitive interaction with a repressor. Proc Natl Acad Sci USA 2001 ; 98 : 9713-8.
- 16. Wallberg AE, Yamamura S, Malik S, et al. Coordination of p300-mediated chromatin remodeling and TRAP/mediator function through coactivator PGC-1alpha. Mol Cell 2003 ; 12 : 1137-49.
- 17. Puigserver P, Adelmant G, Wu Z, et al. Activation of PPARgamma coactivator-1 through transcription factor docking. Science 1999 ; 286 : 1368-71.
- 18. Fan M, Rhee J, St-Pierre J, et al. Suppression of mitochondrial respiration through recruitment of p160 myb binding protein to PGC-1alpha : modulation by p38 MAPK. Genes Dev 2004 ; 18 : 278-89.
- 19. Puigserver P, Rhee J, Lin J, et al. Cytokine stimulation of energy expenditure through p38 MAP kinase activation of PPARgamma coactivator-1. Mol Cell 2001 ; 8 : 971-82.
- 20. Ichida M, Nemoto S, Finkel T. Identification of a specific molecular repressor of the peroxisome proliferator-activated receptor gamma coactivator-1 alpha (PGC-1alpha). J Biol Chem 2002 ; 277 : 50991-5.
- 21. Schreiber SN, Knutti D, Brogli K, et al. The transcriptional coactivator PGC-1 regulates the expression and activity of the orphan nuclear receptor estrogen-related receptor alpha (ERRalpha). J Biol Chem 2003 ; 278 : 9013-8.
- 22. Schreiber SN, Emter R, Hock MB, et al. The estrogen-related receptor alpha (ERRalpha) functions in PPARgamma coactivator 1alpha (PGC-1alpha)-induced mitochondrial biogenesis. Proc Natl Acad Sci USA 2004 ; 101 : 6472-7.
- 23. Mootha VK, Handschin C, Arlow D, et al. Erralpha and Gabpa/b specify PGC-1alpha-dependent oxidative phosphorylation gene expression that is altered in diabetic muscle. Proc Natl Acad Sci USA 2004 ; 101 : 6570-5.
- 24. Russell AP, Feilchenfeldt J, Schreiber S, et al. Endurance training in humans leads to fiber type-specific increases in levels of peroxisome proliferator-activated receptor-gamma coactivator-1 and peroxisome proliferator-activated receptor-alpha in skeletal muscle. Diabetes 2003 ; 52 : 2874-81.
- 25. Lehman JJ, Barger PM, Kovacs A, et al. Peroxisome proliferator-activated receptor gamma coactivator-1 promotes cardiac mitochondrial biogenesis. J Clin Invest 2000 ; 106 : 847-56.
- 26. Mootha VK, Lindgren CM, Eriksson KF, et al. PGC-1alpha-responsive genes involved in oxidative phosphorylation are coordinately downregulated in human diabetes. Nat Genet 2003 ; 34 : 267-73.
- 27. Patti ME, Butte AJ, Crunkhorn S, et al. Coordinated reduction of genes of oxidative metabolism in humans with insulin resistance and diabetes : potential role of PGC1 and NRF1. Proc Natl Acad Sci USA 2003 ; 100 : 8466-71.
- 28. Garnier A, Fortin D, Delomenie C, et al. Depressed mitochondrial transcription factors and oxidative capacity in rat failing cardiac and skeletal muscles. J Physiol (Lond) 2003 ; 551 : 491-501.
- 29. Vega RB, Huss JM, Kelly DP. The coactivator PGC-1 cooperates with peroxisome proliferator-activated receptor alpha in transcriptional control of nuclear genes encoding mitochondrial fatty acid oxidation enzymes. Mol Cell Biol 2000 ; 20 : 1868-76.
- 30. Louet JF, Hayhurst G, Gonzalez FJ, et al. The coactivator PGC-1 is involved in the regulation of the liver carnitine palmitoyltransferase I gene expression by cAMP in combination with HNF4 alpha and cAMP-response element-binding protein (CREB). J Biol Chem 2002 ; 277 : 37991-8000.
- 31. Lin J, Wu H, Tarr PT, et al. Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres. Nature 2002 ; 418 : 797-801.
- 32. Tiraby C, Langin D. Conversion from white to brown adipocytes : a strategy for the control of fat mass ? Trends Endocrinol Metab 2003 ; 14 : 439-41.
- 33. Baar K, Wende AR, Jones TE, et al. Adaptations of skeletal muscle to exercise : rapid increase in the transcriptional coactivator PGC-1. FASEB J 2002 ; 16 : 1879-86.
- 34. Herzig S, Long F, Jhala US, et al. CREB regulates hepatic gluconeogenesis through the coactivator PGC-1. Nature 2001 ; 413 : 179-83.
- 35. Daitoku H, Yamagata K, Matsuzaki H, et al. Regulation of PGC-1 promoter activity by protein kinase B and the forkhead transcription factor FKHR. Diabetes 2003 ; 52 : 642-9.
- 36. Rhee J, Inoue Y, Yoon JC, et al. Regulation of hepatic fasting response by PPARgamma coactivator-1alpha (PGC-1) : requirement for hepatocyte nuclear factor 4alpha in gluconeogenesis. Proc Natl Acad Sci USA 2003 ; 100 : 4012-7.
- 37. Koo SH, Satoh H, Herzig S, et al. PGC-1 promotes insulin resistance in liver through PPAR-alpha-dependent induction of TRB-3. Nat Med 2004 ; 10 : 530-4.
List of figures
Figure 1
Structure de la protéine PGC-1α.
Les sites de liaison des récepteurs ou des facteurs de transcription, PPARγ (acides aminés 292 à 338), NRF1 (acides aminés 180 à 403) et MEF2C (acides aminés 403 à 570), sont indiqués, ainsi que les zones d’interaction avec les co-activateurs (SRC-1, CBP/p300, TRAP 220…) et les sites de phosphorylation par la p38 MAP-kinase (Thr-262, Ser-265 et Thr-298). Le répresseur se lie principalement au motif L3, mais également au motif L2. DA : domaine d ’activation (acides aminés 1 à 170) ; DI : domaine inhibiteur (acides aminés 170 à 350) ; RS : arginine-serine-rich domain (acides aminés 565 à 631) ; RRM : RNA recognition motif (acides aminés 677 à 709) ; L1, L2, L 3 : motifs LXXLL (acides aminés 88 à 92, acides aminés 144 à 148, acides aminés 210 à 214) ; ARN Pol II : ARN polymérase II ; RN : récepteurs nucléaires.
Figure 2
Activités de PGC-1α à l’échelle moléculaire.
A. La protéine p38 MAP-kinase (mitogen-activated protein kinase) activée permet le relargage du répresseur (R) par phosphorylation de PGC-1α. B. Une fois recruté par un récepteur nucléaire (RN), PGC-1α change de conformation pour se lier à des co-activateurs dotés d’une activité histone acétyltransférase (HAT) tels que SRC-1 ou CBP/p300. PGC-1α∈s’associe également par son extrémité aminoterminale à la sous-unité Pol IIa de l’ARN polymérase II, impliquée dans la pré-initiation de la transcription, et par son extrémité carboxyterminale à la sous-unité TRAP 220 du complexe TRAP/mediator (thyroid hormone receptor-associated proteins). C. Le domaine carboxyterminal de Pol II est ensuite phosphorylé (Pol IIo) et se dissocie des partenaires du complexe d’initiation, dont le mediator. Une nouvelle série de protéines, incluant les protéines de la machinerie d’élongation (F. élongation) et d’épissage (F. épissage), se rallie à la forme activée de Pol II. PGC-1α s’associe à ce nouveau complexe d’élongation par son extrémité carboxyterminale. D. Enfin, PGC-1α se dissocie du facteur de transcription ou récepteur nucléaire et progresse avec le complexe d’élongation et d’épissage le long de l’ARNm pour participer, selon toute vraisemblance, à l’épissage du pré-ARNm.
Figure 3
Implication de PGC-1α dans la biogenèse et la respiration mitochondriales, et dans l’oxydation des acides gras.
Dans le tissu adipeux brun, la transcription de PGC-1α est induite après activation des récepteurs β3-adrénergiques (β3-AR). Dans les muscles, l’expression de PGC-1α serait augmentée via les kinases dépendantes de l’AMP (AMPK) ou du calcium et de la calmoduline (CAMK IV). Une fois recruté par un facteur de transcription, PGC-1α induit l’expression de NRF-1, NRF-2 (nuclear respiratory factor1 et 2) ou ERRα estrogen-related receptor α), d’une part, et d’une UCP (uncoupling protein), d’autre part (UCP1 dans le tissu adipeux brun, UCP2 dans les muscles). Le couple PGC-1α-ERRα active seul, ou en synergie avec NRF-1 et NRF-2, selon le tissu considéré, la transcription de gènes de la chaîne respiratoire (Oxphos) et du facteur mtTFA (mitochondrial transcription factor) qui contrôle la transcription et la réplication de l’ADN mitochondrial. PGC-1α peut également interagir directement avec NRF-1 pour co-activer la transcription de ses gènes cibles. Enfin, PGC-1α active la transcription des gènes de l’oxydation des acides gras, en coopération avec les récepteurs PPARα ou ERRα. Prot G : protéine G ; AC : adénylyl cyclase ; PKA : protéine kinase A ; CREB : cAMP responsive element binding protein ; Fact. transcr. : facteurs de transcription ; PPAR : peroxisome proliferator-activated receptor ; TR : thyroïd hormone receptor ; Cox IV : cytochrome oxydase 4 ; Cyt c : cytochrome c ; MCAD : medium chain acyl coenzyme A dehydrogenase ; CPT-1 : carnitine palmitoyl transferase 1.
Figure 4
Rôle de PGC-1α dans la néoglucogenèse hépatique.
PGC-1α amplifie l’effet des glucocorticoïdes, du glucagon et de l’adrénaline sur la transcription des enzymes de la néoglucogenèse. PGC-1α est induit en réponse au glucagon ou à l’adrénaline, par le biais d’une augmentation de la concentration d’AMPc et l’activation de la protéine CREB. PGC-1α est également induit via une levée de l’inhibition exercée par l’insuline sur le promoteur de PGC-1α. Le promoteur de PGC-1α possède trois éléments de réponse à l’insuline (IRS), cibles du facteur de transcription Foxo1 qui active la transcription de PGC-1α. En présence d’insuline, Foxo1 est phosphorylé par la protéine kinase B, elle-même activée par le récepteur de l’insuline : Foxo1 est alors redirigé vers le cytosol, et la transcription de PGC-1α est réprimée. Cependant, PGC-1α, en coopération avec PPARα, peut induire l’expression de TRB-3, un inhibiteur de la protéine kinase B. Foxo1 peut également interagir avec la protéine PGC-1α au même titre que le facteur de transcription hépatique HNF-4α ou le récepteur des glucocorticoïdes, pour coactiver la transcription des gènes de la néoglucogenèse. L’interaction de PGC-1α avec HNF-4α∈serait inhibée par le facteur de transcription SREBP-1. Prot G : protéine G ; AC : adénylyl cyclase ; AMPc : AMP cyclique ; PKA : protéine kinase A ; PI3K : phosphatidyl inositol 3 kinase ; CREB : cAMP responsive element binding protein ; Foxo1 (ou FKHR) : forkhead transcription factor 1 ; GR : glucocorticoid receptor ; HNF-4α : hepatocyte nuclear factor-4α ; PKB : protéine kinase B (Akt) ; SREBP-1 : sterol regulatory element-binding transcription factor 1 ; PEPCK : phosphoénolpyruvate carboxykinase ; F-1,6-BPase : fructose-1,6-biphosphatase ; G-6-Pase : glucose-6-phosphatase.