Abstracts
Résumé
L’azadirachtine serait, selon la littérature, la principale composante à propriétés insecticides dans les extraits de neem, Azadirachta indica, bien que d’autres composés présents dans les extraits peuvent affecter le pouvoir insecticide. Un bioessai a été mis au point pour évaluer le pouvoir insecticide d’extraits de neem en comparaison avec celui d’un produit de référence. Le bioessai a été réalisé à l’aide de larves de drosophile (Drosophila melanogaster) placées sur une diète contenant différentes concentrations de BioNEEM® (Safer). Après 14 jours, les pourcentages d’émergence ont été déterminés afin d’obtenir une courbe d’émergence en fonction de la dose d’azadirachtine. Des analyses par CLHP (Chromatographie liquide haute performance) ont été effectuées sur le BioNEEM® et sur plusieurs extraits de neem pour permettre une comparaison entre les résultats obtenus par bioessai et la quantité d’azadirachtine contenue dans l’extrait. Aucune relation entre la quantité d’azadirachtine et le pouvoir insecticide des extraits de neem testés n’a été trouvée. Ces résultats soulignent l’importance d’évaluer l’effet total insecticide des extraits de neem et non pas uniquement leur concentration en azadirachtine.
Abstract
According to the literature, azadirachtin is the major component with insecticidal effect in neem extract, Azadirachta indica. However, other components in the extract can affect its insecticidal potency. A bioassay was developed to determine the insecticidal effect of neem extracts in comparison to a reference product. The bioassay was carried out using drosophila (Drosophila melanogaster) larvae placed on a diet containing various concentrations of BioNEEM® (Safer). After 14 days, the percentage of emergence was calculated to obtain an emergence curve as a function of azadirachtin concentration. HPLC (High Performance Liquid Chromatography) analyses were performed on BioNEEM® and other neem extracts to allow a comparison between the results obtained with the bioassay and the quantity of azadirachtin in the extract. No relation between the quantity of azadirachtin and insecticidal effect was found. These results emphasize the importance of evaluating the total insecticidal activity of neem extracts and not only their concentration in azadirachtin.
Article body
Introduction
Les extraits des graines de neem, Azadirachta indica A. Juss (Meliaceae), renferment un mélange de plus de 100 composés (Addea-Mensah 1998). Parmi ceux-ci, l’azadirachtine (C35H14O16) serait l’un des bio-insecticides les plus importants (Mordue et Blackwell 1993; Schmutterer 1990; Zongo et al. 1993). À maturité, l’arbre de neem peut produire jusqu’à 50 kg de fruits, ce qui équivaut à 30 kg de graines; celles-ci constituent la principale source de composés à propriétés insecticides, dont l’azadirachtine (Roger 1992; Schmutterer 1990). Cependant la quantité d’azadirachtine contenue dans les graines varie considérablement selon les conditions climatiques, les conditions du sol et le génotype de l’arbre (Ermel et al. 1986; Singh 1986). D’une année à l’autre, un arbre peut donc produire des extraits qui contiennent des quantités différentes d’azadirachtine.
De façon générale, les recherches effectuées jusqu’à maintenant ont utilisé la concentration en azadirachtine comme principale variable prédictive du pouvoir insecticide des extraits de neem. Nous pouvons, à l’aide de la chromatographie liquide haute performance (CLHP), mesurer le pourcentage en azadirachtine d’un extrait donné. La détermination de la teneur en azadirachtine ne semble cependant pas suffire, à elle seule, à expliquer les propriétés insecticides d’un cocktail de substances pouvant agir en synergie ou en antagonisme. Certains ont démontré que ce n’est pas seulement l’azadirachtine qui est responsable de la mortalité des insectes testés, mais bien un mélange de plusieurs substances présentes dans l’extrait (Mordue et Blackwell 1993; Schmutterer 1990). Une approche alternative est proposée par l’utilisation d’un bioessai permettant de déterminer ce pouvoir insecticide. Ce bioessai se veut un substitut aux analyses chimiques de haute technicité; l’état actuel des connaissances sur le pouvoir insecticide des divers composants d’un extrait de neem n’est pas suffisant pour estimer de façon précise le pouvoir insecticide total d’un extrait de neem par une méthode analytique telle que le CLHP.
Matériel et méthodes
Courbe de référence
Le BioNEEM de Safer® a été utilisé pour mettre au point le bioessai. L’étiquette de ce produit mentionne une concentration de 900 ppm d’azadirachtine mais des tests en chromatographie ont établi que cette concentration était plutôt de 1100 ppm (voir plus loin). Cette concentration a donc été utilisée pour la suite des essais. Chaque gobelet (29,5 mL) utilisé, pour le bioessai, contenait 4 g de diète pour drosophile (Sigma), 4,5 μL d’acide phosphorique à 98 % (H3PO4), 40,5 μL d’acide propionique à 99 % (C3H6O2), une dose de BioNEEM® qui a été complétée avec de l’eau distillée pour obtenir 5 mL et 10 larves de drosophile, Drosophila melanogaster Meigen [Diptera : Drosophilidae] de 4-5 j. Huit doses de BioNEEM® ont été testées dans un seul bloc : 0; 0,2; 0,4; 0,8; 1,4; 2,0; 4,0 et 6,0 % ce qui correspond respectivement à 0; 2,2; 4,4; 8,8; 15,4; 22; 44 et 66 ppm d’azadirachtine dans la diète; chaque bloc a été répliqué 50 fois. L’eau, le BioNEEM® et les acides ont été mélangés ensemble et incorporés à la diète dans le gobelet. Par la suite, les larves de drosophile y ont été déposées. Les gobelets ont été placés à 24°C, 60 % d’humidité relative et une photopériode 16L:8O pour une durée de 14 j. Au 14e j, les adultes émergés ont été dénombrés pour obtenir le pourcentage d’émergence.
Analyse par chromatographie liquide haute performance (Schroeder et Nakanishi 1987)
Le dosage de l’azadirachtine a été effectué par chromatographie liquide haute performance (CLHP) pour le BioNEEM® ainsi que pour chacun des extraits testés avec le bioessai. Les analyses ont été réalisées à l’aide d’un appareil de marque Hewlett Packard séries 1050, muni d’un détecteur UV-Visible et d’une pompe quaternaire. La séparation a été effectuée en mode isocratique sur une colonne Supelcosil LC-18 (Supelco) d’une longueur de 25 cm et d’un diam de 4,6 mm, contenant des particules de 5 μm. L’éluant utilisé, un mélange (43:57) d’acétonitrile (grade CLHP) et d’eau tridistillée, était élué au rythme de 1 mL min-1 pendant que la température était maintenue à 35°C. La longueur d’onde de détection était de 214 nm.
Chaque échantillon a été dilué 10 fois dans du méthanol, puis filtré sur un filtre seringue (0,45 μm) avant l’injection. Le volume était injecté dans une boucle d’injection de 20 μL, chaque échantillon ayant été injecté deux fois. Une moyenne de la surface des pics a été évaluée pour chaque injection. La calibration a été réalisée à partir de sept solutions d’azadirachtine (95 % pure; Sigma) dont les concentrations allaient de 6,25 à 250 ppm (r = 0,998).
Extraits de neem testés avec le bioessai
Onze extraits de neem ont été testés pour déterminer leur pouvoir insecticide à l’aide du bioessai. Le bioessai décrit précédemment permet de tester des solutions contenant entre 0,5 et 25 ppm d’azadirachtine. En se basant sur les analyses de CLHP, des solutions de chaque extrait ont été préparées dans cette fourchette de concentration. Les résultats des bioessais sont présentés pour la concentration initiale. La mortalité des larves de drosophile prédit une concentration d’azadirachtine qui a été comparée à la concentration obtenue par CLHP. Les bioessais ont été effectués dans les mêmes conditions d’expérimentation que celles discutées pour le BioNEEM®. Tous les extraits de tourteaux (résidus solides obtenus après extraction de l’huile des graines ou des fruits) provenaient du Burkina Faso; pour l’extrait 11, les tourteaux avaient été exposés au soleil pour une période de 6 mois dans le but de dégrader complètement l’azadirachtine.
Statistiques
BioNEEM®: Une analyse Probit (SAS Institute 2001) a été effectuée pour établir la courbe de référence.
Extraits de neem : Le bioessai nous permettait de prédire, à partir du pourcentage d’émergence des drosophiles, une concentration d’azadirachtine pour les différents extraits (Fig. 1). Cette concentration prédite a ensuite été comparée à la concentration en azadirachtine calculée par CLHP. Ces données ont été utilisées pour décrire la valeur du bioessai mais les pourcentages calculés et mesurés n’ont pas été comparés statistiquement.
Figure 1
Courbe d’émergence des adultes de drosophile en fonction de la concentration d’azadirachtine testée (les points représentent les valeurs réelles obtenues), N=50
Résultats
Courbes de référence et valeur par CLHP du BioNEEM®
L’analyse Probit des résultats obtenus donne l’équation suivante : Log de l’émergence = 4,419 – 3,143 Log (dose). Nous avons obtenu une courbe classique de réponse à un pesticide (Fig. 1). À des concentrations d’azadirachtine inférieures à 4,4 ppm, le pourcentage d’émergence des drosophiles était de 80 % ou plus. Par contre, ce pourcentage d’émergence diminue rapidement lorsque la concentration dépasse 4,4 ppm pour atteindre 3 % d’émergence à une concentration de 22 ppm d’azadirachtine.
L’analyse par CLHP du BioNEEM® a révélé que sa concentration en azadirachtine était de 1100 ppm, soit 200 ppm de plus que la concentration indiquée sur l’étiquette (900 ppm).
Extraits de neem testés avec le bioessai et par CLHP
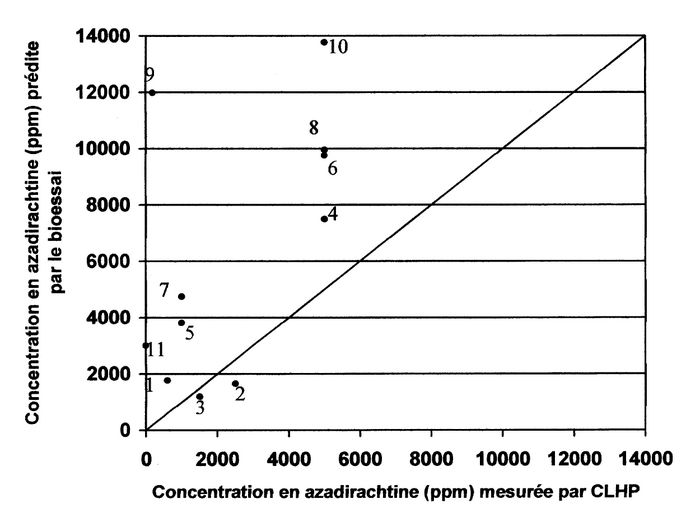
Pour les extraits de neem testés, la concentration d’azadirachtine prédite par le bioessai a été généralement supérieure à la quantité d’azadirachtine déterminée par CLHP (Fig. 2).
Figure 2
Représentation graphique de la relation entre la concentration en azadirachtine, mesurée par CLHP, des extraits de neem testés, et la concentration prédite par le bioessai
Discussion
Si l’azadirachtine était le seul composé déterminant le pouvoir insecticide d’un extrait de neem, une relation étroite aurait été observée entre la quantité d’azadirachtine mesurée par CLHP et la quantité d’azadirachtine prédite par le bioessai. Cependant, sauf pour les extraits 2 et 3 (Fig. 2), la concentration en azadirachtine prédite par le bioessai s’est révélée supérieure à celle calculée par CLHP. Par exemple, pour l’extrait 10, une concentration d’azadirachtine de 5000 ppm a été mesurée par CLHP alors que le bioessai générait une prédiction de 13 800 ppm, donc un pouvoir insecticide beaucoup plus grand. Ce résultat suggère qu’un ou plusieurs autres composés, probablement des limonoïdes (Schmutterer 1990), causent une mortalité additionnelle équivalent à 8800 ppm d’azadirachtine. L’exemple le plus probant est celui de l’extrait 11, duquel l’azadirachtine de cet extrait avait été dégradé par exposition au soleil (l’analyse par CLHP a confirmé qu’il ne restait aucune trace d’azadirachtine dans l’échantillon). Si l’azadirachtine déterminait, à lui seul, le pouvoir insecticide d’un extrait, aucun effet insecticide n’aurait été observé pour cet échantillon. Or, le bioessai prédit une concentration en azadirachtine de 3000 ppm, une concentration supérieure à celle de l’extrait 2 dont la concentration en azadirachtine a été évaluée à 2500 ppm par CLHP. Ces observations montrent qu’il est important de déterminer correctement le pouvoir insecticide des extraits de neem en utilisant une méthode plus adéquate que la quantification de l’azadirachtine par CLHP; ce n’est pas seulement l’azadirachtine qui détermine le pouvoir insecticide de l’extrait, mais bien le mélange de plusieurs composés. À deux reprises (extraits 2 et 3), la quantité d’azadirachtine prédite par le bioessai a été légèrement inférieure à ce que nous avions prédit en se basant sur la concentration en azadirachtine calculée par CLHP. Cette observation suggère que la valeur obtenue par CLHP génère, en général, une estimation de la valeur minimale du pouvoir insecticide. Les composés, faisant partie des extraits, devraient faire l’objet d’une évaluation de leurs effets insecticides (synergiques ou antagonistes) et ainsi mieux prédire le pouvoir insecticide d’un extrait à partir d’une quantification CLHP des divers composés contenus dans un extrait.
Appendices
Remerciements
Les auteurs remercient Moussa Savadogo de l’IRSAT pour son implication technique, le Centre de recherche en développement international (CRDI) pour le financement du projet Bioinsecticide (Afrique 55239) ainsi que Marcel Brosseau de Pronatex pour son implication dans le projet.
Références
- Addea-Mensah, I. 1998. The uses of the neem (Azadirachta indica) in Ghana and their relations of the chemical constituents and biological activities. Proc. seminar held Dodowa: the potentials of the neem trees in Ghana. p. 11-26.
- Ermel, K.E., E. Pahlich et H. Schmutterer. 1986. Azadirachtin content of neem kernels from different geographical locations, and its dependence on temperature, relative humidity and light. Proc. 3rd Int. Neem Conf. Nairobi, Kenya. p. 171-184.
- Mordue, A.J. et A. Blackwell. 1993. Azadirachtin: an update. J. Insect Physiol. 39 : 903-924.
- Roger, C. 1992. Impact des pesticides chimiques et biologiques sur la survie et l’efficacité de prédation de Coleomegilla maculata lengi Timberlake (Coleoptera : Coccinellidae). Mémoire de maîtrise en biologie. Université du Québec à Montréal, Québec, Canada. 76 pp.
- SAS Institute. 2001. SAS user’s guide, version 8.2. SAS Institute, Cary, NC. 1596 pp.
- Schmutterer, H. 1990. Properties and potential of natural pesticides from the neem tree, Azadirachta indica. Annu. Rev. Entomol. 35 : 271-297.
- Schroeder, D.R. et K. Nakanishi. 1987. A simplified isolation procedure for azadirachtin. J. Nat. Prod. 50 : 241-244.
- Singh, R.P. 1986. Comparison of antifeedant efficacy and extract yields from different parts and ecotypes of neem (Azadirachta indica A. Juss.) trees. Proc. 3rd Int. Neem Conf. Nairobi, Kenya. p. 185-194.
- Zongo, J.O., C. Vincent et R.K. Stewart. 1993. Effects of neem seed kernel extracts on egg and larval survival of the sorghum shoot fly, Atherigona soccata Rondani (Dipt.: Muscidae). J. Appl. Entomol. 115 : 363-369.
List of figures
Figure 1
Courbe d’émergence des adultes de drosophile en fonction de la concentration d’azadirachtine testée (les points représentent les valeurs réelles obtenues), N=50
Figure 2
Représentation graphique de la relation entre la concentration en azadirachtine, mesurée par CLHP, des extraits de neem testés, et la concentration prédite par le bioessai