Corps de l’article
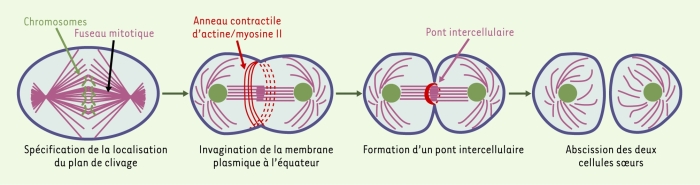
La cytocinèse est le processus qui permet la séparation physique des deux cellules filles en fin de mitose. Dans les cellules animales, elle se caractérise par la présence d’un sillon de clivage qui déforme la membrane plasmique de la cellule mère (le plus souvent à l’équateur et de manière symétrique), et se contracte jusqu’à la division en deux cellules individualisées (Figure 1). Cette étape cruciale de la division cellulaire intervient après la ségrégation des chromosomes, et conduit à la partition du patrimoine génétique, du cytoplasme et des organites intracellulaires dans chacune des cellules filles. La cytocinèse fascine les biologistes et les physiciens depuis plus de 100 ans tant en raison de ses aspects spectaculaires (la division d’une cellule en deux) que pour ses implications médicales (un défaut de cytocinèse empêche de facto la prolifération cellulaire mais peut aussi être à l’origine d’une ségrégation inégale du patrimoine génétique [aneuploïdie] caractéristique de nombreux cancers).
Figure 1
Étapes de la cytocinèse conduisant à la séparation physique des deux cellules soeurs.
Des dizaines d’années d’expérimentation (en particulier sur des embryons d’invertébrés marins) ont tout d’abord permis d’élucider deux aspects clés de la cytocinèse : les microtubules du fuseau mitotique dictent la position du sillon de clivage ; et l’invagination de la membrane est associée à la contraction d’un anneau cortical interne d’actine/myosine II [1]. Une combinaison d’approches morphologiques, biochimiques et génétiques a permis d’appréhender les bases moléculaires du fonctionnement de l’anneau contractile. En particulier, une GTPase (RhoA), après activation par un facteur d’échange spécifique pour la cytocinèse (Pebble/Ect2), contrôle l’activité de kinases (citron kinase et ROCK) qui contrôle par phosphorylation l’activité motrice de la myosine II et donc la contraction des filaments d’actine associés. D’autres voies parallèles en aval de RhoA, mettant en jeu notamment les protéines diaphanous/cyk1, profiline et cofiline, contrôlent plus spécifiquement la polymérisation/dépolymérisation de l’actine au cours de la cytocinèse [2].
Bien que le fonctionnement de l’anneau contractile soit probablement l’aspect de la cytocinèse le mieux compris à l’heure actuelle, la contribution de l’actine est plus complexe qu’initialement proposée, notamment dans le contrôle de la rigidité corticale qui doit s’adapter à l’élongation cellulaire -pendant l’anaphase B- associée aux étapes finales de la division cellulaire ([3] et nos travaux en cours). Par ailleurs, si l’anneau contractile contribue bien à l’invagination rapide et poussée du sillon dans la première phase de la cytocinèse, des éléments structuraux du fuseau empêchent le clivage final en deux cellules filles. En effet, à mesure que le fuseau mitotique s’allonge pendant l’ana-phase B - ce qui contribue à une ségrégation efficace des chromosomes -, il évolue vers une structure dense, majoritairement constituée de microtubules antiparallèles non kinétochoriens qui se retrouve en travers du sillon de clivage. De plus, la contraction de l’anneau d’actine ne permet pas la fusion des membranes cellulaires opposées, une étape requise pour la séparation topologique des deux cellules filles. Comme W. Flemming le notait en 1891, les cellules restent au contraire connectées par un pont intercellulaire souvent appelé midbody, le temps nécessaire à l’abscission en deux cellules indépendantes [4] (Figure 1). De manière surprenante, des expériences de micro-injection dans des cellules de mammifère en culture ont montré que le pont permet le passage de molécules entre deux cellules soeurs connectées pendant des heures, dans certains cas jusqu’en G2 du cycle cellulaire suivant la mitose [5] ! Ce pont intercellulaire, riche en microtubules et en structures/vésicules membranaires, perdure donc bien après le désassemblage de l’anneau contractile et peu de choses sont connues aujourd’hui des mécanismes moléculaires conduisant à sa formation, à sa stabilisation et finalement à sa résolution [6]. Ce pont intercellulaire est apparemment essentiel aux étapes finales de la cytocinèse (des protéines nécessaires à l’abscission s’y trouvent en effet localisées), et différentes approches tentent actuellement d’en cerner la fonction afin de mieux comprendre les étapes tardives, moins explorées, de la cytocinèse [7].
Une approche particulièrement fructueuse, récemment publiée, a défini le protéome du midbody des cellules de mammifères [8]. Une préparation fortement enrichie en midbodies a tout d’abord été obtenue à partir de cellules CHO synchronisées. Sur les 577 protéines identifiées par spectrométrie de masse, 160 ont été étudiées plus en détail, les autres ayant été écartées car elles provenaient d’une possible contamination par des protéines mitochondriales, nucléaires et ribosomiques. Les auteurs ont ensuite inactivé fonctionnellement chacun des gènes orthologues correspondants par interférence ARN chez C. elegans et analysé le phénotype au cours des premières divisions embryonnaires. Un résultat remarquable est que l’inactivation de près de 60 % des gènes a entraîné des défauts de cytocinèse chez C. elegans (défauts mitotiques précoces ou tardifs, et/ou dans la lignée germinale), suggérant que les orthologues humains sont requis à des étapes similaires de la division cellulaire. Cette combinaison exceptionnelle d’approches protéomiques et génomiques à grande échelle a considérablement enrichi le répertoire connu des gènes indispensables à la cytocinèse : sur la centaine de gènes dont la mutation entraînait un phénotype, 16 étaient déjà connus chez C. elegans et 57 dans d’autres systèmes modèles (drosophile, S. pombe, Dictyostelium, mammifères, etc.). Il n’est évidemment pas possible d’énumérer tous les gènes découverts, mais la majorité codent pour des protéines impliquées dans le trafic membranaire (annexines, dynamines, rab7, transporteurs GLUT1 et GLUT4, COPI), des protéines associées à l’actine (Arp2, Arp3), aux microtubules (CLIP-170, dynéine/dynactine, Huntingtin interacting protein 1, kinésine KIF4, Rabkinesin-6), ou pour des kinases (Aurora B, cdc2). Bien que la fonction précise de ces molécules pendant la cytocinèse ne soit pas encore définie, ce type d’approche a permis de mettre en lumière des liens inattendus : par exemple, entre des protéines impliquées à la fois dans la voie de sécrétion, la cytocinèse et l’alignement correct des chromosomes en métaphase, ou entre des protéines communes à la cytocinèse et aux fonctions neuronales/musculaires. Il est également à noter que 14 % des protéines ainsi identifiées sont impliquées dans des maladies humaines (entre autres : surdité, scléroses, mélanomes ou leucémies).
Signalons que, du fait du mode de préparation des midbodies, un certain nombre de gènes essentiels à la cytocinèse (par exemple, RhoA) n’ont pu être identifiés par ce type d’étude. D’autres équipes s’attachent actuellement à inactiver systématiquement la fonction de chacun des gènes d’un organisme, et à identifier ceux qui sont essentiels pour la cytocinèse (par exemple, dans des cultures cellulaires de drosophile : voir pour une étude à moyenne échelle [9] et nos travaux à l’échelle génomique [10]). De façon similaire aux résultats décrits chez C. elegans [8], nous avons pu mettre en évidence un rôle tardif du trafic membranaire au moment de l’abscission [10].
En conclusion, les approches génomiques actuelles par génétique inverse fondée sur l’interférence par l’ARN à grande échelle (principalement dans les organismes modèles, C. elegans et drosophile, mais demain chez l’homme) sont en train de révolutionner la compréhension des phénomènes cellulaires complexes, comme la cytocinèse. L’intégration temporelle et spatiale de ce nombre considérable de données commence tout juste à émerger [11, 12] et constituera un défi pour les biologistes cellulaires.
Parties annexes
Références
- 1. Glotzer M. Animal cell cytokinesis. Annu Rev Cell Dev Biol 2001 ; 17 : 351-86.
- 2. Prokopenko SR, Saint R, Bellen HJ. Untying the Gordian knot of cytokinesis. Role of small G proteins and their regulators. J Cell Biol 2000 ; 148 : 843-8.
- 3. O’Connell CB, Warner AK, Wang Y. Distinct roles of the equatorial and polar cortices in the cleavage of adherent cells. Curr Biol 2001 ; 11 : 702-7.
- 4. Paweletz N. Walter Flemming : pioneer of mitosis research. Nat Rev Mol Cell Biol 2001 ; 2 : 72-5.
- 5. Schulze ES, Blose SH. Passage of molecules across the intercellular bridge between post-mitotic daughter cells. Exp Cell Res 1984 ; 151 : 367-73.
- 6. Piel M, Nordberg J, Euteneuer U, Bornens M. Centrosome-dependent exit of cytokinesis in animal cells. Science 2001 ; 291 : 1550-3.
- 7. Schweitzer JK, D’Souza-Schorey C. Finishing the job : cytoskeletal and membrane events bring cytokinesis to an end. Exp Cell Res 2004 ; 295 : 1-8.
- 8. Skop AR, Liu H, Yates J 3rd, et al. Dissection of the mammalian midbody proteome reveals conserved cytokinesis mechanisms. Science 2004 ; 305 : 61-6.
- 9. Kiger A, Baum B, Jones S, et al. A functional genomic analysis of cell morphology using RNA interference. J Biol 2003 ; 2 : 27.
- 10. Echard A, Hickson GR, Foley E, O’Farrell PH. Terminal cytokinesis events uncovered after an RNAi screen. Curr Biol 2004 ; 14 (sous presse).
- 11. Gonzalez C. Cell division : the place and time of cytokinesis. Curr Biol 2003 ; 13 : R363-5.
- 12. Pollard TD. Functional genomics of cell morphology using RNA interference : pick your style, broad or deep. J Biol 2003 ; 2 : 25.
Liste des figures
Figure 1
Étapes de la cytocinèse conduisant à la séparation physique des deux cellules soeurs.