Résumés
Résumé
On assiste depuis les dernières décennies à une augmentation des anomalies de la différenciation de l’appareil génital mâle (hypospadias, cryptorchidisme) et du cancer du testicule, ainsi qu’à une diminution quantitative et qualitative de la production de spermatozoïdes. Des études épidémiologiques ont mis en relation ces altérations avec des modifications de l’environnement, et notamment avec l’exposition croissante à des molécules agonistes des oestrogènes ou antagonistes des androgènes. Des données cliniques et expérimentales laissent penser que ces xéno-oestrogènes agiraient pendant la vie foetale et néonatale en induisant des anomalies du développement testiculaire, responsables des altérations observées chez l’adulte. Nous avons effectivement démontré que les oestrogènes endogènes inhibent physiologiquement le développement du testicule foetal.
Summary
Estrogens are classically known to play a major role in female reproduction, but there is now compelling evidence that they may also be involved in the regulation of male reproductive function. In humans, a decrease in sperm count and an increase in the incidences of testicular cancer, cryptorchidism and hypospadia have been observed in many countries over the last 50 years. Male reproductive alterations were also observed in wildlife. Such male reproductive disorders have been attributed to the increase in concentration of xenobiotics, and of xenoestrogens in particular, in the environment and in food. Epidemiological, clinical and experimental studies have suggested that excessive exposure to estrogens during fetal/neonatal life can lead to reproductive disorders in adulthood. Using an in vitro model, we showed that estrogens directly affected the development of the fetal testis. Lastly, we clearly demonstrated that the fetal and neonatal testis is very sensitive to estrogens since the invalidation of estrogen receptor α leads to an increase of steroidogenesis and the invalidation of estrogen receptor β enhances the development of the germ cell lineage in the male.
Corps de l’article
Les inquiétudes vis-à-vis des changements survenus dans l’environnement et de leurs conséquences possibles sur la fonction de reproduction humaine et animale se sont amplifiées au cours des dernières décennies.
Altérations des fonctions de l’appareil reproducteur mâle
On a ainsi observé une augmentation de diverses anomalies des capacités reproductives de certaines espèces aquatiques, ainsi qu’une baisse qualitative et quantitative de la production spermatique humaine [1, 2]. En outre, l’incidence du cancer du testicule (qui est le cancer le plus fréquent chez l’homme jeune) s’est accrue de façon régulière au cours des vingt dernières années, dans tous les pays où des études ont été réalisées [3]. Enfin, il semble que l’incidence de plusieurs affections du tractus génital mâle soit aussi en augmentation [4] : c’est le cas du cryptorchidisme (non descente des testicules dans le scrotum), qui s’observe chez 2 % à 4 % des nouveau-nés, et de l’hypospadias (abouchement ectopique de l’urètre), qui atteint 0,3 % à 0,7 % des garçons à la naissance (Figure 1).
Figure 1
Évolution du nombre de spermatozoïdes et des anomalies de l’appareil de reproduction masculin au cours des dernières décennies (d’après [2, 4]).
Différents arguments laissent penser que ces anomalies sont liées entre elles : ainsi, une étude comparative réalisée dans différents pays européens montre que l’incidence de chacune de ces quatre altérations (qualité du sperme, cancer testiculaire, cryptorchidisme et hypospadias) est maximale au Danemark et minimale en Finlande [3]. En outre, il est clairement établi que le cryptorchidisme est un facteur de risque des trois autres altérations, et que l’hypospadias et l’oligospermie sont des facteurs de risque du cancer testiculaire [2]. Enfin, la fertilité est diminuée chez les hommes qui développeront ultérieurement un cancer testiculaire [5]. Ainsi, ces quatre altérations correspondraient vraisemblablement à différents symptômes d’un même syndrome : le syndrome de dysgénésie testiculaire (TDS) [5].
Hypothèse d’une perturbation du développement testiculaire pendant la vie foetale
Les deux grandes fonctions testiculaires (gamétogenèse et stéroïdogenèse) se mettent en place dès la vie foetale. Les cellules de Sertoli sont les premières cellules à se différencier : elles englobent les cellules germinales, alors appelées gonocytes, pour former les cordons séminifères dès 12 jours postconception (jpc) chez la souris, 13,5 jpc chez le rat et 42-45 jours chez l’homme. Elles se multiplient activement jusqu’à la puberté, et ne seront ensuite jamais renouvelées au cours de la vie de l’individu. Les cellules germinales se forment dans l’épiblaste et migrent à travers les territoires extra-embryonnaires et embryonnaires jusqu’aux crêtes génitales. Lors de cette migration, puis dans la gonade, les cellules germinales prolifèrent activement, puis se différencieront en spermatogonies souches après la naissance. Les cellules de Leydig foetales se différencient peu de temps après les cellules de Sertoli et secrètent deux hormones nécessaires à la masculinisation du foetus : la testostérone et l’insulin like hormone 3 (Insl 3) [6].
L’hypothèse actuellement la plus plausible est que le syndrome de dysgénésie testiculaire (TDS) décrit plus haut ait pour origine une altération du développement du testicule foetal [2, 5] (Figure 2). De fait, l’hypospadias résulte d’un défaut de production ou d’action des androgènes pendant la vie foetale. Le cryptorchidisme, quant à lui, résulte d’anomalies de la production ou de l’action de l’Insl 3 ou des androgènes, qui régulent respectivement la descente transabdominale et transinguinale des testicules [7]. En ce qui concerne le cancer testiculaire, bien que son origine cellulaire reste hypothétique, plusieurs arguments suggèrent que les cellules tumorales proviendraient de gonocytes ne s’étant pas différenciés normalement en spermatogonies [5] : en effet, les cellules tumorales des premiers stades du cancer (carcinome in situ, CIS) ont les mêmes caractéristiques morphologiques et expriment les mêmes marqueurs immunohistochimiques (phosphatase alcaline, c-kit…) que les gonocytes [8] ; en outre, des CIS ont été découverts chez des enfants âgés de quelques mois, ce qui renforce l’hypothèse d’une origine foetale des cellules cancéreuses. Enfin, la diminution de la production spermatique chez l’adulte peut résulter de dysfonctionnements très variés : le contrôle de la spermatogenèse, qui reste encore largement méconnu, implique en effet des régulations endocrines, intratesticulaires et intragerminales extraordinairement complexes. Nous avons vu que c’est pendant le développement du testicule foetal que se met en place le stock de gonocytes qui deviendront les spermatogonies souches de l’adulte. En outre, la réduction expérimentale du nombre de gonocytes pendant la vie foetale provoque une diminution de la production spermatique adulte. Il en est de même après réduction expérimentale du nombre de cellules de Sertoli pendant la vie périnatale [9]. Ainsi, la production spermatique adulte dépend en partie de la gamétogenèse foetale et de la capacité des gonocytes à se transformer en spermatogonies souches.
Figure 2
Origines foetales de l’altération des fonctions de reproduction masculine.
Effets délétères des xéno-oestrogènes
De nombreuses observations et expériences réalisées au cours des vingt dernières années confortent l’hypothèse initialement formulée par Sharpe et Skakkebaek, en 1993, selon laquelle les problèmes répertoriés dans le domaine de la reproduction masculine pourraient résulter d’effets délétères, pendant la vie foetale, de polluants chimiques dont la diversité et la concentration dans l’environnement augmentent régulièrement [2, 3, 10]. Les principaux polluants chimiques incriminés sont les perturbateurs endocriniens à activité oestrogénique (xéno-oestrogènes) ou à effet anti-androgénique. Il s’agit entre autres de pesticides, d’agents plastifiants, de surfactants et de phytooestrogènes essentiellement présents dans l’alimentation et, plus accessoirement, dans l’atmosphère.
Le premier argument en faveur de cette hypothèse concerne l’étude de la faune sauvage. En effet, des publications ont relaté l’effet d’expositions d’animaux dans leur milieu naturel à de fortes concentrations de polluants chimiques à propriétés oestrogéniques. Les effets observés varient de changements subtils à des altérations permanentes de la fonction de reproduction, tels la féminisation ou des changements de comportement sexuels [11].
Un argument clinique essentiel concerne les anomalies observées chez les fils de femmes traitées pendant leur grossesse par le diéthylstilbestrol (DES), un agoniste fort des oestrogènes, au cours des années 50-70. Dans certaines études, ces garçons présentent une augmentation de l’incidence de malformations génitales, de cryptorchidie et de cancers testiculaires ainsi qu’une altération de la qualité du sperme [12, 13], tandis que d’autres études ne rapportent pas d’altération de la fertilité [14]. Ces contradictions pourraient être dues à la phase de la grossesse pendant laquelle a lieu le traitement, suggérant l’existence de périodes de sensibilité du testicule aux xéno-oestrogènes. Le deuxième argument clinique concerne la démonstration récente de l’influence négative des phtalates (plastifiants, que l’on retrouve dans les cosmétiques, pratiquement tous les produits en PVC et de nombreuses peintures) sur le développement de l’appareil reproducteur masculin [15] : une corrélation a été établie entre l’importance de l’exposition (mesurée par la concentration de phtalates dans l’urine des femmes pendant leur grossesse) et la diminution de la masculinisation du jeune enfant (évaluée par la diminution de la distance entre l’anus et la base du pénis et le pourcentage de descente incomplète des testicules).
Les arguments expérimentaux sont nombreux. On sait que les récepteurs des oestrogènes ERα et ERβ sont présents dans le testicule dès les premiers stades de différenciation : ERα a ainsi été détecté dans la gonade indifférenciée dès 10 jpc chez la souris ; ce récepteur est localisé dans les cellules de Leydig des testicules foetaux de rongeurs [16], mais est absent dans le testicule humain [17]. ERβ a, quant à lui, été détecté dans le testicule dès 14 jpc chez la souris : il est localisé majoritairement dans les gonocytes, mais également dans les cellules de Leydig chez la souris et dans les cellules de Sertoli chez toutes les espèces étudiées [16]. Par ailleurs, de très nombreuses données montrent que, chez les rongeurs, les mâles exposés in utero ou pendant la période néonatale à des oestrogènes exogènes (DES, éthyniloestradiol, bisphénol A…) développent un hypospadias, une altération de la descente testiculaire et une réduction plus ou moins importante de la production de spermatozoïdes [2, 5, 18]. De même, l’exposition in utero à de fortes doses d’oestrogènes induit l’apparition de cancers testiculaires à l’âge adulte chez la souris, le rat, le hamster et le chien.
Oestrogènes endogènes et développement foetal et néonatal du testicule
Alors même que les oestrogènes exogènes étaient suspectés d’avoir un effet délétère sur le développement testiculaire, le rôle des oestrogènes endogènes n’était pas connu.
L’étude de souris mâles invalidées pour les récepteurs des oestrogènes (ERα‑/‑ ou ERβ‑/‑) ou pour l’aromatase (Ar‑/‑), ainsi que l’analyse de patients ayant un déficit en aromatase et d’un individu porteur d’une mutation du récepteur α des oestrogènes ont montré que l’absence d’oestrogènes ou de certaines de leurs voies de signalisation conduit également à des perturbations de la capacité reproductrice [19]. Les souris mâles ERα‑/‑ et Ar‑/‑ sont stériles à l’âge adulte, en raison d’une insuffisance de la réabsorption de fluide dans l’épididyme chez les ERα‑/‑ et d’anomalies de la spermatogenèse chez les Ar‑/‑. Ainsi, il est clairement établi que les oestrogènes sont nécessaires aux fonctions de reproduction masculine chez l’adulte.
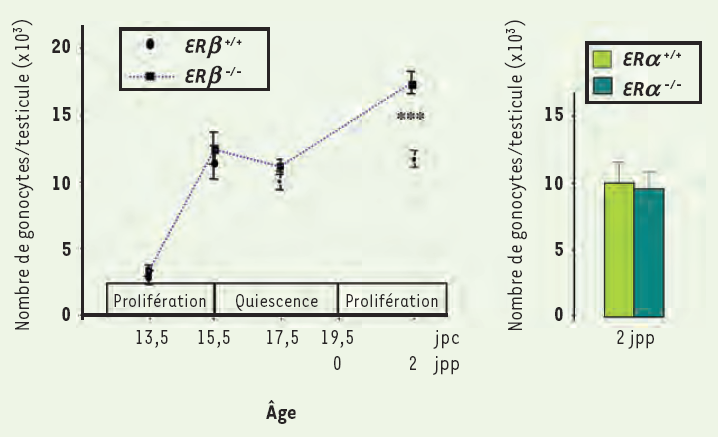
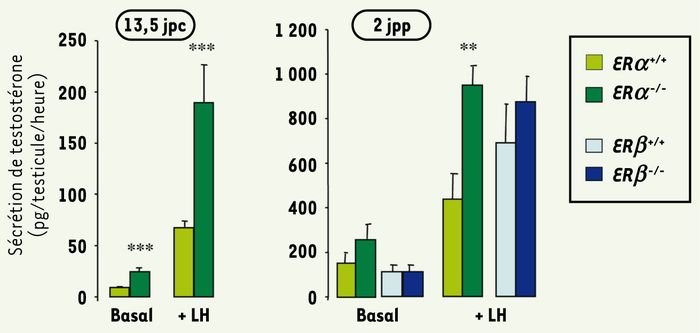
Mais ces études ne donnent pas d’information sur le rôle joué par les oestrogènes pendant la vie foetale. Nous avons récemment étudié le développement foetal et néonatal du testicule (Figure 3) chez des souris ERα‑/‑ et ERβ‑/‑ [20, 21]. Nous avons montré que l’invalidation de ERβ provoque une augmentation de 50 % du nombre de gonocytes à 2 jours post-partum (jpp) (Figure 4), qui se poursuit au moins jusqu’à 6 jpp et résulte d’une augmentation de leur activité mitotique et d’une diminution de leur activité apoptotique, sans modification du nombre de cellules de Sertoli. En revanche, l’invalidation de ERα ne modifie ni le nombre de cellules germinales, ni celui des cellules de Sertoli, mais augmente la production de testostérone (Figure 5) ; cette augmentation, qui s’observe dès 13 jpc, c’est-à-dire moins de 2 jours après que les premières cellules de Leydig se soient différenciées, résulte d’une action directe des oestrogènes sur le testicule, sans modification de la sécrétion de LH (hormone lutéinisante), au contraire de ce qui est décrit chez l’adulte où la modification du taux de LH semble jouer un rôle prédominant. L’activité de chaque cellule de Leydig foetale est augmentée, comme en témoignent leur hypertrophie et l’augmentation de l’expression des ARNm codant trois protéines impliquées dans la synthèse de testostérone : StAR, P450scc et P450c17. En revanche, l’invalidation de ERβ n’a pas d’effet sur la stéroïdogenèse testiculaire (Figure 5).
Figure 3
Histologie du testicule de souriceau nouveau-né (2 jours).
A. Cordon séminifère après coloration au bleu de Tushmann. Les flèches représentent les gonocytes, reconnaissables à leur aspect histologique : cellules de grande taille présentant un noyau de forme sphérique contenant deux ou trois nucléoles globulaires, un cytoplasme d’aspect clair et une membrane plasmique bien visible. Les pointes de flèche représentent les cellules de Sertoli, généralement situées à la périphérie des cordons, dont la membrane plasmique n’est pas visible et dont le noyau, de forme triangulaire, allongée ou sphérique est plus dense que celui des cellules germinales. B. Cellules de Leydig, situées dans l’interstitium, après révélation immunohistochimique de la 3β-hydroxy-stéroïde-déshydrogénase.
Figure 4
Évolution du nombre de gonocytes dans les testicules de souris pendant la vie foetale puis néonatale, après invalidation des récepteurs α (ERα) ou β (ERβ) des oestrogènes.
Les périodes de prolifération et de quiescence des gonocytes sont précisées le long de l’axe chronologique. Les valeurs représentent la moyenne ± SEM de 4 à 13 animaux. *** p < 0,001 par rapport aux souris sauvages en utilisant le test t de Student (d’après [20]).
Figure 5
Production de testostérone par des testicules de souris après invalidation des récepteurs α (ERα) ou β (ERβ) des oestrogènes.
Les testicules sont incubés 3 heures sur filtre en présence (+ LH) ou non (Basal) de 100 ng/ml de LH ovine. Les valeurs représentent la moyenne ± SEM de 7 à 19 animaux. ** p < 0,01, *** p < 0,001 par rapport aux souris sauvages en utilisant le test t de Student (d’après [21]).
Ces résultats montrent donc que, à la différence de ce qui se passe chez l’adulte, les oestrogènes endogènes ont un effet négatif sur les fonctions et le développement du testicule pendant la vie foetale et néonatale. Chacun des récepteurs des oestrogènes joue un rôle précis dans le développement testiculaire, ERβ étant impliqué dans la régulation du développement des cellules germinales et ERα dans celle du développement et de la fonction des cellules de Leydig.
Par ailleurs, nous avons mis au point un modèle de culture organotypique de testicule foetal ou néonatal de rat, qui permet de reproduire in vitro le développement des différents types cellulaires du testicule observé in vivo [22, 23]. En utilisant ce modèle, et dans le cadre d’une étude collaborative, nous avons démontré un effet négatif direct des oestrogènes sur le développement des trois principaux types cellulaires [24]. L’étude de l’ontogenèse des effets des oestrogènes in vitro pendant la vie foetale ou néonatale a mis en évidence l’existence de périodes critiques de sensibilité du testicule aux oestrogènes (Delbès et al., résultats non publiés).
Conclusions et perspectives
Les données expérimentales laissent penser que les effets délétères irréversibles des oestrogènes sur le développement testiculaire et la masculinisation du tractus génital ont lieu pendant le développement foetal et néonatal. Nous avons montré que les oestrogènes endogènes régulent physiologiquement le développement du testicule pendant la vie foetale puis néonatale en contrôlant les deux principales fonctions du testicule foetal et néonatal : la gamétogenèse et la stéroïdogenèse. Or nous avons vu que le dysfonctionnement de la mise en place de la lignée germinale est susceptible d’induire des cancers testiculaires et une altération de la production de spermatozoïdes. En outre, le contrôle de la sécrétion de testostérone par les oestrogènes leur confère un rôle possible dans la masculinisation du tractus génital et la descente testiculaire.
Cependant, le lien entre des effets observés à la naissance et leurs conséquences sur la fertilité adulte reste très difficile à établir, d’autant que de nombreux mécanismes de régulation de la spermatogenèse se mettent en place à la puberté. Ainsi, alors que les déficits des voies oestrogéniques ont des effets positifs chez le foetus et le nouveau-né, ces effets sont négatifs chez l’adulte. La mise en évidence des conséquences à l’âge adulte des anomalies induites par l’absence des oestrogènes ou de leurs voies de signalisation pendant la vie foetale nécessitera l’établissement de souris porteuses d’une invalidation uniquement pendant la vie foetale.
Par ailleurs, il semble qu'il existe des périodes de sensibilité du testicule aux oestrogènes pendant la vie foetale puis néonatale, cette sensibilité dépendant en plus de l’espèce et de la souche considérées [25]. Il apparaît donc important d’étudier la sensibilité du testicule foetal humain, d’autant que, contrairement à ce qui se passe chez les rongeurs, le récepteur des oestrogènes ERα n’est pas présent dans le testicule et que de nombreux variants de ERβ ont été décrits chez l’homme [17].
Enfin, l’ensemble des données expérimentales met en évidence les effets délétères de fortes doses de xéno-oestrogènes ; en revanche, il ne semble pas que l’exposition à de faibles doses s’accompagne d’effet délétère irréversible [26, 27]. La question de l’incidence directe de l’augmentation des xéno-oestrogènes dans l’environnement sur la reproduction masculine humaine reste donc posée, même si certains auteurs estiment que les perturbateurs endocriniens n’atteignent pas dans l’organisme humain des concentrations nécessaires à la manifestation de leurs effets xéno-hormonaux. Toutefois, du fait de leur caractère lipophile, ces molécules s’accumulent et leurs effets pourraient être amplifiés par une combinaison de divers xéno-oestrogènes. Le nombre grandissant d’arguments épidémiologiques et expérimentaux liant l’action des oestrogènes aux fonctions de reproduction masculine semblerait donc justifier la nécessité de mesures en matière de prévention médicale et environnementale.
L’importance du problème vient encore de s’accroître à la suite d’un travail, récent, rapportant que les rats dont l’arrière-grand-père a été intoxiqué par un perturbateur endocrinien pendant sa vie foetale ont une production spermatique inférieure à la normale [28]. Ainsi, les altérations du développement du testicule foetal, exprimées chez l’individu adulte contaminé, pourraient également être transmises aux générations suivantes par des mécanismes encore à découvrir.
Parties annexes
Références
- 1. Auger J, Kunstmann JM, Czyglik F, Jouannet P. Decline in semen quality among fertile men in Paris during the past 20 years. N Engl J Med 1995 ; 332 : 281-5.
- 2. Sharpe RM, Irvine DS. How strong is the evidence of a link between environmental chemicals and adverse effects on human reproductive health? Br Med J 2004 ; 328 : 447-51.
- 3. Toppari J, Larsen J, Christiansen P, et al. Male reproductive health and environmental xenoestrogens. Environ Health Perspect 1996 ; 104 : 741-803.
- 4. Toppari J, Kaleva M, Virtanen HE. Trends in the incidence of cryptorchidism and hypospadias, and methodological limitations of registry-based data.Hum Reprod Update 2001 ; 7 : 282-6.
- 5. Skakkebaek NE, Rajpert-De Meyts E, Main KM. Testicular dysgenesis syndrome: an increasingly common developmental disorder with environmental aspects.Hum Reprod 2001 ; 16 : 972-8.
- 6. Habert R, Lejeune H, Saez JM. Origin, differentiation and regulation of fetal and adult Leydig cells. Mol Cell Endocrinol 2001 ; 179 : 47-74.
- 7. Kubota Y, Temelcos C, Bathgate RA, et al. The role of insulin 3, testosterone, Mullerian inhibiting substance and relaxin in rat gubernacular growth.Mol Hum Reprod 2002 ; 8 : 900-5.
- 8. Rajpert-De Meyts E, Jorgensen N, Brondum-Nielsen K, et al. Developmental arrest of germ cells in the pathogenesis of germ cell neoplasia.Apmis 1998 ; 106 : 198-206.
- 9. Orth JM, Gunsalus GL, Lamperti AA. Evidence from Sertoli cell-depleted rats indicates that spermatid number in adults depends on numbers of Sertoli cells produced during perinatal development.Endocrinology 1988 ; 122 : 787-94.
- 10. Jegou B, Auger J, Multigner L, et al. The saga of the sperm count decrease in humans and wild and farm animals. In: Gagnon C, ed. The male gamete: from basic science to clinical applications. Clearwater: Cache River Press, 1999 : 446-54.
- 11. Vos JG, Dybing E, Greim HA, et al. Health effects of endocrine-disrupting chemicals on wildlife, with special reference to the European situation.Crit Rev Toxicol 2000 ; 30 : 71-133.
- 12. Glaze GM. Diethylstilbestrol exposure in utero: review of literature.J Am Osteopath Assoc 1984 ; 83 : 435-8.
- 13. Strohsnitter WC, Noller KL, Hoover RN, et al. Cancer risk in men exposed in utero to diethylstilbestrol.J Natl Cancer Inst 2001 ; 93 : 545-51.
- 14. Wilcox AJ, Baird DD, Weinberg CR, et al. Fertility in men exposed prenatally to diethylstilbestrol.N Engl J Med 1995 ; 332 : 1411-6.
- 15. Swan SH, Main KM, Lui F, et al. Decrease in anogenital distance among male infants with prenatal phtalate exposure.Environ Health Perspect 2005 ; 113 : 1056-61.
- 16. O’Donnell L, Robertson KM, Jones ME, Simpson ER. Estrogen and spermatogenesis. Endocrinol Rev 2001 ; 22 : 289-318.
- 17. Saunders PT, Sharpe RM, Williams K, et al. Differential expression of oestrogen receptor alpha and beta proteins in the testes and male reproductive system of human and non-human primates.Mol Hum Reprod 2001 ; 7 : 227-36.
- 18. Sharpe RM. The estrogen hypothesis: where do we stand now? Int J Androl 2003 ; 26 : 2-15.
- 19. Carreau S. Estrogens: male hormones? Folia Histochem Cytobiol 2003 ; 41 : 107-11.
- 20. Delbes G, Levacher C, Pairault C, et al. Estrogen receptor beta-mediated inhibition of male germ cell line development in mice by endogenous estrogens during perinatal life.Endocrinology 2004 ; 145 : 3395-403.
- 21. Delbes G, Levacher C, Duquenne C, et al. Endogenous estrogens inhibit mouse fetal Leydig cell development via estrogen receptor alpha.Endocrinology 2005 ; 146 : 2454-61.
- 22. Habert R, Devif I, Gangnerau MN, et al. Ontogenesis of the in vitro response of rat testis to gonadotropin releasing hormone. Mol Cell Endocrinol 1991 ; 82 : 199-206.
- 23. Rouiller-Fabre V, Levacher C, Pairault C, et al. Development of the fetal and neonatal testis.Andrologia 2003 ; 35 : 79-83.
- 24. Lassurguere J, Livera G, Habert R, Jegou B. Time- and dose-related effects of estradiol and diethylstilbestrol on the morphology and function of the fetal rat testis in culture.Toxicol Sci 2003 ; 73 : 160-9.
- 25. Spearow JL, Barkley M. Reassessment of models used to test xenobiotics for estrogenic potency is overdue.Hum Reprod 2001 ; 16 : 1027-9.
- 26. Atanassova N, McKinnell C, Turner K, et al. Comparative effects of neonatal exposure of male rats to potent and weak (environmental) estrogens on spermatogenesis at puberty and the relationship to adult testis size and fertility: evidence for stimulatory effects of low estrogen levels.Endocrinology 2000 ; 141 : 3898-908.
- 27. Fielden MR, Samy SM, Chou KC, Zacharewski TR. Effect of human dietary exposure levels of genistein during gestation and lactation on long-term reproductive development and sperm quality in mice.Food Chem Toxicol 2003 ; 41 : 447-54.
- 28. Anway MD, Cupp AS, Uzumcu M, Skinner MK. Epigenetic transgenerational actions of endocrine disruptors and male fertility. Science 2005 ; 308 : 1466-9.
Liste des figures
Figure 1
Évolution du nombre de spermatozoïdes et des anomalies de l’appareil de reproduction masculin au cours des dernières décennies (d’après [2, 4]).
Figure 2
Origines foetales de l’altération des fonctions de reproduction masculine.
Figure 3
Histologie du testicule de souriceau nouveau-né (2 jours).
A. Cordon séminifère après coloration au bleu de Tushmann. Les flèches représentent les gonocytes, reconnaissables à leur aspect histologique : cellules de grande taille présentant un noyau de forme sphérique contenant deux ou trois nucléoles globulaires, un cytoplasme d’aspect clair et une membrane plasmique bien visible. Les pointes de flèche représentent les cellules de Sertoli, généralement situées à la périphérie des cordons, dont la membrane plasmique n’est pas visible et dont le noyau, de forme triangulaire, allongée ou sphérique est plus dense que celui des cellules germinales. B. Cellules de Leydig, situées dans l’interstitium, après révélation immunohistochimique de la 3β-hydroxy-stéroïde-déshydrogénase.
Figure 4
Évolution du nombre de gonocytes dans les testicules de souris pendant la vie foetale puis néonatale, après invalidation des récepteurs α (ERα) ou β (ERβ) des oestrogènes.
Figure 5
Production de testostérone par des testicules de souris après invalidation des récepteurs α (ERα) ou β (ERβ) des oestrogènes.



![Évolution du nombre de spermatozoïdes et des anomalies de l’appareil de reproduction masculin au cours des dernières décennies (d’après [2, 4]).](/fr/revues/ms/2005-v21-n12-ms1023/012016ar/media/012016arf001n.png)