Corps de l’article
L’immunothérapie reposant sur l’usage des lymphocytes T pour traiter le cancer suscite autant d’enthousiasme que de scepticisme. Un tel clivage tient en grande partie aux résultats contradictoires obtenus avec les deux principales approches thérapeutiques mises en oeuvre. Ainsi, la vaccination contre des antigènes associés aux tumeurs (AAT), appliquée à des sujets porteurs de tumeurs solides (ex : mélanome) n’a pas démontré, sauf rarissimes exceptions, d’effets cliniques probants [1, 2]. En revanche, l’injection de lymphocytes T allogéniques dirigés contre des antigènes mineurs d’histocompatibilité (AgMiH) s’est avérée très efficace dans le traitement des hémopathies malignes (leucémies surtout) [3, 4]. A priori, trois facteurs pourraient expliquer cette différence : (1) la nature de l’antigène cible (AAT contre AgMiH) ; (2) la méthode de traitement (vaccination ou injection de lymphocytes) ; et (3) le type de néoplasie (tumeur solide ou leucémie). De ceci émerge donc la question suivante : serait-il possible d’obtenir contre des tumeurs solides des résultats aussi favorables que contre les leucémies ?
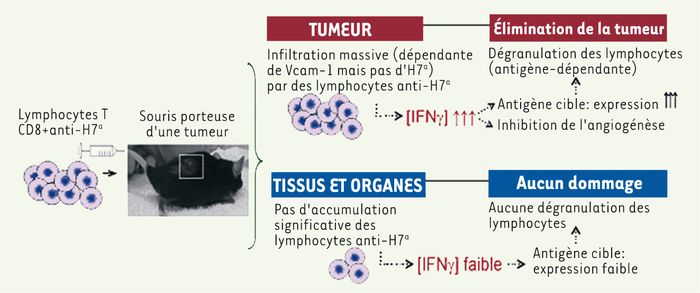
Nous avons précédemment établi que des lymphocytes T CD8 pré-activés et dirigés contre l’AgMiH H7a pouvaient guérir des souris leucémiques [5]. Nos travaux récents montrent que les mêmes lymphocytes permettent aussi d’obtenir des taux de guérison appréciables face au mélanome [6]. Fait crucial, dans les deux cas, seules les cellules cancéreuses sont attaquées par les lymphocytes anti- H7a, et ce malgré l’expression ubiquitaire d’ H7a. Ainsi, des lymphocytes T CD8 pré-activés reconnaissant un seul antigène peuvent éliminer une tumeur solide déjà établie. Nos études suggèrent que l’élimination de la tumeur se déroule en trois temps : d’abord, à la suite de leur injection chez la souris receveuse, les lymphocytes anti- H7a pré-activés s’accumulent préférentiellement au site tumoral de façon antigène-indépendante. La surexpression de Vcam-1 par l’endothélium tumoral joue un rôle primordial dans l’« attraction » des lymphocytes activés. Ces lymphocytes sécrètent ensuite localement de l’interféron-gamma (IFN-γ) inhibant l’angiogenèse tumorale et entraînant l’augmentation de l’expression des molécules du complexe majeur d’histocompatibilité (CMH) sur les cellules néoplasiques. Enfin, les lymphocytes reconnaissant leur antigène sécrètent des molécules cytotoxiques qui s’attaqueront à la tumeur (Figure 1).
Figure 1
Élimination tumorale par transfert adoptif de lymphocytes T anti-H7a.
Les lymphocytes T anti-H7a injectés à une souris porteuse de tumeur éliminent la tumeur sans causer de dommages collatéraux. Pour ce faire, ces lymphocytes migrent massivement (de façon Vcam-1-dépendante et H7a-indépendante) au site tumoral où ils sécrètent d’importantes quantités d’IFNγ. Cette sécrétion inhibe ensuite l’angiogenèse tumorale et entraîne l’augmentation de l’expression de l’antigène cible sur les cellules tumorales. Cela cause finalement une dégranulation locale des lymphocytes T anti-H7a. Parallèlement, aucune accumulation significative des lymphocytes T anti-H7a n’est observée dans les tissus et organes normaux. Car, les concentrations d’IFNγ et l’expression de H7a demeurent faibles dans ces organes et aucune dégranulation des lymphocytes n’y survient.
L’extravasation dans les tissus non-lymphoïdes, telle la tumeur, est l’apanage des cellules T effectrices et non des cellules T naïves. En effet, les cellules T effectrices ont pour fonction de migrer aux sites présentant une inflammation. Or la croissance tumorale implique une invasion tissulaire et, en conséquence, une réaction inflammatoire. Ainsi, la pré-activation des lymphocytes, avant injection au receveur, est essentielle au succès du traitement. De plus, nous avons démontré que les cellules T effectrices anti- H7a expriment fortement Vla-4 et que les néovaisseaux tumoraux surexpriment Vcam-1, le ligand de Vla-4 [6]. Cette surexpression de Vcam-1, fréquemment observée sur des néovaisseaux tumoraux, facilite l’entrée des cellules T effectrices dans la tumeur.
Comme nous l’avons mentionné précédemment, la sécrétion intra-tumorale d’IFNγ induit une inhibition de l’angiogenèse. Cette inhibition est primordiale car elle limite la croissance tumorale en deçà d’un seuil critique. Le résultat final de l’immunothérapie, guérison ou échec, dépend d’une course entre cellules tumorales et cellules T. Privée de néovaisseaux, la prolifération des cellules tumorales demeure limitée [7]. On a vu que l’IFNγ induit l’expression des molécules du CMH dans la tumeur. À l’état basal, les gènes du CMH sont peu exprimés par les cellules non-hématopoïétiques. L’augmentation du nombre de molécules du CMH exprimées à la surface des cellules néoplasiques a pour effet de susciter une surexpression d’ H7a, qui facilite leur reconnaissance par les lymphocytes T et induit l’exocytose antigène-dépendante des granules cytotoxiques présents dans les lymphocytes anti- H7a. Parce que l’IFNγ est sécrété uniquement dans la tumeur, l’expression du CMH et d’H7a demeure faible sur les autres cellules de l’organisme qui sont donc « ignorées » par les lymphocytes anti- H7a.
H7a possède deux caractéristiques qui en font un antigène de choix en immunothérapie. Tout d’abord, il est très immunogène et est abondamment exprimé à la surface cellulaire. Ensuite, il provient d’une protéine (STT3B) dont les cellules néoplasiques ne peuvent réprimer l’expression [8, 9]. Ces paramètres devront être pris en considération lors de l’élaboration de stratégies transposables à l’humain. L’antigène H7a n’est pas présenté par les molécules du CMH chez l’homme. Dans une telle perspective, HA-1 est un AgMiH particulièrement intéressant car il est très immunogène et est exprimé dans la plupart des tumeurs solides et des leucémies humaines [10]. De plus, grâce aux données obtenues dans notre modèle murin (Figure 2), nous proposons l’approche suivante : lymphodéplétion du receveur suivie de l’injection de deux populations cellulaires provenant d’un donneur compatible : (1) des cellules souches hématopoïétiques et (2) des lymphocytes T activés dirigés contre un AgMiH présent dans les cellules tumorales. La lymphodéplétion (par exemple par irradiation, Figure 2) et l’injection de cellules souches hématopoïétiques visent à prévenir deux complications : (1) le rejet des cellules du donneur et (2) une aplasie médullaire consécutive à la destruction des cellules hématopoïétiques du receveur. La première peut survenir dans tous les cas ; la seconde, dans le cas où l’AgMiH cible est exprimé par les cellules hématopoïétiques du receveur. Les molécules du CMH, fortement exprimées dans les cellules hématopoïétiques, les rendent vulnérables à la cytotoxicité anti-AgMiH. Par conséquent, des lymphocytes T qui reconnaissent un antigène présent dans les cellules hématopoïétiques peuvent détruire les progéniteurs hématopoïétiques présents dans la moelle osseuse et causer ainsi une aplasie médullaire. Dans une perspective globale, il apparaît primordial que le microenvironnement tumoral attire sélectivement les lymphocytes T effecteurs de façon à obtenir un effet anti-néoplasique tout en minimisant les dommages collatéraux. Il sera donc crucial de déterminer quelles sont les interactions moléculaires, outre celles entre Vla-4 et Vcam-1, responsables de ce phénomène qui méritent d’être exploitées en immunothérapie.
Figure 2
Modèle expérimental.
Des souris irradiées au jour 0 reçoivent une greffe de moelle osseuse (traitée pour éliminer les lymphocytes T) par voie intraveineuse, ainsi que 2 x 105 cellules de mélanome B16.F10 (H7a-positives) par voie sous-cutanée. Au jour 7, des splénocytes (5 x107) pré-activés ou non contre H7a sont injectés en guise de traitement. Les splénocytes et les cellules de moelle osseuse proviennent de la même souche de souris (syngénique). Des tumeurs sont prélevées au jour 19 pour analyse: infiltration et dégranulation par les lymphocytes T effecteurs anti-H7a, quantification de l’interféron-gamma et marquage immunohistochimique. Les autres receveuses sont suivies pour évaluation de la croissance tumorale et la survie.
Parties annexes
Références
- 1. Rosenberg SA, Yang JC, Restifo NP. Cancer immunotherapy: moving beyond current vaccines. Nat Med 2004 ; 10 : 909-15.
- 2. Boon T, Coulie PG, Van den Eynde BJ, van der Bruggen P. Human T cell responses against melanoma. Annu Rev Immunol 2006 (sous presse).
- 3. Perreault C, Brochu S. Adoptive cancer immunotherapy: discovering the best targets. J Mol Med 2002 ; 80 : 212-8.
- 4. Bleakley M, Riddell SR. Molecules and mechanisms of the graft-versus-leukaemia effect. Nat Rev Cancer 2004 ; 4 : 371-80.
- 5. Fontaine P, Roy-Proulx G, Knafo L, et al. Adoptive transfer of T lymphocytes targeted to a single immunodominant minor histocompatibility antigen eradicates leukemia cells without causing graft-versus-host disease. Nat Med 2001 ; 7 : 789-94.
- 6. Meunier MC, Delisle JS, Bergeron J, et al. T cells targeted against a single minor histocompatibility antigen can cure solid tumors. Nat Med 2005 ; 11 : 1222-9.
- 7. Blankenstein T. The role of tumor stroma in the interaction between tumor and immune system. Curr Opin Immunol 2005 ; 17 : 180-6.
- 8. McBride K, Baron C, Picard S, et al. The model B6dom1 minor histocompatibility antigen is encoded by a mouse homolog of the yeast STT3 gene. Immunogenetics 2002 ; 54 : 562-9.
- 9. Caron É, Charbonneau R, Huppé G, et al. The structure and location of SIMP/STT3B account for its prominent imprint on the MHC I immunopeptidome. Int Immunol 2005 ; 17 : 1583-96.
- 10. Klein CA, Wilke M, Pool J, et al. The hematopoietic system-specific minor histocompatibility antigen HA-1 shows aberrant expression in epithelial cancer cells. J Exp Med 2002 ; 196 : 359-68.
Liste des figures
Figure 1
Élimination tumorale par transfert adoptif de lymphocytes T anti-H7a.
Les lymphocytes T anti-H7a injectés à une souris porteuse de tumeur éliminent la tumeur sans causer de dommages collatéraux. Pour ce faire, ces lymphocytes migrent massivement (de façon Vcam-1-dépendante et H7a-indépendante) au site tumoral où ils sécrètent d’importantes quantités d’IFNγ. Cette sécrétion inhibe ensuite l’angiogenèse tumorale et entraîne l’augmentation de l’expression de l’antigène cible sur les cellules tumorales. Cela cause finalement une dégranulation locale des lymphocytes T anti-H7a. Parallèlement, aucune accumulation significative des lymphocytes T anti-H7a n’est observée dans les tissus et organes normaux. Car, les concentrations d’IFNγ et l’expression de H7a demeurent faibles dans ces organes et aucune dégranulation des lymphocytes n’y survient.
Figure 2
Modèle expérimental.
Des souris irradiées au jour 0 reçoivent une greffe de moelle osseuse (traitée pour éliminer les lymphocytes T) par voie intraveineuse, ainsi que 2 x 105 cellules de mélanome B16.F10 (H7a-positives) par voie sous-cutanée. Au jour 7, des splénocytes (5 x107) pré-activés ou non contre H7a sont injectés en guise de traitement. Les splénocytes et les cellules de moelle osseuse proviennent de la même souche de souris (syngénique). Des tumeurs sont prélevées au jour 19 pour analyse: infiltration et dégranulation par les lymphocytes T effecteurs anti-H7a, quantification de l’interféron-gamma et marquage immunohistochimique. Les autres receveuses sont suivies pour évaluation de la croissance tumorale et la survie.