Abstracts
Résumé
La sorption des ions chromate de solutions aqueuses sur une hydrotalcite de synthèse et sur son produit de calcination a été étudiée. L’interaction de ces matériaux avec les ions chromate montre que la cinétique de sorption est rapide et suit une expression de vitesse de sorption réversible du premier ordre. Les influences du pH, de la concentration en ions chromate de la solution et de la température ont été étudiées afin d’optimiser la sorption. Le traitement de solutions contenant de 10 à 200 mg L-1 de Cr(VI) a donné de bons résultats. Les capacités de sorption de ces matériaux sont 1,3 et 2,4 mmol g‑1 de Cr(VI), respectivement. L’étude de la réversibilité de la sorption des ions chromate indique qu’il est possible d’utiliser les hydrotalcites calcinées comme sorbants recyclables. Ceci suggère notamment que ces derniers pourraient constituer d’intéressants supports pour le piégeage d’ions chromate.
Mots clés:
- Traitement de l’eau,
- hydroxyde double lamellaire,
- hydrotalcite,
- sorption,
- chromate
Summary
The sorption of chromate ions from aqueous solutions onto a synthetic hydrotalcite and its calcination product was investigated. The interaction of these materials with chromate ions shows that the kinetics of sorption are fast and follow a first-order reversible model. The effects of pH, chromate ion concentration and temperature on the sorption were studied. Solutions containing from 10 to 200 mg L‑1 of Cr(VI) were successfully treated. The sorption capacities of these materials are approximately 1.3 and 2.4 mmol CrO42-, per g, for the hydrotalcite and its calcination product, respectively. The reversibility of the sorption of chromate ions suggests the possible use of the calcined hydrotalcites as recyclable sorbents, which may constitute useful supports for trapping chromate ions.
Key words:
- Water treatment,
- layered double hydroxide,
- hydrotalcite,
- sorption,
- chromate
Article body
1. Introduction
Le chrome est un élément rencontré dans de nombreux effluents liquides. Sous sa forme hexavalente, il présente une toxicité très élevée (BOJIC et al., 2004). Parmi les méthodes de traitement des rejets contenant du Cr(VI), la plus courante est celle qui consiste en une réduction suivie d’une précipitation du Cr(III) obtenu sous forme d’hydroxyde. Cette technique de détoxication, bien connue dans le milieu du traitement de surface, présente néanmoins quelques inconvénients : (i) production de boues, (ii) consommation importante de réactifs souvent toxiques et (iii) perte de matière première (ECKENFELDER, 1982).
Plusieurs travaux ont montré que les hydroxydes doubles lamellaires (notés LDHs, acronyme de Layered Double Hydroxides) peuvent être utilisés pour le piégeage de polluants chimiques organiques ou inorganiques, en raison de leur capacité d’échange parmi les plus fortes chez les échangeurs anioniques (TORAISHI et al., 2002). Les LDHs s’apparentent à l’hydrotalcite naturelle Mg6Al2(OH)16(CO3)•4H2O, dans laquelle des cations magnésium sont remplacés par des cations aluminium. La substitution partielle des cations trivalents aux cations divalents génère un excès de charge positive sur les feuillets et, afin d’assurer la neutralité électrique globale, des espèces anioniques sont alors intercalées dans l’espace interfeuillet, conjointement à des molécules d’eau. Les anions les plus rencontrés dans l’espace interfoliaire des LDHs sont les ions carbonate. Ces derniers, en raison de leur faible taille par rapport à leur charge (MENDIBOURE et SCHÖLLHOM, 1986), présentent une grande affinité pour ces matrices et, par conséquent, ils sont difficilement échangeables. L’emploi des LDHs calcinés a permis, par ailleurs, de s’affranchir des ions carbonate. Il semble en effet que de tels matériaux puissent se régénérer après calcination et former des oxydes mixtes (DE ROY et al., 1992). Si l’anion est détruit dans le domaine de température de calcination, il peut être remplacé par un autre anion. Les oxydes mixtes obtenus après calcination des LDHs, remis dans une solution contenant l’anion à intercaler, se réhydratent pour former une nouvelle phase LDH.
L’utilisation des LDHs calcinés pour éliminer les ions bichromate a été étudiée et a donné de bons résultats (GOSWAMEE et al., 1998).
Pour notre part, nous nous sommes intéressés à l’étude de l’élimination des ions chromate en solution aqueuse par sorption sur une hydrotalcite Mg‑Al‑CO3 et par son produit de calcination. Suite aux travaux réalisés par LAZARIDIS et ASOUHIDOU (2003), nous avons mené des essais de sorption afin de déterminer les conditions optimales de sorption des ions chromate sur ces solides (temps de contact, pH de la solution, concentration initiale en Cr(VI), masse du sorbant et température) et, d’autre part, étudié l’échange anionique des ions chromate retenus par des ions carbonate et sulfate en vue d’une utilisation de ces matériaux comme sorbants recyclables pour le traitement des eaux polluées.
2. Matériaux et méthodes
2.1 Synthèse des matériaux
L’hydrotalcite (Mg‑Al‑CO3) a été obtenue par la méthode de coprécipitation à pH constant (REICHLE, 1986). Une solution de 0,1 mole de MgCl2 et 0,05 mole de Al(NO3)3 dans 80 mL d’eau distillée est ajoutée goutte à goutte et sous forte agitation à 100 mL de solution aqueuse contenant 0,35 mole de NaOH et 0,09 mole de Na2CO3. Le pH est ajusté et maintenu à la valeur de 10 durant toute la durée de l’ajout, par addition d’une solution de HNO3 ou de Na2CO3 (1 N). Le gel formé est agité à 65 °C pendant environ 20 h jusqu’à cristallisation, puis filtré et lavé à l’eau distillée jusqu’à test négatif au nitrate d’argent. Le solide, noté HT, est séché à 105 °C pendant 18 h, ensuite broyé et tamisé à 0,1 mm. Le solide HT a été calciné à 550 °C avec une montée de température de 40 °C h‑1. Cette calcination lente nous permet d’éviter un départ trop rapide des molécules d’eau et des anions carbonate, qui conduirait, après la reconstruction, à une phase faiblement cristallisée (DE ROY et al., 1992). Le solide obtenu est noté HT-C.
La réhydratation de l’échantillon calciné a été effectuée par dispersion de 2 g de HT‑C dans 100 mL d’une solution 5 x 10‑2 M de Na2CO3. La suspension est agitée pendant 2 h, puis filtrée et lavée. Le solide obtenu est séché à 105 °C pendant 18 h. Le matériau obtenu est noté HT‑R.
2.2 Caractérisation des matériaux synthétisés
L’analyse chimique des éléments Mg et Al a été réalisée par spectrométrie de fluorescence X au Centre de Recherche et de Développement de l’entreprise Sonatrach (Algérie).
Les analyses par diffraction des rayons X ont été effectuées sur poudres à l’aide d’un diffractomètre Philips PW 1800 (raie Kα du cuivre (λ = 1,5418 Å), 40 kV, 20 mA).
L’analyse thermogravimétrique a été réalisée sur un appareil Setaram TG‑DTA 16 entre 20 et 850 °C avec une vitesse de chauffe de 10 °C min-1.
2.3 Sorption des ions chromate sur les matériaux HT et HT‑C
La détermination de la cinétique de sorption du Cr(VI) sur les matériaux HT et HT‑C a été réalisée sur une série de suspensions de 50 mg de solide dans 100 mL de solution aqueuse de K2CrO4 à concentration initiale (Ci) 10, 30, 50 et 100 mg L‑1 de Cr(VI), pour des temps de contact allant de 5 à 90 min. L’agitation, à la température ambiante (17‑19 °C), est assurée par un agitateur rotatif. À la fin du temps imparti, chaque suspension est centrifugée. Dans le surnageant on mesure le pH d’équilibre ainsi que la concentration résiduelle à l’instant t (Ct) en Cr(VI). La concentration de Cr(VI) est déterminée par spectrophotométrie du complexe chrome-diphénylcarbazide à la longueur d’onde de 540 nm (EATON et al., 1995).
L’effet du pH a été étudié dans la gamme des valeurs de 4 à 10 sur des suspensions de 50 mg de solide dans 100 mL de solution de Cr(VI) à 50 mg L‑1. Les suspensions sont agitées durant 1 h tout en ajustant le pH à la valeur désirée, par ajout de HNO3 ou de NaOH (10‑2 N).
Les isothermes de sorption ont été établies, à la température ambiante, en utilisant des suspensions de masses de sorbant comprises entre 50 et 150 mg dans 100 mL de solutions à teneurs croissantes en Cr(VI) (10 à 200 mg L‑1). Ces concentrations sont du même ordre de grandeur que celles rencontrées dans les rejets industriels (BOJIC et al., 2004; HOURI et al., 1999). Les suspensions de pH ajusté à 6 sont agitées durant 1 h puis centrifugées. Dans les surnageants, on mesure la concentration totale d’équilibre (Ce) en Cr(VI). La quantité de Cr(VI) fixée par unité de masse de solide (Qa, en mg g‑1) s’obtient à partir de la différence entre les concentrations initiales et les concentrations totales d’équilibre.
L’influence de la température a été étudiée en faisant varier la température des suspensions de 50 mg d’échantillon dans 100 mL de solution à 160 mg L‑1 en Cr(VI) de 15 à 60 °C. Les suspensions de pH ajusté à 6 sont agitées pendant 1 h en même temps que la température est maintenue à la valeur désirée à l’aide d’un bain thermostaté.
2.4 Déplacement des ions chromate
Le déplacement d’ions chromate retenus sur les matériaux étudiés a été conduit en utilisant la méthode de dilution (YOU et al., 2001). Des échantillons HT et HT‑C saturés en Cr(VI) ont été préparés en utilisant des suspensions de 250 mg de solide dans 500 mL de solution à 200 mg L‑1 de Cr(VI) à 60 °C, pH de 6 et un temps de contact de 1 h. Les solides récupérés, notés HTCr et HT‑CCr, sont lavés, puis séchés à 105 °C. Les quantités de Cr(VI) retenues ont été déterminées, après dissolution de 50 mg du solide dans 100 mL d’H2SO4 (1 N).
50 mg d’échantillon de HTCr ou HT‑CCr sont mis en contact avec 100 mL de solution de réactif d’extraction (carbonate ou sulfate de sodium à 10‑2 M). Les suspensions sont agitées durant 1 h, ensuite laissées décanter. 50 mL du surnageant (liquide clair) sont remplacés par une deuxième fraction de 50 mL de réactif d’extraction; deuxième agitation et décantation, cette opération est répétée plusieurs fois, le surnageant de chaque extraction est recueilli séparément et la quantité de Cr(VI) extraite est mesurée.
3. Résultats et discussion
3.1 Caractérisation chimique et structurale
La formule chimique de la phase [Mg‑Al‑CO3] déduite des pourcentages en masse en magnésium et en aluminium (respectivement 19,7 ± 0,2 et 10,5 ± 0,1) est :
[Mg0,68 Al0,32 (OH)2] (CO3)0,16 • nH2O
Le rapport molaire Mg/Al de 2,08, déterminé à partir des résultats de l’analyse chimique, est en bon accord avec celui calculé compte tenu des concentrations initiales en sels.
Le diffractogramme de RX du matériau HT (Figure 1a), montre le diagramme caractéristique de l’hydrotalcite avec notamment l’ensemble des raies (00l) rencontrées dans les composés à structure lamellaire (DE ROY et al., 1992). La distance interréticulaire de la raie (003) correspond à la distance interfeuillet, alors que la distance interréticulaire de la raie (110) représente la moitié de la distance métal‑métal dans le feuillet. Les paramètres de maille hexagonaux a (= 2d (110)) = 3,04 Å et c (= 3d (003)) = 22,89 Å sont en bon accord avec ceux trouvés dans la littérature (DE ROY et al., 1992). On note sur le diffractogramme de RX de l’échantillon calciné HT‑C (Figure 1b), la disparition des raies de diffraction de la phase lamellaire, et seules deux raies larges (200) et (220) appartenant à la phase MgO sont observées. L’oxyde d’aluminium n’est pas détecté. À cette température de calcination, les oxydes d’aluminium sont à l’état amorphe, et donc non détectables (ROELOFS et al., 2002). Après hydratation des oxydes mixtes obtenus, en présence d’ions carbonate, une nouvelle phase [Mg‑Al‑CO3] se forme. La comparaison des diffractogrammes des figures 1a et 1c le montre clairement.
La courbe d’ATG du solide HT est présentée à la figure 2. Le comportement thermique de la phase [Mg‑Al‑CO3] a été largement étudié par ailleurs (NOMURA et al., 2003; ROELOFS et al., 2002). Il y a généralement deux étapes dans la perte de masse des LDHs : (i) perte de l’eau interfeuillet et des espèces adsorbées, (ii) déshydroxylation des feuillets, perte des espèces carbonate et la destruction du matériau. Sur la base de la perte de masse vers 227 °C, nous avons déterminé le nombre de molécules d’eau intercalées. La valeur calculée correspond à 0,78 mole d’eau par LDH, la formule chimique peut alors s’écrire :
[Mg0,68 Al0,32 (OH)2] (CO3)0,16 • 0,78 H2O
Figure 1
Diffractogrammes de RX des hydrotalcites de synthèse HT (a), calcinée HT-C (b) et calcinée puis réhydratée HT-R (c).
X-ray diffraction diagram of synthetic hydrotalcites (HT) (a), calcined HT-C (b) and calcined and re-hydrated HT-R (c).
Figure 2
Courbe d’analyse thermogravimétrique de l’hydrotalcite HT.
Hydrotalcite HT thermogravimetric analysis curve.
3.2 Sorption des ions chromate
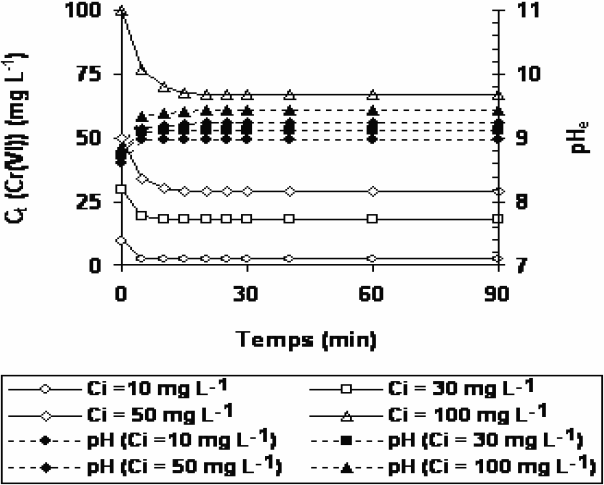
L’examen des résultats des expériences relatives à l’effet du temps de contact sur la sorption du Cr(VI) sur les solides HT et HT‑C met tout d’abord en évidence la rapidité du phénomène (Figures 3 et 4). En effet, l’équilibre est atteint au bout de 30 min de contact. Ce résultat rejoint l’observation faite précédemment par (HOURI et al., 1999; LAZARIDIS et ASOUHIDOU, 2003). On note aussi que la sorption est plus rapide à son début qu’à sa fin; phénomène dû probablement à la résistance au transfert de matière à l’intérieur des grains des solides. L’augmentation de la vitesse de transfert de matière est due à l’accroissement de la force d’échange : différence entre la concentration du coeur de la solution et celle à la surface du solide. Enfin, le temps d’équilibre varie avec la concentration initiale en Cr(VI). Il ressort également des figures 3 et 4 que, dans le cas de la sorption du Cr(VI) sur le matériau HT, les pH des solutions restent approximativement constants, alors que sur HT‑C, ils sont toujours supérieurs aux pH des solutions initiales. De tels effets ont été rapportés par d’autres auteurs concernant la sorption des ions Cl-, HPO42-, NO3- et SeO32- (KAMEDA et al., 2003; YOU et al., 2001), et pourraient être justifiés par le fait que les matériaux HT‑C, au cours du processus de réhydratation, libèrent des ions OH- (KAMEDA et al., 2003). Il en résulte une augmentation du pH de la solution.
Figure 3
Cinétique de sorption des ions chromate sur l’hydrotalcite HT.
Sorption kinetics of chromate ions on hydrotalcite HT.
Figure 4
Cinétique de sorption des ions chromate sur l’hydrotalcite calcinée HT-C.
Sorption kinetics of chromate ions on calcined HT-C.
Les données de l’effet du temps de contact sont traitées suivant l’expression de vitesse de sorption réversible du premier ordre selon l’équation 1 (BELMOUDEN et al., 2001) :
où Ci, Ct et Ce (mg L‑1) sont les concentrations initiales de Cr(VI) dans la solution, à l’instant t et à l’équilibre, respectivement et k’ (min‑1) est la constante de vitesse.
k’ = k1(1 + (1/ke)) = k1 + k2, ke = k1/k2 et ke = Ca/Ce avec k1 et k2 (min‑1) étant les constantes de vitesse de sorption et de désorption du premier ordre, respectivement; Ke, la constante d’équilibre et Ca (mg L‑1), la concentration fixée par le solide à l’équilibre.
Après intégration de l’équation 1 entre l’instant initial et l’instant t, on obtient :
Le tableau 1 donne les valeurs des paramètres cinétiques de la sorption des ions chromate ainsi que le coefficient de corrélation r entre ln(1 - (Ci - Ct)/(Ci - Ce)) et t (Éq. 2). La valeur du coefficient de corrélation, proche de l’unité, indique que les cinétiques de sorption des ions chromate sur les matériaux étudiés suivent une expression de vitesse de sorption réversible du premier ordre. Nous constatons que HT‑C a des constantes de vitesse de sorption k1 plus élevées, ce qui signifierait que l’interaction entre les ions chromate et le matériau HT‑C est plus forte que celle entre ces espèces anioniques et HT.
Tableau 1
Les paramètres cinétiques de la sorption des ions Cr(VI) sur les matériaux étudiés.
Sorption kinetics parameters for chromate ions on the studied materials.
HT | |||||
|---|---|---|---|---|---|
|
Ci en Cr(VI) (mg L‑1) |
Ke |
k’ (min‑1) |
k1 (min‑1) |
k2 (min‑1) |
ra |
30 |
0,230 |
0,338 |
0,063 |
0,275 |
0,9998 |
50 |
0,220 |
0,250 |
0,045 |
0,205 |
0,9992 |
100 |
0,153 |
0,153 |
0,020 |
0,133 |
0,9988 |
HT-C | |||||
|
Ci en Cr(VI) (mg L‑1) |
Ke |
k’ (min‑1) |
k1 (min‑1) |
k2 (min‑1) |
ra |
50 |
0,709 |
0,290 |
0,121 |
0,170 |
0,9961 |
100 |
0,494 |
0,259 |
0,086 |
0,174 |
0,9984 |
a Coefficient de corrélation
La figure 5 montre l’effet du pH sur la sorption du Cr(VI) sur les solides HT et HT‑C. Elle montre que dans le domaine des pH basiques, les matériaux utilisés présentent un faible pouvoir de rétention des ions chromate. De tels effets ont été rapportés par LAZARIDIS et ASOUHIDOU (2003). Ceci pourrait être dû à la présence des ions OH- et CO32-; ces derniers entrent en compétition avec les ions chromate sur les sites de sorption des matériaux utilisés.
Lorsque le pH évolue dans la gamme pH 7 à pH 5, gamme dans laquelle les espèces du chrome en solution sont HCrO4- et CrO42- (SAHA et al., 2004), la capacité de fixation croît. Un résultat analogue avait été observé par LAZARIDIS et ASOUHIDOU (2003). Ceci pourrait s’expliquer par le fait qu’une diminution du pH favorise l’augmentation de la concentration des ions bicarbonate au dépens des ions carbonate. Ces ions étant de valence moins élevée, leur effet compétitif vis‑à‑vis des sites de sorption est moins prononcé. Enfin, aux valeurs de pH < 5, les quantités fixées par rapport à la masse de matériau introduite diminuent. Cette réduction de la sorption a également été soulignée par YOU et al. (2001) pour les ions SeO32- et est communément interprétée par une dissolution partielle de ces matériaux.
Figure 5
Influence du pH sur les quantités d’ions Cr(VI) sorbées.
Influence of pH on the quantity of Cr(VI) ions sorbed.
Les données de sorption sont traitées suivant l’équation linéarisée de Langmuir :
où Q0 est la capacité maximale de sorption (mg g‑1) et b est une constante d’équilibre (L mg‑1).
Les tracés des courbes Ce/(Qa) en fonction de Ce, pour différents rapports solide/solution (R) (Figure 6), sont des droites avec un coefficient de corrélation proche de l’unité. Ce résultat indique que le phénomène de sorption est bien régi par une isotherme de type Langmuir. L’exploitation des équations des droites de Langmuir permet de calculer les paramètres Q0 et b qui sont regroupés dans le tableau 2. On constate que la sorption de Cr(VI) sur les matériaux utilisés est affectée par une variation du rapport (R). En effet, pour un décroissement de R de 1,5 à 0,5 g L‑1, la sorption est multipliée par un facteur 1,79 pour HT et 1,53 pour HT‑C. Ceci est en accord avec les résultats obtenus par LAZARIDIS et ASOUHIDOU (2003), et provient du fait que lorsque la masse de sorbant augmente, les cristallites tendent à s’agglomérer, ce qui engendre une diminution de la surface de contact.
Les capacités maximales (Q0) des matériaux HT et HT‑C calculées varient avec (R) selon des expressions de la forme Q0 = 84,42 e‑0,584 R et Q0 = 138,43 e‑0,4239 R, respectivement.
Figure 6
Transformées linéaires des isothermes de Langmuir pour la sorption de Cr(VI).
Langmuir isotherm linear transformations for the sorption of Cr(VI).
Tableau 2
Constantes de Langmuir pour les matériaux étudiés.
Langmuir constants for the studied materials.
|
HT |
HT-C |
||||
|---|---|---|---|---|---|---|
|
R (g L‑1) |
0,5 |
1 |
1,5 |
0,5 |
1 |
1,5 |
|
Q0 (mg g‑1) |
63,3 |
49,5 |
35,3 |
112,3 |
90,1 |
73,5 |
|
b (L mg‑1) |
0,038 |
0,056 |
0,105 |
0,082 |
0,157 |
0,242 |
ra |
0,985 |
0,987 |
0,984 |
0,997 |
0,996 |
0,993 |
a Coefficient de corrélation
On note également que le matériau HT a une capacité de rétention Q0 de 1,3 mmol g‑1, valeur inférieure à la capacité d’échange anionique moyenne d’une hydotalcite (3,5 mmol g‑1) (MIYATA,1983; YOU et al., 2001). Ceci indique que pour nos conditions expérimentales les phénomènes de précipitation et d’échange entre les feuillets sont peu ou pas responsables de la rétention de ces anions. Ceci suggère que ces derniers se fixent par adsorption électrostatique sur des sites provenant des groupements situés sur les bords des feuillets (MgOH, AlOH). Ce résultat va dans le même sens que des travaux effectués par TORAISHI et al. (2002) et YOU et al. (2001), lesquels ont signalé l’échange non fructueux des anions carbonate de l’espace interfeuillet par des anions phosphate, silicate et iodate. Par ailleurs, la capacité de fixation du matériau calciné HT‑C (2,4 mmol g‑1) est supérieure à celle du matériau de départ HT. Ce qui suggère, en accord avec plusieurs observations antérieures pour la sorption des ions chromate et d’autres anions (GOSWAMEE et al., 1998; KAMEDA et al., 2003; LAZARIDIS et ASOUHIDOU, 2003), qu’en plus du processus d’adsorption sur la surface externe, il y a également un processus d’intercalation d’anions, lors de la reconstruction du domaine interlamellaire. Enfin, la différence entre la quantité retenue de Cr(VI) sur le solide HT‑C et sa capacité d’échange anionique pourrait être attribuée à l’effet compétitif des ions carbonate, étant donné que l’opération est effectuée à l’air libre.
Les paramètres thermodynamiques mettant en évidence l’influence de la température sont déterminés à partir des relations entre eux et le coefficient de distribution de sorption Ksor. Ksor est défini comme étant le rapport de la quantité de Cr(VI) fixée Qa(mg g‑1) sur la quantité de Cr(VI) restante en solution (mg cm‑3) (KHAN et al., 1995).
La relation thermodynamique ΔG0 = ΔH0 ‑ TΔS0; associée à la relation de Vant’Hoff ΔG0 = ‑RTlnKsor (KHAN et al., 1995), nous permet d’aboutir à l’équation :
Le tracé des droites lnKsor = f(1/T) permet d’obtenir les valeurs de ΔH0 et de ΔS0 (Figure 7). Les valeurs des paramètres thermodynamiques sont présentées au tableau 3. On constate que la variation de l’enthalpie ΔH0 du système est positive, et cela indique que le processus de sorption est endothermique. Les valeurs de ΔG0 (valeur absolue) augmentent avec la température, indiquant une spontanéité dans le processus de sorption des ions chromate sur HT et HT‑C.
Figure 7
Détermination des paramètres thermo-dynamiques.
Determination of thermodynamic parameters
Le tableau 4 compare les capacités de sorption du Cr(VI) sur les matériaux utilisés et sur d’autres sorbants (AGGARWAL et al., 1999; BAES et al., 1997; GOSWAMEE et al., 1998; HOURI et al., 1999; LAZARIDIS et ASOUHIDOU, 2003). La conclusion tirée met en évidence le grand pouvoir de sorption de l’hydrotalcite calcinée. Ceci suggère l’utilisation de ce matériau pour la purification d’eau contenant des ions chromate.
3.3 Déplacement des ions chromate
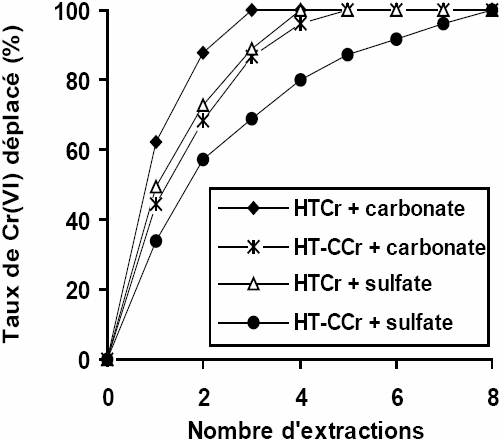
L’examen des résultats du déplacement du Cr(VI), présentés à la figure 8, montre que les ions chromate retenus par les solides HT et HT‑C peuvent être extraits par les ions CO32- ou SO42-. Il ressort aussi que le déplacement de ces ions à partir du matériau HTCr est plus aisé qu’à partir du HT‑CCr. Ce résultat conforte l’hypothèse que la sorption sur HT‑C, met en jeu d’autres sites que les groupements ionisables des feuillets. Nous pensons que ce sont les sites du domaine interlamellaire parce que les échanges de bordure se font très rapidement. Par contre, quand il doit y avoir pénétration entre les feuillets, les échanges seraient plus lents.
Tableau 3
Valeurs des paramètres thermodynamiques.
Thermodynamic parameter values.
Solide |
ΔH0 (kJ mol‑1) |
ΔS0 (J oK‑1 mol‑1) |
Température (K) |
ra |
|||
|---|---|---|---|---|---|---|---|
288 |
303 |
318 |
333 |
||||
|
‑ΔG0 (kJ mol‑1) | |||||||
HT |
6,08 |
70,30 |
14,17 |
15,22 |
16,28 |
17,33 |
0,96 |
HT-C |
5,60 |
75,95 |
16,27 |
17,41 |
18,55 |
19,69 |
0,97 |
a Coefficient de corrélation
Tableau 4
Propriétés sorbantes comparées des hydrotalcites et d’autres sorbants vis à vis du Cr(VI).
Sorption of Cr(VI) on hydrotalcite and its calcination product compared to other sorbents.
Hydrotalcite |
Ci en Cr(VI) (mmol L‑1) |
pH |
R (g L‑1) |
T (°C) |
Capacité de sorption (mmol g‑1) |
|
|---|---|---|---|---|---|---|
Non calcinée |
Calcinée |
|||||
Mg-Al-CO3 a |
3,85 |
6 |
0,5 |
15 |
0,9 |
1,9 |
30 |
1,1 |
2,0 |
||||
45 |
1,1 |
2,2 |
||||
60 |
1,3 |
2,4 |
||||
Mg-Al-CO3 b |
1,92 |
6 |
0,2 |
60 |
- |
2,3 |
Zn-Al-Cl c |
5,77 |
7 |
0,2 |
25 |
1,0 |
- |
Mg-Al-CO3 d |
30,19 |
10 |
10 |
25 |
- |
1,2 |
Charbon activé e |
3,85 |
5,5 |
10 |
25 |
0,7 |
|
Résine anionique forte f (Amberlite IRA-900) |
- |
7 |
- |
25 |
2,9 |
a, notre travail; b, (LAZARIDIS et ASOUHIDOU (2003)); c, (HOURI et al., 1999); d, (GOSWAMEE et al., 1998); e, (AGGARWAL et al., 1999); f, (BAES et al., 1997).
Figure 8
Déplacement des ions Cr(VI) par les ions carbonate et sulfate.
The displacement of Cr(VI) ions by CO32- and SO42- ions
4. Conclusions
Le solide Mg‑Al‑CO3 a été préparé par une méthode de coprécipitation à pH constant et selon un rapport Mg/Al = 2. Les études par diffraction des rayons X, analyse thermogravimétrique et analyse chimique ont montré que le matériau obtenu correspond aux composés de type hydrotalcite avec une bonne cristallinité. La réhydratation des oxydes mixtes obtenus après calcination ménagée à 550 °C du matériau de départ donne, en présence des anions carbonate, une phase Mg‑Al‑CO3.
L’étude des phénomènes physico-chimiques qui régissent les interactions entre une phase Mg‑Al‑CO3 et son produit de calcination vis‑à‑vis des ions chromate révèle que les matériaux calcinés pourraient être de bons candidats pour le piégeage de ces polluants. En effet, le traitement de solutions contenant de 10 à 200 mg L-1 de Cr(VI) a donné de bons résultats. Les capacités de sorption de ces matériaux sont 1,3 et 2,4 mmol g‑1 de Cr(VI), respectivement. Enfin, l’étude de la réversibilité de la sorption des ions chromate indique que le recyclage de ces matériaux calcinés est possible. Ceci suggère notamment que ces derniers pourraient constituer d’intéressants supports pour le piégeage d’anions polluants. En effet, le recyclage par restitution et calcination-reconstruction devrait favoriser l’accumulation de ces polluants.
Appendices
Annexe
Notations
Références bibliographiques
- AGGARWAL D., M. GOYAL et R.C. BANSAL (1999). Adsorption of chromium by activated carbon from aqueous solution. Carbon, 37, 1989-1997.
- BAES A.U., T. OKUDA, W. NISHIJIMA, E. SHOTO et M. OKADA (1997). Adsorption and ion exchange of some groundwater anion contaminants in an amine modified coconut coir. Water Sci. Technol., 35, 89-95.
- BELMOUDEN M., A. ASSABBANE et Y. AIT ICHOU (2001). Removal of 2,4-dichloro phenoxyacetic acid from aqueous solution by adsorption on activated carbon. A kinetic study. Ann. Chim. Sci. Mat., 26, 79-85.
- BOJIC A., M. PURENOVIC et D. BOJIC (2004). Removal of chromium (VI) from water by micro-alloyed aluminium composite (MAlC) under flow conditions. Water SA, 30, 353-359.
- DE ROY A., C. FORANO, K. EL MALKI et J.-P. BESSE (1992). Anionic clays. Dans : Synthesis of microporous materials. OCCELLI M.L. et H.E. ROBSON (Éditeurs), Van Nostrand Reinhold, New-York, États-Unis, pp. 108‑169.
- EATON A.D, L.S CLESCERI et A.E GREENBERG (1995). Standard methods for the examination of water and wastewater, APHA, AWWA, WPCF, APHA, Washington, DC, États-Unis, pp. 4-23.
- ECKENFELDER W.W. (1982). Gestion des eaux usées urbaines et industrielles. Technique & Documentation, Lavoisier, Paris, France, 423 p.
- GOSWAMEE R.L., P. SENGUPTA, K.G. BHATTACHARYYA et D.K. DUTTA (1998). Adsorption of Cr(VI) in layered double hydroxides. Appl. Clay Sci., 13, 21-34.
- HOURI B., A. LEGROURI, A. BARROUG, C. FORANO et J.-P. BESSE (1999). Removal of chromate ions from water by anionic clays. J. Chim. Phys., 96, 455-463.
- KAMEDA T., F. YABUUCHI, T. YOSHIOKA, M. UCHIDA et A. OKUWAKI (2003). New method of treating dilute mineral acids using magnesium-aluminium oxide. Water Res., 37, 1545-1550.
- KHAN S.A., RIAZ-UR-REHMAN, et M.A. KHAN (1995.) Adsorption of chromium (III), chromium (VI) and silver (I) on bentonite. Waste Manage., 15, 271-282.
- LAZARIDIS N.K. et D.D. ASOUHIDOU (2003). Kinetics of sorptive removal of chromium(VI) from aqueous solutions by calcined Mg‑Al‑CO3 hydrotalcite. Water Res., 37, 2875-2882.
- MENDIBOURE A. et R. SCHÖLLHOM (1986). Formation and anion exchange reaction of layered transition metal hydroxides [Ni1-x Mx](OH)2(CO3)x/2(H2O)x (M = Fe,Co). Rev. Chim. Min., 23, 819-827.
- MIYATA S. (1983). Anion-exchange properties of hydrotalcite-like compound. Clays Clay Miner., 31, 305-311.
- NOMURA R., T. MORI, E. KANEZAKI et T. YABUTANI (2003). Removal of phosphate in water to layered double hydroxide. Internat. J. Modern Phys. B., 17, 1458-1463.
- REICHLE W.T. (1986). Synthesis of anionic clay minerals (mixed metal hydroxides, hydrotalcite). Solid State Ionics, 22, 135-141.
- ROELOFS J.C.A.A., J.A. VAN BOKHOVEN, A.J. VAN DILLEN, J.W. GEUS et K.P. DE JONG (2002). The thermal decomposition of Mg-Al hydrotalcites: Effects of interlayer anions and characteristics of the final structure. Chem. Eur. J., 8, 5571-5579.
- SAHA B., R.J. GILL, D.G. BAILEY, N. KABAY et M. ARDA (2004). Sorption of Cr(VI) from aqueous solution by Amberlite XAD-7 resin impregnated with aliquat 336. React. Funct. Polym., 60, 223-244.
- TORAISHI T., S. NAGASAKI et S. TANAKA (2002). Adsorption behavior of IO3- by CO3- and NO3- hydrotalcite. Appl. Clay Sci., 22, 17-23.
- YOU Y, G.F VANCE et H. ZHAO (2001). Selenium adsorption on Mg-Al and Zn-Al layered double hydroxides. Appl. Clay Sci., 20, 13-25.
List of figures
Figure 1
Diffractogrammes de RX des hydrotalcites de synthèse HT (a), calcinée HT-C (b) et calcinée puis réhydratée HT-R (c).
X-ray diffraction diagram of synthetic hydrotalcites (HT) (a), calcined HT-C (b) and calcined and re-hydrated HT-R (c).
Figure 2
Courbe d’analyse thermogravimétrique de l’hydrotalcite HT.
Hydrotalcite HT thermogravimetric analysis curve.
Figure 3
Cinétique de sorption des ions chromate sur l’hydrotalcite HT.
Sorption kinetics of chromate ions on hydrotalcite HT.
Figure 4
Cinétique de sorption des ions chromate sur l’hydrotalcite calcinée HT-C.
Sorption kinetics of chromate ions on calcined HT-C.
Figure 5
Influence du pH sur les quantités d’ions Cr(VI) sorbées.
Influence of pH on the quantity of Cr(VI) ions sorbed.
Figure 6
Transformées linéaires des isothermes de Langmuir pour la sorption de Cr(VI).
Langmuir isotherm linear transformations for the sorption of Cr(VI).
Figure 7
Détermination des paramètres thermo-dynamiques.
Determination of thermodynamic parameters
Figure 8
Déplacement des ions Cr(VI) par les ions carbonate et sulfate.
The displacement of Cr(VI) ions by CO32- and SO42- ions
List of tables
Tableau 1
Les paramètres cinétiques de la sorption des ions Cr(VI) sur les matériaux étudiés.
Sorption kinetics parameters for chromate ions on the studied materials.
HT | |||||
|---|---|---|---|---|---|
|
Ci en Cr(VI) (mg L‑1) |
Ke |
k’ (min‑1) |
k1 (min‑1) |
k2 (min‑1) |
ra |
30 |
0,230 |
0,338 |
0,063 |
0,275 |
0,9998 |
50 |
0,220 |
0,250 |
0,045 |
0,205 |
0,9992 |
100 |
0,153 |
0,153 |
0,020 |
0,133 |
0,9988 |
HT-C | |||||
|
Ci en Cr(VI) (mg L‑1) |
Ke |
k’ (min‑1) |
k1 (min‑1) |
k2 (min‑1) |
ra |
50 |
0,709 |
0,290 |
0,121 |
0,170 |
0,9961 |
100 |
0,494 |
0,259 |
0,086 |
0,174 |
0,9984 |
a Coefficient de corrélation
Tableau 2
Constantes de Langmuir pour les matériaux étudiés.
Langmuir constants for the studied materials.
|
HT |
HT-C |
||||
|---|---|---|---|---|---|---|
|
R (g L‑1) |
0,5 |
1 |
1,5 |
0,5 |
1 |
1,5 |
|
Q0 (mg g‑1) |
63,3 |
49,5 |
35,3 |
112,3 |
90,1 |
73,5 |
|
b (L mg‑1) |
0,038 |
0,056 |
0,105 |
0,082 |
0,157 |
0,242 |
ra |
0,985 |
0,987 |
0,984 |
0,997 |
0,996 |
0,993 |
a Coefficient de corrélation
Tableau 3
Valeurs des paramètres thermodynamiques.
Thermodynamic parameter values.
Solide |
ΔH0 (kJ mol‑1) |
ΔS0 (J oK‑1 mol‑1) |
Température (K) |
ra |
|||
|---|---|---|---|---|---|---|---|
288 |
303 |
318 |
333 |
||||
|
‑ΔG0 (kJ mol‑1) | |||||||
HT |
6,08 |
70,30 |
14,17 |
15,22 |
16,28 |
17,33 |
0,96 |
HT-C |
5,60 |
75,95 |
16,27 |
17,41 |
18,55 |
19,69 |
0,97 |
a Coefficient de corrélation
Tableau 4
Propriétés sorbantes comparées des hydrotalcites et d’autres sorbants vis à vis du Cr(VI).
Sorption of Cr(VI) on hydrotalcite and its calcination product compared to other sorbents.
Hydrotalcite |
Ci en Cr(VI) (mmol L‑1) |
pH |
R (g L‑1) |
T (°C) |
Capacité de sorption (mmol g‑1) |
|
|---|---|---|---|---|---|---|
Non calcinée |
Calcinée |
|||||
Mg-Al-CO3 a |
3,85 |
6 |
0,5 |
15 |
0,9 |
1,9 |
30 |
1,1 |
2,0 |
||||
45 |
1,1 |
2,2 |
||||
60 |
1,3 |
2,4 |
||||
Mg-Al-CO3 b |
1,92 |
6 |
0,2 |
60 |
- |
2,3 |
Zn-Al-Cl c |
5,77 |
7 |
0,2 |
25 |
1,0 |
- |
Mg-Al-CO3 d |
30,19 |
10 |
10 |
25 |
- |
1,2 |
Charbon activé e |
3,85 |
5,5 |
10 |
25 |
0,7 |
|
Résine anionique forte f (Amberlite IRA-900) |
- |
7 |
- |
25 |
2,9 |
a, notre travail; b, (LAZARIDIS et ASOUHIDOU (2003)); c, (HOURI et al., 1999); d, (GOSWAMEE et al., 1998); e, (AGGARWAL et al., 1999); f, (BAES et al., 1997).