Abstracts
Résumé
L’embryon du nématode Caenorhabditis elegans représente un système expérimental de choix pour disséquer les mécanismes qui orchestrent les processus de division cellulaire dans un organisme multicellulaire. En effet, un faisceau d’approches cellulaires, génétiques, moléculaires et génomiques permettent d’aborder chez cet organisme nombre de questions fondamentales relatives à la division cellulaire. Certaines des molécules caractérisées chez ce nématode pourraient jouer un rôle important dans d’autres organismes, y compris l’être humain. Dès lors, la recherche fondamentale menée sur l’embryon de C. elegans devrait avoir, à terme, un impact significatif sur le développement de nouveaux outils diagnostiques et thérapeutiques.
Summary
The mechanisms orchestrating spatial cell division control remain poorly understood. In animal cells, the position of the mitotic spindle dictates cleavage furrow placement, and thus plays a key role in governing spatial relationships between resulting daughter cells. The one-cell stage Caenorhabditis elegans embryo is an attractive model system to investigate the mechanisms underlying spindle positioning in metazoans. In this review, the experimental advantages of this model system for an in vivo dissection of cell division processes are first discussed. Next, three lines of experiments that were conducted to dissect the mechanisms governing spindle positioning in one-cell stage C. elegans embryos are summarized. First, localized laser micro-irradiations were utilized to identify the forces acting on spindle poles during anaphase. This work revealed that there is a precise imbalance of pulling forces acting on the two spindle poles, with the forces acting on the posterior spindle pole being in slight excess, thus explaining the asymmetric spindle position achieved by the end of anaphase. Second, an RNAi-based fonctional genomic screen was carried out to identify novel components required for generating these pulling forces. This uncovered that gpr-1/gpr-2, which encode GoLoco-containing proteins, as well as the previously identified Ga subunits goa-1/gpa-16, are required for generation of pulling forces on the spindle poles. Third, the zyg-8 locus was identified by mutational analysis to play a distinct role during anaphase spindle positioning. zyg-8 was found to encode a protein related to human Doublecortin, which is affected in patients with neuronal migration disorders. Moreover, ZYG-8 is a microtubule-associated protein that stabilizes microtubules against depolymerization. Together, these experimental approaches contribute to a better understanding of the mechanisms orchestrating spatial cell division control in metazoan organisms.
Article body
Les processus de division cellulaire doivent être finement contrôlés au cours du développement afin de permettre la constitution d’un organisme formé d’un nombre adéquat de cellules correctement disposées dans l’architecture tissulaire. Plusieurs maladies chez l’être humain, notamment certaines formes de cancer, sont dues à des erreurs de division cellulaire. L’élucidation des mécanismes gouvernant ce processus est donc cruciale pour l’acquisition de nouveaux outils diagnostiques et thérapeutiques.
Au cours des vingt dernières années, de nombreux travaux ont démontré que les mécanismes fondamentaux orchestrant la progression du cycle cellulaire sont remarquablement conservés au cours de l’évolution. Ces recherches ont été couronnées par l’attribution du prix Nobel 2001 de médecine à Leland H. Hartwell, R.Thimothy Hunt et Paul M. Nurse ((→) m/s 2001, n°11, p. 1226). Cette conservation au cours de l’évolution implique que les mécanismes identifiés sur des organismes expérimentaux relativement simples peuvent permettre des avancées thérapeutiques pour l’être humain. Par exemple, la mise en évidence que les kinases CDK (cyclin-dependent-kinase) sont un moteur universel dans la progression du cycle cellulaire de toutes les cellules eucaryotes a conduit à l’identification de molécules qui interfèrent avec leur activité [1]. Plusieurs de ces molécules sont actuellement en test clinique de phases II et III et auront peut-être un effet anti-tumoral efficace chez les patients.
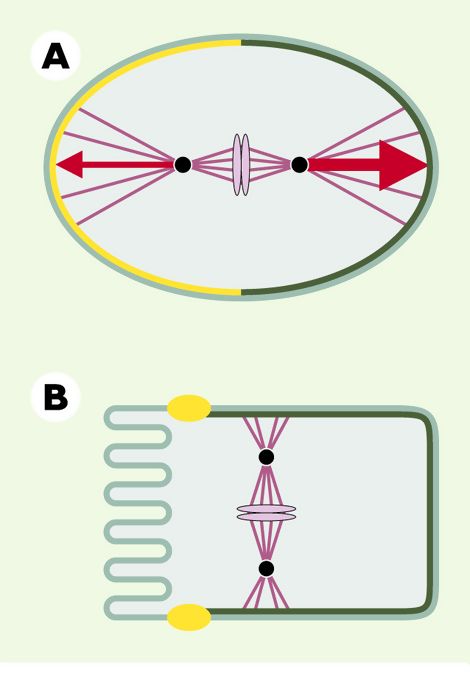
Si les mécanismes assurant le contrôle temporel du cycle cellulaire sont relativement bien connus, il n’en va pas de même pour ceux qui gouvernent le contrôle spatial de la division cellulaire. Or, la position du fuseau mitotique joue un rôle prépondérant dans ces processus. Dans les cellules animales, la position du fuseau mitotique durant l’anaphase détermine la position du sillon de clivage qui est formé à distance égale des deux pôles du fuseau, et perpendiculairement à celui-ci, et définit par conséquent la taille relative des cellules filles [2]. Un fuseau localisé au centre de la cellule conduit à une division égale, tandis qu’un fuseau excentré conduit à une division inégale, engendrant des cellules filles de taille différente (Figure 1A). De telles divisions asymétriques sont fréquentes au cours du développement d’organismes multicellulaires où elles contribuent à la production de la diversité cellulaire. Par ailleurs, la position du fuseau mitotique détermine la disposition des cellules filles dans l’architecture tissulaire (Figure 1B). Un fuseau orienté parallèlement à un épithélium conduit les deux cellules filles à demeurer dans le plan épithélial, tandis qu’un fuseau orienté perpendiculairement à cet épithélium conduit au départ de l’une des deux cellules filles du plan épithélial. De telles divisions perpendiculaires ont lieu lors du développement du système nerveux central par exemple, aussi bien chez les invertébrés que chez les vertébrés. La position du fuseau mitotique doit être également coordonnée avec les axes de polarité cellulaire, afin de permettre à des molécules polarisées dans la cellule mère d’être héritées par l’une ou l’autre des cellules filles (Figures 1A et 1B). Par conséquent, la position du fuseau mitotique est cruciale pour assurer la ségrégation des facteurs qui dirigent le développement. Malgré leur importance, les mécanismes orchestrant le contrôle spatial de la division cellulaire, et en particulier le positionnement du fuseau mitotique, demeurent mal compris.
Figure 1
La position du fuseau mitotique détermine la taille relative et la relation spatiale entre cellules filles.
Cercles noirs: pôles du fuseau; lignes violet foncé: microtubules du fuseau et microtubules astraux; ovales violet clair: chromosomes; cercles oranges : noyau ; ligne discontinue bleu foncé: sillon de clivage; ovales rouge: jonctions serrées des cellules épithéliales; ronds jaunes: facteurs développementaux. A. Un fuseau localisé au centre de la cellule mère produit deux cellules filles de taille identique (à gauche), tandis qu’un fuseau excentré produit deux cellules filles de taille différente (à droite). B. Un fuseau orienté parallèlement au plan épithélial conduit les deux cellules filles à demeurer dans l’épithélium (à gauche), tandis qu’un fuseau orienté perpendiculairement à ce plan conduit une des deux cellules filles à quitter l’épithélium (à droite). La position du fuseau mitotique détermine également la distribution de facteurs développementaux dans les cellules filles. Par exemple, des facteurs présents du côté basal de la cellule mère (B) seront répartis dans les deux cellules filles si le fuseau est orienté parallèlement à l’épithélium (à gauche), ou ne seront hérités que par l’une des deux cellules filles si le fuseau est orienté perpendiculairement à l’épithélium (à droite) (d’après [44]).
Cet article résume nos travaux récents portant sur les mécanismes gouvernant la position du fuseau mitotique dans la cellule-oeuf (ou zygote) de C. elegans.
Développement de l’embryon précoce de C. elegans
Chez C. elegans, l’axe de polarité antéro-postérieure est établi peu après la fertilisation. Un constituant du spermatozoïde, qui correspond vraisemblablement à la capacité qu’ont les centrosomes d’origine paternelle de nucléer des microtubules, détermine le pôle postérieur de l’embryon [3, 4] ((→) m/s 2002, n°11, p. 1157). Le signal issu du spermatozoïde est ensuite transmis par l’action de gènes maternels. Ces gènes codent pour six protéines PAR (partitioning-defective), pour la protéine kinase C atypique PKC-3, pour la petite protéine G CDC-42, ainsi que pour des composants du cytosquelette d’actine [5, 6]. De fait, plusieurs protéines PAR ont une distribution polarisée dans le zygote de C. elegans(Figure 2A). PAR-3 et PAR-6, par exemple, des protéines contenant des motifs PDZ (PSD-95/Disc-large/ZO-1), sont concentrées dans le cortex antérieur [7, 8]. À l’inverse, PAR-1, une sérine-thréonine protéine kinase, et PAR-2, une protéine contenant un domaine ring-finger, sont toutes deux concentrées dans le cortex postérieur [9, 10]. Ainsi, une distribution polarisée des protéines PAR permettrait d’établir la polarité cellulaire le long de l’axe antéro-postérieur.
Figure 2
La distribution polarisée de certaines protéines PAR est conservée au cours de l’évolution des organismes multicellulaires.
Symboles similaires à ceux de la Figure 1. A. Zygote de C. elegans juste après la métaphase. PAR-3 (jaune) est localisé dans le cortex antérieur, tandis que PAR-1 (vert foncé) est localisé dans le cortex postérieur. Les vecteurs de force tirant sur les pôles du fuseau mitotique sont représentés en rouge, le vecteur postérieur étant supérieur au vecteur antérieur. B. Cellule épithéliale de mammifère en mitose. ASIP, l’homologue de PAR-3 (jaune), est localisé au niveau des jonctions serrées situées du côté apical de la cellule, tandis qu’un homologue de PAR-1 (vert foncé) est localisé sous la membrane baso-latérale.
Des homologues des protéines PAR ont été identifiés chez d’autres organismes multicellulaires, où ils ont également fréquemment une distribution polarisée. Dans les cellules épithéliales de mammifère, ASIP (atypical PKC isotype-specific interacting protein), l’homologue de PAR-3, est présent dans les jonctions serrées situées du côté apical, tandis que l’homologue de PAR-1 est localisé le long de la membrane baso-latérale (Figure 2B) [11, 12]. De telles observations, qui ont également été faites chez la drosophile, suggèrent que la fonction des protéines PAR dans l’établissement de la polarité cellulaire a été conservée au cours de l’évolution des organismes multicellulaires [13].
Chez C. elegans, l’action des protéines PAR conduit ensuite à une distribution différentielle, le long de l’axe antéro-postérieur, de facteurs essentiels au développement de l’embryon. Par exemple la protéine PIE-1 (pharyngeal and intestinal excess), qui joue un rôle important dans la différenciation des descendants du blastomère postérieur, est présente initialement partout dans le cytoplasme du zygote, puis se concentre au pôle postérieur lors du premier cycle cellulaire [14]. Les protéines MEX-5/MEX-6 (muscle excess), qui sont requises pour la différenciation des descendants du blastomère antérieur, sont au contraire localisées au pôle antérieur du zygote, en réponse à l’action des protéines PAR [15] ((→) m/s 2002, n°1, p. 97).
Au cours des dix dernières années, de nombreuses études ont été consacrées à des molécules comme PIE-1 ou MEX-5/MEX-6, dont la distribution est contrôlée par le système PAR et qui organisent la mise en place des feuillets embryonnaires [16]. De ce fait, les mécanismes orchestrant le développement précoce de l’embryon de C. elegans sont relativement bien connus. En revanche, ce n’est que récemment que le potentiel de ce système expérimental, pour aborder des questions relatives à la division cellulaire, a été reconnu et exploité.
Approches expérimentales pour disséquer les processus de division cellulaire dans l’embryon de C. elegans
Le zygote de C. elegans mesure 50 μm de long et se divise rapidement (la mitose à proprement parler dure environ 2 minutes): il constitue donc un système expérimental de choix pour disséquer les processus de division cellulaire dans le contexte d’un organisme en développement. Pour ce faire, une batterie d’approches expérimentales est à la disposition des chercheurs. La vidéo-microscopie permet l’observation des embryons vivants avec une grande résolution temporelle et spatiale [17]. Utilisée sur des animaux transgéniques exprimant des marqueurs de la division cellulaire fusionnés à la GFP (green fluorescent protein), comme la tubuline ou les histones, elle permet d’examiner la dynamique de ces molécules-clés [18] (Figure 3). Par ailleurs, le zygote de C. elegans peut être soumis à l’action d’agents chimiques ou physiques (par exemple, un faisceau laser localisé) qui perturbent le cytosquelette et permettent de révéler les principes qui sous-tendent les processus de division cellulaire [19, 20]. L’isolement de mutants par mutagenèse conventionnelle combinée à l’analyse par vidéo-microscopie permet de caractériser de nouveaux gènes requis pour l’un ou l’autre des processus de division cellulaire (Encadré 1 et Figure 5) [21, 22]. En outre, le génome de C. elegans étant entièrement séquencé, l’analyse moléculaire de locus définis par mutagenèse est grandement facilitée. En outre, cela a permis de réaliser des criblages de génomique fonctionnelle par la technique d’interférence par l’ARN qui permet d’inactiver un grand nombre de gènes et de déterminer ainsi l’identité de ceux requis pour l’un ou l’autre des processus de division cellulaire (Encadré 2) [23-26].
Figure 3
Séquence du processus de division cellulaire chez le zygote de C. elegans.
Images issues d’une séquence de vidéo-microscopie conduite sur un embryon transgénique exprimant l’histone H2B fusionnée à la GFP (green fluorescent protein), ce qui permet la visualisation de l’ADN (fluorescence verte). L’embryon mesure environ 50 μm de long; son pôle antérieur est situé à gauche, son pôle postérieur à droite. Le temps écoulé est indiqué en minutes et en secondes; le temps 0 correspond à 30 minutes environ après la fécondation. Les flèches indiquent la position des centrosomes (C), puis des pôles du fuseau mitotique (D). A. Le pronoyau femelle (à gauche) et le pronoyau mâle (à droite) sont visibles. B. Le pronoyau femelle migre vers le pronoyau mâle, qui lui-même s’éloigne du pôle postérieur et les pronoyaux se rencontrent. C. Les deux centrosomes entreprennent une rotation de 90° qui les repositionne le long de l’axe antéro-postérieur. Le fuseau se met en place au centre de la cellule. D. Le fuseau se déplace vers le pôle postérieur durant l’anaphase. E. Ce déplacement conduit à une division asymétrique qui scinde le zygote en un grand blastomère antérieur et un petit blastomère postérieur. Il faut noter que chacun de ces processus de division cellulaire peut être affecté chez des mutants ou par l’inactivation de gènes par interférence par l’ARN.
Position du fuseau mitotique et division asymétrique du zygote de C. elegans
Comme nous l’avons vu précédemment, les protéines PAR jouent un rôle primordial dans le contrôle de la position du fuseau mitotique dans le zygote de C. elegans. Ce zygote se divise de manière asymétrique, engendrant un blastomère antérieur légèrement plus grand que le blastomère postérieur (Figures 3E et 4A). Dans la souche sauvage, le fuseau mitotique se met en place le long de l’axe antéro-postérieur et au centre de la cellule (Figure 3C). Lorsque le fuseau s’allonge au cours de l’anaphase, son pôle antérieur reste relativement immobile, tandis que son pôle postérieur est déplacé vers le cortex postérieur. Ainsi, le fuseau occupe une position excentrée à la fin de la mitose (Figure 3D). En revanche, dans les mutants par, la polarité antéro-postérieure n’est pas mise en place, le déplacement vers le pôle postérieur n’a pas lieu, et le zygote se divise de manière symétrique [27] (Figure 4B).
Figure 4
Mutations affectant la division du zygote de C. elegans.
A. Embryon sauvage. B. Mutant par-3. C. Mutant zyg-8. Alors que le zygote se divise de façon asymétrique dans la souche sauvage, engendrant un blastomère antérieur légèrement plus grand que le blastomère postérieur (A), le zygote se divise de manière symétrique dans le mutant par-3, engendrant deux blastomères de taille identique (B). Dans le mutant zyg-8, le fuseau mitotique est éxagérément déplacé vers le pôle postérieur, engendrant une première division aberrante (C).
Les mécanismes permettant aux protéines PAR de diriger la position exacte du fuseau mitotique le long de l’axe antéro-postérieur sont mal compris. Pour aborder cette question, nous avons utilisé plusieurs approches méthodologiques qui sont exposées ci-dessous.
Forces déterminant la position du fuseau mitotique
Des expériences menées dans des systèmes autres que C. elegans ont montré que deux types de forces agissent sur les pôles du fuseau mitotique et peuvent contribuer à l’élongation du fuseau au cours de l’anaphase. D’une part, des forces agissant sur les microtubules anti-parallèles qui émanent des pôles et se croisent au centre du fuseau, forces qui « poussent » les deux pôles en direction du cortex de la cellule [29]. D’autre part, des forces agissant sur les microtubules astraux qui émanent des pôles et les relient au cortex, forces qui « tirent » les deux pôles vers le cortex cellulaire [30]. La contribution de ces deux types de forces sur les pôles du fuseau peut être testée en coupant les microtubules du fuseau à l’aide d’un faisceau laser localisé. Si l’élongation du fuseau mitotique durant l’anaphase est strictement due aux forces agissant sur les microtubules anti-parallèles du fuseau, les deux pôles ne devraient plus se séparer après coupure au laser. Au contraire, si l’élongation se fait au moins en partie grâce à des forces agissant sur les microtubules astraux, les deux pôles devraient toujours se séparer en l’absence du fuseau et pourraient même se séparer plus rapidement, à l’image de ce qui se produit lorsque deux personnes tirent chacune l’extrêmité d’une corde et que celle-ci se rompt brutalement ((→) m/s 2001, n°3, p. 355).
Nous avons réalisé ce type d’expérience sur le zygote de C. elegans, en utilisant un faisceau laser d’une longueur d’onde de 337 nm, optimale pour la destruction de microtubules dans un organisme vivant [28]. Un faisceau relativement petit (environ 2 μm de diamètre) permet la destruction spécifique des microtubules du fuseau sans léser les microtubules astraux. On observe que les deux pôles du fuseau se séparent extrêmement rapidement après la coupure du fuseau. Des forces externes au fuseau, qui vraisemblablement tirent sur les microtubules astraux, jouent donc un rôle prépondérant dans l’élongation du fuseau mitotique dans le zygote de C. elegans.
Par ailleurs, nous avons remarqué que les deux pôles du fuseau se comportent différemment l’un de l’autre après la coupure, la différence la plus notoire étant que la vitesse du pôle postérieur excède légèrement celle du pôle antérieur, ce qui suggère que les forces tirant sur le pôle postérieur sont légèrement supérieures à celles tirant sur le pôle antérieur. Cette différence entre l’intensité des forces tirant sur les deux pôles peut expliquer la position légèrement excentrée du fuseau mitotique observée au terme de l’anaphase dans la souche sauvage. Des expériences similaires effectuées sur des mutants par-2 et par-3 indiquent que cet équilibre précis est contrôlé par les protéines PAR [28]. L’ensemble de ces données suggère que c’est la polarité axiale antéro-postérieure, via le système PAR, qui contrôle l’ampleur des forces tirant sur les pôles du fuseau mitotique au cours de la division asymétrique du zygote de C. elegans(Figure 2A) [28] ((→) m/s 1999, n°5, p. 695).
Molécules nécessaires aux forces agissant sur les pôles du fuseau mitotique
Quelles sont les molécules permettant de traduire la polarité axiale antéro-postérieure en forces différentielles tirant sur les pôles du fuseau mitotique? Des résultats récents impliquent des sous-unités α (Gα) des protéines G hétérotrimériques. En effet, l’inactivation simultanée par interférence par l’ARN de deux de ces sous-unités, goa-1 (G-0 protein α subunit) et gpa-16 (G protein α subunit), conduit à une première division symétrique [31]. Le même phénotype est obtenu lors de l’inactivation par interférence par l’ARN grp-1 et gpr-2 (G protein regulator), qui codent pour des protéines contenant un domaine GoLoco caractéristique de protéines interagissant avec des sous-unités Gα. Une sous-unité Gα et une protéine contenant un domaine GoLoco sont également impliquées dans la division asymétrique des neuroblastes chez la drosophile, suggérant que certaines des molécules gouvernant ces processus ont été conservées au cours de l’évolution des métazoaires [32, 33].
Dans le cas de C. elegans, l’inactivation de ces molécules par interférence par l’ARN ne semble pas affecter la polarité axiale antéro-postérieure, puisque la distribution des protéines PAR après inactivation est identique à celle observée dans la souche sauvage [31]. Il n’en va pas de même des forces tirant sur les pôles du fuseau. En effet, des expériences de coupure du fuseau au moyen du faisceau laser localisé après inactivation par interférence par l’ARN ont révélé que les forces tirant sur les deux pôles sont identiques et extrêmement amoindries par rapport à la souche sauvage. goa-1/gpa-16, de même que gpr-1/gpr-2, sont donc nécessaires pour engendrer les forces tirant sur les pôles du fuseau. Il reste à établir le rôle précis de ces molécules dans ce processus. Des sous-unités Gα de mammifère peuvent influencer la dynamique des microtubules in vitro [34], suggérant qu’un mécanisme analogue pourrait jouer un rôle in vivo pour la production de forces le long des microtubules astraux dans le zygote de C. elegans.
ZYG-8: régulateur de la formation des microtubules durant l’anaphase
Lors du criblage par vidéo-microscopie de mutants affectés dans le processus de division cellulaire, nous avons identifié des mutations dans le gène zyg-8 (zygotic defective) [35]. Le positionnement du fuseau dans les embryons mutants zyg-8 est altéré de façon spectaculaire. En effet, bien que le fuseau se forme en général normalement, il est déplacé de manière excessive vers le pôle postérieur de la cellule durant l’anaphase, conduisant à une première division aberrante (Figure 4C). Alors que la distribution des protéines PAR n’est pas affectée dans les mutants zyg-8, les microtubules sont plus courts que dans la souche sauvage. zyg-8 serait donc requis pour la croissance ou la stabilité des microtubules durant l’anaphase. Un phénotype similaire est obtenu en traitant des embryons sauvages durant l’anaphase avec le nocodazole, une molécule qui déstabilise les microtubules. Cette observation étaye l’hypothèse selon laquelle le déplacement exagéré du fuseau vers le pôle postérieur de l’embryon mutant zyg-8 serait bien dû à un défaut au niveau des microtubules.
La protéine codée par zyg-8 comprend, d’une part, un domaine kinase et, d’autre part, un domaine apparenté à la Doublecortine. La protéine Doublecortine humaine est codée par un gène qui est muté chez des patients présentant une lissencéphalie (absence de circonvolutions cérébrales) liée au chromosome X ou atteints du syndrome du double cortex [36, 37]. Ces maladies résultent de défauts de migration neuronale au cours du développement du système nerveux central, migration qui requiert une modulation appropriée du cytosquelette de microtubules. La protéine ZYG-8, à l’instar de la protéine Doublecortine elle-même, peut interagir avec les microtubules in vitro et in vivo, et peut également les protéger contre les effets dépolymérisants du nocodazole ou du froid. Ainsi, la fonction du domaine protéique qui contrôle la dynamique des microtubules est conservée au cours de l’évolution des organismes multicellulaires. C’est une preuve supplémentaire que des découvertes fondamentales effectuées dans des organismes comme C. elegans ont des implications importantes pour la compréhension de phénomènes analogues dans d’autres organismes, y compris l’être humain ((→) m/s 1999, n°11, p. 1293).
Conclusions
Cet article illustre comment l’utilisation du zygote de C. elegans, comme système expérimental modèle, permet l’acquisition d’une meilleure connaissance des mécanismes orchestrant le contrôle spatial de la division cellulaire. Cette illustration aurait également pu être effectuée en traitant d’autres processus fondamentaux pour la division cellulaire, tels que la duplication du centrosome ou la cytocinèse (Encadré 1 et Figure 5). Il est d’ores et déjà établi que certains des mécanismes et des molécules gouvernant les processus de division cellulaire chez ce nématode ont été conservés au cours de l’évolution. Par conséquent, à terme, l’étude de cet organisme simple devrait permettre le développement de nouveaux outils diagnostiques et thérapeutiques.
Figure 5
Mutants affectant la duplication du centrosome et la cytocinèse.
A, B. Immunofluorescence d’embryons en mitose de la souche sauvage (A) ou du mutant sas-1 (spindle assembly) en utilisant des anticorps contre la tubulineα (vert) et contre ZYG-9 (marqué en rouge, mais apparaissant en jaune en raison de la superposition avec le vert), un constituant du centrosome. Noter que deux centrosomes sont présents à ce stade dans l’embryon sauvage, mais un seul chez le mutant (images fournies par Marie Delattre). C, D. Images de microscopie à contraste de phase d’un embryon sauvage (C) ou d’un mutant cyk-1 (D) peu de temps après la cytocinèse du zygote. Noter que les deux noyaux filles (deux flèches vers la droite) se retrouvent dans le même cytoplasme chez le mutant après la régression du sillon de clivage. De plus, un troisième noyau est visible (flèche vers la gauche), provenant de la régression du sillon de clivage du second globule polaire (voir [21] pour plus de détails).
Appendices
Remerciements
Je tiens à remercier Jean-Michel Bellanger et Marie Delattre pour avoir contribué à améliorer le manuscrit, et Marie Delattre également pour avoir fourni les images des figures 5A et 5B. Les travaux de mon laboratoire sont soutenus par le Fonds National Suisse pour la Recherche Scientifique, la Ligue Suisse contre le Cancer et le EMBO Young Investigator Program.
Références
- 1. Sausville EA. Complexities in the development of cyclin-dependent kinase inhibitor drugs. Trends Mol Med 2002; 8: S32-7.
- 2. Rappaport R. Cytokinesis in animal cells. Int Rev Cytol 1971; 31: 169-213.
- 3. Wallenfang MR, Seydoux G. Polarization of the anterior-posterior axis of C. elegans is a microtubule-directed process. Nature 2000; 408 : 89-92.
- 4. Goldstein B, Hird SN. Specification of the anteroposterior axis in Caenorhabditis elegans. Development 1996; 122: 1467-74.
- 5. Kemphues KJ, Strome S. Fertilization and establishment of polarity in the embryo. In: Riddle DL, Blumenthal T, Meyer BJ, Priess JR, eds. C. elegans II. New York : Cold Spring Harbor Laboratory Press, 1997 : 335-59.
- 6. Gotta M, Ahringer J. Axis determination in C. elegans: initiating and transducing polarity. Curr Opin Genet Dev 2001; 11 : 367-73.
- 7. Etemad-Moghadam B, Guo S, Kemphues KJ, Asymmetrically distributed PAR-3 protein contributes to cell polarity and spindle alignement in early C. elegans embryos. Cell 1995; 83: 743-52.
- 8. Hung TJ, Kemphues KJ. PAR-6 is a conserved PDZ domain-containing protein that colocalizes with PAR-3 in Caenorhabditis elegans embryos. Development 1999; 126: 127-35.
- 9. Boyd L, Guo S, Levitan D, Stinchcomb DT, Kemphues KJ. PAR-2 is asymmetrically distributed and promotes association of P granules and PAR-1 with the cortex in C. elegans embryos. Development 1996; 122: 3075-84.
- 10. Guo S, Kemphues KJ. par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed. Cell 1195; 81: 611-20.
- 11. Izumi Y, Hirose T, Tamai Y, et al. An atypical PKC directly associates and colocalizes at the epithelial tight junction with ASIP, a mammalian homologue of Caenorhabditis elegans polarity protein PAR-3. J Cell Biol 1998; 143: 95-106.
- 12. Bohm H, Brinkmann V, Drab M, Henske A, Kurzchalier TV. Mammalian homologues of C. elegans PAR-1 are asymmetrically localized in epithelial cells and may influence their polarity. Curr Biol 1997; 7: 603-6.
- 13. Kemphues K. PARsing embryonic polarity. Cell 2000; 101: 345-8.
- 14. Mello CC, Schubert C, Draper B, et al. The PIE-1 protein and germline specification in C. elegans embryos. Nature 1996; 382: 710-2.
- 15. Schubert CM, Lin R, de Vries CJ, Plasterk RH, Priess JR. MEX-5 and MEX-6 function to establish soma/germline asymmetry in early C. elegans embryos. Mol Cell 2000; 5: 671-82.
- 16. Bowerman B. Maternal control of pattern formation in early Caenorhabditis elegans embryos. Curr Top Dev Biol 1998; 39: 73-117.
- 17. Sulston JE, Schierenberg E, White JG, Thomson JN. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev Biol 1983; 100: 64-119.
- 18. Oegema K, Desai A, Rybina M, Kirkham M, Hyman AA. Functional analysis of kinetochore assembly in Caenorhabditis elegans. J Cell Biol 2001; 153: 1209-26.
- 19. Strome S, Wood WB. Generation of asymmetry and segregation of germ-line granules in early C. elegans embryos. Cell 1983; 35: 15-25.
- 20. Hyman AA. Centrosome movement in the early divisions of Caenorhabditis elegans: a cortical site determining centrosome position. J Cell Biol 1989; 109: 1185-93.
- 21. Gönczy P, Schnabel H, Kaletta T, et al. Dissection of cell division processes in the one cell stage Caenorhabditis elegans embryo by mutational analysis. J Cell Biol 1999; 144: 927-46.
- 22. O’Connell KF, Leys CM, White JG. A genetic screen for temperature-sensitive cell-division mutants of Caenorhabditis elegans. Genetics 1998; 149: 1303-21.
- 23. Fraser AG, Kamath RS, Zipperlen P, Martinez-Campos M, Sohmann M, Ahringer J. Functional genomic analysis of C. elegans chromosome I by systematic RNA interference. Nature 2000; 408: 325-30.
- 24. Gönczy P, Echeverri G, Degema K, et al. Functional genomic analysis of cell division in C. elegans using RNAi of genes on chromosome III. Nature 2000 ; 408: 331-6.
- 25. Piano F, Schetter AJ, Mangona M, Stain L, Komphues KJ. RNAi analysis of genes expressed in the ovary of Caenorhabditis elegans. Curr Biol 2000; 10: 1619-22.
- 26. Maeda I, Kohara Y, Yamamoto M, Sugimoto A. Large-scale analysis of gene function in Caenorhabditis elegans by high-throughput RNAi. Curr Biol 2001; 11: 171-6.
- 27. Kemphues KJ, Priess JR, Morton DG, Cheng NS. Identification of genes required for cytoplasmic localization in early C. elegans embryos. Cell 1988; 52: 311-20.
- 28. Grill SW, Gönczy P, Stelzer EH, Hymen AA. Polarity controls forces governing asymmetric spindle positioning in the Caenorhabditis elegans embryo. Nature 2001; 409: 630-3.
- 29. Leslie RJ, Pickett HJ. Ultraviolet microbeam irradiations of mitotic diatoms: investigation of spindle elongation. J Cell Biol 1983; 96: 548-61.
- 30. Aist JR, Liang H, Mangona M, Stain L, Komphues KJ. Astral and spindle forces in PtK2 cells during anaphase B: a laser microbeam study. J Cell Sci 1993; 104: 1207-16.
- 31. Gotta M, Ahringer J. Distinct roles for Gα and Gβγ in regulating spindle position and orientation in Caenorhabditis elegans embryos. Nat Cell Biol 2001; 3: 297-300.
- 32. Schaefer M, Petronczki M, Dorner D, Forto M, Knoblirh JA. Heterotrimeric G proteins direct two modes of asymmetric cell division in the Drosophila nervous system. Cell 2001; 107: 183-94.
- 33. Schaefer M, Shevchenko A, Knoblich JA. A protein complex Shevchemke A, containing Inscuteable and the Gα-binding protein Pins orients asymmetric cell divisions in Drosophila. Curr Biol 2000; 10: 353-62.
- 34. Roychowdhury S, Panda D, Wilson L, Rasemick MH. G protein α subunits activate tubulin GTPase and modulate microtubule polymerization dynamics. J Biol Chem 1999; 274: 13485-90.
- 35. Gönczy P, Bellanger JM, Kirkham M, et al. zyg-8, a gene required for spindle positioning in C. elegans, encodes a doublecortin-related kinase that promotes microtubule assembly. Dev Cell 2001; 1: 363-75.
- 36. des Portes V, Pinard JM, Billuart P, et al. A novel CNS gene required for neuronal migration and involved in X-linked subcortical laminar heterotopia and lissencephaly syndrome. Cell 1998; 92: 51-61.
- 37. Gleeson JG, Allen KM, Fox JW, et al. Doublecortin, a brain-specific gene mutated in human X-linked lissencephaly and double cortex syndrome, encodes a putative signaling protein. Cell 1998; 92: 63-72.
- 38. O’Connell KF, Caron C, Kopish KR, et al. The C. elegans zyg-1 gene encodes a regulator of centrosome duplication with distinct maternal and paternal roles in the embryo. Cell 2001; 105: 547-58.
- 39. Jantsch-Plunger V, Gönczy P Romano A, et al. CYK-4, a rho family GTPase activating protein (gap) required for central spindle formation and cytokinesis. J Cell Biol 2000; 149: 1391-404.
- 40. Mishima M, Kaitna S, Glotzer M, et al. Central spindle assembly and cytokinesis require a kinesin-like protein/RhoGAP complex with microtubule bundling activity. Dev Cell 2002; 2:41-54.
- 41. Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998; 391: 806-11.
- 42. Zipperlen P, Fraser AG, Lendeckel W, Yalcin A, Welber K, Tuschl T. Roles for 147 embryonic lethal genes on C. elegans chromosome I identified by RNA interference and video microscopy. EMBO J 2001; 20: 3984-92.
- 43. Elbashir SM, Harborth J, Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature 2001; 411: 494-8.
- 44. Gönczy P. Mechanisms of spindle positioning in flies and worms. Trends Cell Biol 2002; 12: 332-9.
List of figures
Figure 1
La position du fuseau mitotique détermine la taille relative et la relation spatiale entre cellules filles.
Cercles noirs: pôles du fuseau; lignes violet foncé: microtubules du fuseau et microtubules astraux; ovales violet clair: chromosomes; cercles oranges : noyau ; ligne discontinue bleu foncé: sillon de clivage; ovales rouge: jonctions serrées des cellules épithéliales; ronds jaunes: facteurs développementaux. A. Un fuseau localisé au centre de la cellule mère produit deux cellules filles de taille identique (à gauche), tandis qu’un fuseau excentré produit deux cellules filles de taille différente (à droite). B. Un fuseau orienté parallèlement au plan épithélial conduit les deux cellules filles à demeurer dans l’épithélium (à gauche), tandis qu’un fuseau orienté perpendiculairement à ce plan conduit une des deux cellules filles à quitter l’épithélium (à droite). La position du fuseau mitotique détermine également la distribution de facteurs développementaux dans les cellules filles. Par exemple, des facteurs présents du côté basal de la cellule mère (B) seront répartis dans les deux cellules filles si le fuseau est orienté parallèlement à l’épithélium (à gauche), ou ne seront hérités que par l’une des deux cellules filles si le fuseau est orienté perpendiculairement à l’épithélium (à droite) (d’après [44]).
Figure 2
La distribution polarisée de certaines protéines PAR est conservée au cours de l’évolution des organismes multicellulaires.
Symboles similaires à ceux de la Figure 1. A. Zygote de C. elegans juste après la métaphase. PAR-3 (jaune) est localisé dans le cortex antérieur, tandis que PAR-1 (vert foncé) est localisé dans le cortex postérieur. Les vecteurs de force tirant sur les pôles du fuseau mitotique sont représentés en rouge, le vecteur postérieur étant supérieur au vecteur antérieur. B. Cellule épithéliale de mammifère en mitose. ASIP, l’homologue de PAR-3 (jaune), est localisé au niveau des jonctions serrées situées du côté apical de la cellule, tandis qu’un homologue de PAR-1 (vert foncé) est localisé sous la membrane baso-latérale.
Figure 3
Séquence du processus de division cellulaire chez le zygote de C. elegans.
Images issues d’une séquence de vidéo-microscopie conduite sur un embryon transgénique exprimant l’histone H2B fusionnée à la GFP (green fluorescent protein), ce qui permet la visualisation de l’ADN (fluorescence verte). L’embryon mesure environ 50 μm de long; son pôle antérieur est situé à gauche, son pôle postérieur à droite. Le temps écoulé est indiqué en minutes et en secondes; le temps 0 correspond à 30 minutes environ après la fécondation. Les flèches indiquent la position des centrosomes (C), puis des pôles du fuseau mitotique (D). A. Le pronoyau femelle (à gauche) et le pronoyau mâle (à droite) sont visibles. B. Le pronoyau femelle migre vers le pronoyau mâle, qui lui-même s’éloigne du pôle postérieur et les pronoyaux se rencontrent. C. Les deux centrosomes entreprennent une rotation de 90° qui les repositionne le long de l’axe antéro-postérieur. Le fuseau se met en place au centre de la cellule. D. Le fuseau se déplace vers le pôle postérieur durant l’anaphase. E. Ce déplacement conduit à une division asymétrique qui scinde le zygote en un grand blastomère antérieur et un petit blastomère postérieur. Il faut noter que chacun de ces processus de division cellulaire peut être affecté chez des mutants ou par l’inactivation de gènes par interférence par l’ARN.
Figure 4
Mutations affectant la division du zygote de C. elegans.
A. Embryon sauvage. B. Mutant par-3. C. Mutant zyg-8. Alors que le zygote se divise de façon asymétrique dans la souche sauvage, engendrant un blastomère antérieur légèrement plus grand que le blastomère postérieur (A), le zygote se divise de manière symétrique dans le mutant par-3, engendrant deux blastomères de taille identique (B). Dans le mutant zyg-8, le fuseau mitotique est éxagérément déplacé vers le pôle postérieur, engendrant une première division aberrante (C).
Figure 5
Mutants affectant la duplication du centrosome et la cytocinèse.
A, B. Immunofluorescence d’embryons en mitose de la souche sauvage (A) ou du mutant sas-1 (spindle assembly) en utilisant des anticorps contre la tubulineα (vert) et contre ZYG-9 (marqué en rouge, mais apparaissant en jaune en raison de la superposition avec le vert), un constituant du centrosome. Noter que deux centrosomes sont présents à ce stade dans l’embryon sauvage, mais un seul chez le mutant (images fournies par Marie Delattre). C, D. Images de microscopie à contraste de phase d’un embryon sauvage (C) ou d’un mutant cyk-1 (D) peu de temps après la cytocinèse du zygote. Noter que les deux noyaux filles (deux flèches vers la droite) se retrouvent dans le même cytoplasme chez le mutant après la régression du sillon de clivage. De plus, un troisième noyau est visible (flèche vers la gauche), provenant de la régression du sillon de clivage du second globule polaire (voir [21] pour plus de détails).