Abstracts
Résumé
Les récepteurs couplés aux protéines G sont, pour la plupart, rapidement internalisés après stimulation. L’étude de ce phénomène s’est particulièrement développée depuis une dizaine d’années et a engendré une masse impressionnante d’informations, apparemment discordantes, qui pourraient faire croire que chaque récepteur interprète sa propre partition biologique. Le but de cet article est de souligner, à partir de travaux récents, les convergences qui existent au niveau de la fonction et des mécanismes de lde ces récepteurs, tout en soulignant certaines variations phénotypiques réelles qui reflètent des nécessités biologiques.
Summary
Most G protein-coupled receptors (GPCR) are rapidly internalized upon agonist stimulation. From the large number of studies available to date on receptor endocytosis, substantial differences seem to exist among GPCRs in terms of both the molecular pathways of receptor internalization and the biological significance of this process. The aim of this review is to outline common themes in GPCR endocytosis and to delineate true phenotypic variations, which reflect specific necessities for receptor’s function.
Article body
L’endocytose est un processus fondamental de la vie cellulaire consistant en l’internalisation vers des compartiments intracellulaires de portions de la membrane plasmique et de protéines membranaires. Les protéines membranaires sont internalisées vers des endosomes soit de façon constitutive, comme dans le cas des récepteurs impliqués dans l’approvisionnement cellulaire en nutriments (récepteur de la transferrine), soit de façon induite par la liaison de leurs ligands, comme dans le cas de récepteurs ayant un rôle de transmission du signal cellulaire.
La voie majeure d’internalisation des protéines membranaires est la voie dite dépendante de la clathrine, qui passe par des structures spécialisées de la membrane plasmique appelées puits recouverts de clathrine (CCP, clathrin coated pits). Ces structures sont caractérisées par la présence d’un manteau protéique constitué majoritairement du complexe AP-2 et de la clathrine. Le complexe adaptateur AP-2 contrôle la polymérisation de la clathrine à la membrane et sélectionne les molécules à internaliser ((→) m/s 2002, n°11, p.1126). Celles-ci se concentrent dans les CCP et sont internalisées par la fission de ceux-ci en vésicules, une étape dépendante de la dynamine.
Les récepteurs à sept domaines transmembranaires couplés aux protéines G (RCPG) représentent la plus grande famille de récepteurs. Du fait de leur nombre (1% du génome), de leur rôle fondamental dans toutes les grandes fonctions de l’organisme, et de leur importance en pharmacologie clinique (50% des dépenses en médicaments correspondent à des substances actives sur les RCPG), ces récepteurs constituent un domaine de recherche très actif.
Rôle de l’endocytose dans la régulation des RCPG
L’endocytose des RCPG a été initialement décrite et définie comme un phénomène de perte de sites récepteurs de surface au profit de leur accumulation dans des compartiments intracellulaires vésiculaires de faible densité [1]. Elle a commencé à faire l’objet d’études plus spécifiques, quand son lien fonctionnel avec le phénomène de désensibilisation [2], c’est-à-dire la perte progressive du signal cellulaire induit par un récepteur lors d’une stimulation répétée, a pu être établi. En effet, la désensibilisation est un phénomène de régulation essentiel, contrôlant finement la durée de l’activation cellulaire induite par un récepteur donné et empêchant les effets toxiques dus à sa stimulation excessive. Le rôle fonctionnel de la désensibilisation facilement démontrable dans des modèles cellulaires in vitro, est également illustré par des modèles animaux dans lesquels les voies normales de désensibilisation sont altérées. Ainsi, l’invalidation du gène codant pour l’arrestine, une protéine impliquée dans la désensibilisation du récepteur de la lumière (voirplus loin), induit une dégénérescence du photorécepteur analogue à celle qui est observée dans certaines formes de cécité congénitale humaine associées à des mutations du gène codant pour la même protéine [3]. C’est sans doute dans le domaine thérapeutique que les effets de la désensibilisation des RCPG sont les plus connus. L’administration répétée et/ou prolongée de médicaments activateurs (agonistes) des RCPG s’accompagne d’une perte progressive de leur bénéfice clinique. La résistance aux bronchodilatateurs β-adrénergiques ou aux analgésiques opioïdes en est un exemple.
Au fil du temps et des observations successives, désensibilisation et endocytose des RCPG sont apparues comme des phénomènes subtilement intriqués, la seconde apparaissant comme un modulateur de la première. L’endocytose a d’abord été perçue comme un phénomène participant à la désensibilisation [4]: «en cas de perte de sites de surface par endocytose, on s’attend logiquement à une diminution du signal». Elle a ensuite été considérée comme un phénomène sans fonction biologique certaine [5]: «les récepteurs sont désensibilisés plus rapidement qu’ils ne sont internalisés; le fait qu’ils soient en surface ou à l’intérieur de la cellule ne change pas l’amplitude du signal résiduel». Puis il a été proposé que l’endocytose limiterait la désensibilisation [6]: «après internalisation, les récepteurs redeviennent fonctionnels, pouvant recycler en surface pour un nouveau cycle d’activation». Enfin, l’endocytose est apparue à nouveau comme un élément de renforcement de la désensibilisation [7]: «certains RCPG ne recyclent pas à partir des endosomes et sont triés vers le compartiment lysosomial où ils sont dégradés». Qu’en est-il réellement? En fait, toutes les interprétations mentionnées ci-dessus sont correctes en fonction du type de récepteur étudié, de son environnement cellulaire et des fonctions biologiques qu’il contrôle.
L’événement le plus précoce au cours de la désensibilisation est la phosphorylation (en quelques secondes ou minutes) des RCPG par des sérine-thréonine kinases [8, 9]. La protéine kinase A ou la protéine kinase C, activées par les seconds messagers résultant de la transduction du signal, phosphorylent les récepteurs, indépendamment de leur conformation [9]. D’autres kinases, les GRK (G protein-coupled receptor kinase), phosphorylent spécifiquement les récepteurs dans leur conformation activée par le ligand [10]. Ces phosphorylations peuvent soit altérer directement le couplage entre RCPG et protéines G, soit favoriser la translocation de protéines cytosoliques découplantes, les β-arrestines (βarr), vers les récepteurs [11]. Ces protéines sont proches de l’arrestine visuelle mais, alors que celle-ci est exclusivement exprimée dans la rétine, où elle arrête le signal induit par l’activation de la rhodopsine, les βarr-1 et 2 sont ubiquitaires, impliquées dans la désensibilisation des autres RCPG.
Les récepteurs phosphorylés sont le plus souvent internalisés. Une fois dans les endosomes, les RCPG ont un devenir variable (Figure 1). Le pH acide des endosomes peut favoriser la dissociation entre ligand et récepteur [12]. Les récepteurs «vides» de leur ligand reprennent la conformation qu’ils avaient avant activation et sont déphosphorylés par des phosphatases du type de la protéine phosphatase 2A [13], et recyclés vers la membrane plasmique. Le récepteur β2-adrénergique [14], le récepteur opioïde µ [15] ou le récepteur de la GnRH (gonadotropin-releasing hormone) [16], sont des exemples de récepteurs qui recyclent. D’autres récepteurs, comme le récepteur opioïde δ [15] ou le récepteur PAR-1 de la thrombine [17], une fois arrivés dans le compartiment endosomique, sont au contraire dirigés vers les lysosomes où ils sont dégradés. Dans le cas du récepteur de la thrombine, le processus rapide de dégradation dans les lysosomes se justifie par le clivage protéolytique du récepteur lors de son activation, qui en fait un récepteur à usage unique. Pour les autres RCPG ne recyclant pas, l’endocytose et la dégradation qui s’ensuivent favorisent vraisemblablement une transmission du signal cellulaire extrêmement transitoire. Bien que tous les récepteurs de cette catégorie se concentrent dans les mêmes endosomes, plusieurs mécanismes moléculaires différents semblent impliqués dans le tri de ces récepteurs vers les lysosomes. Ainsi, pour le récepteur V2 de la vasopressine, la forte affinité du récepteur pour les βarr et, consécutivement, le maintien de l’interaction récepteur-βarr au niveau des endosomes, semble être en cause [18]. Cette affinité accrue s’expliquerait par la présence d’un groupement de résidus sérine phosphorylés au niveau de l’extrémité carboxy-terminale du récepteur. Dans le cas du récepteur de la thrombine, l’interaction avec une protéine associée aux membranes, la nexine, déterminerait le tri de ce récepteur vers les lysosomes [19]. Un mécanisme similaire, mais mettant en jeu une autre protéine de tri, la GASP (G protein-coupled receptor associated sorting protein), serait impliqué dans la dégradation des récepteurs opioïdes δ [20]. Enfin, le rôle de l’ubiquitinylation de certains RCPG dans l’orientation de tri vers le compartiment lysosomial a récemment été démontré [21].
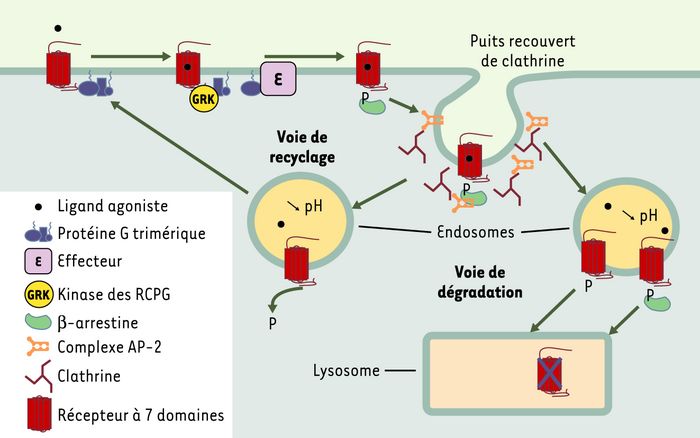
Figure 1
Endocytose des récepteurs à sept domaines transmembranaires couplés aux protéines G (RCPG) après une activation de courte durée: mécanisme principal et devenir des récepteurs internalisés.
Lorsque le ligand se lie à un récepteur, ce dernier interagit avec une protéine G trimérique qui se dissocie en sous-unités α-GTP et βγ, capables d’activer des effecteurs cellulaires (E). Très rapidement les RCPG sont phosphorylés par des kinases spécifiques (GRK) et cette phosphorylation a pour effet d’augmenter l’affinité pour la β-arrestine. La liaison de la β-arrestine sur les RCPG favorise leur entrée dans la voie d’endocytose via les puits recouverts de clathrine. En effet, la β-arrestine interagit avec la sous-unité β d’AP-2 et cette protéine adaptatrice établit un pont moléculaire entre le complexe récepteur-β-arrestine et la principale protéine du manteau de la vésicule d’endocytose, la clathrine. Une fois le compartiment endosomique atteint, le devenir des récepteurs internalisés est variable. Le plus souvent, les récepteurs sont déphosphorylés et recyclés vers la membrane plasmique, où ils peuvent à nouveau être stimulés. Du fait de spécificités de structure propres, certains récepteurs ne recyclent pas et sont dirigés vers le compartiment lysosomial pour y être dégradés. Les mécanismes moléculaires qui dirigent les récepteurs vers les lysosomes semblent multiples, incluant une forte affinité pour les β-arrestines, l’ubiquitinylation de la région cytoplasmique, ou l’association avec des protéines de tri.
En cas de stimulation prolongée (plusieurs heures) par leurs ligands agonistes, situation survenant le plus souvent dans un contexte pathologique ou thérapeutique, la plupart des récepteurs qui recyclent finissent également par êtres dégradés. Un changement de tri des RCPG, qui ne sont alors plus recyclés mais adressés aux lysosomes, semble le plus souvent en cause [22]. Les mécanismes moléculaires de ce changement de tri restent inconnus.
Mécanismes moléculaires de l’endocytose des RCPG
Le rôle, débattu, de la phosphorylation par les GRK dans le phénomène d’endocytose des récepteurs a été discuté en détail dans un article paru en 2001 [23]. Pour résumer, si la phosphorylation par les GRK n’est pas absolument indispensable à l’endocytose, elle stabilise un état conformationnel des RCPG qui leur permet d’interagir avec des partenaires moléculaires impliqués dans la machinerie de l’endocytose. En particulier, l’affinité des βarr pour les récepteurs est accrue quand ces derniers sont phosphorylés par les GRK [24]. Des données récentes indiquent que les GRK contribueraient également à l’étape d’internalisation en recrutant la phosphatidyl inositol 3-kinase à proximité des récepteurs activés. Les modifications lipidiques résultant de l’action de cette enzyme favoriseraient l’association des récepteurs avec le complexe adaptateur AP-2 [25].
Outre leur rôle dans la désensibilisation des récepteurs (voirplus haut), les βarr se sont révélées comme étant des molécules clés dans le processus d’internalisation des RCPG par les CCP [24]. Il a d’abord été montré que les βarr se lient avec une forte affinité à la clathrine in vitro [26] et qu’elles sont recrutées dans les CCP avec les RGPG après stimulation des récepteurs par leurs ligands agonistes. Ces données ont initialement suggéré que les βarr pourraient jouer un rôle d’adaptateur moléculaire direct entre RCPG et clathrine, comparable à celui du complexe AP-2. Cette hypothèse a cependant été remise en question par deux observations: contrairement à AP-2, les βarr ne sont pas capables de favoriser la polymérisation de la clathrine [27], et des formes mutantes incapables de se lier à la clathrine [28] ont toujours un effet stimulant sur l’endocytose des RCPG [29]. Le fait que les βarr interagissent également avec une des sous-unités du complexe AP2 [30] a permis de proposer un modèle alternatif compatible avec toutes les informations précédentes: les βarr constitueraient un pont moléculaire entre les RCPG activés et le complexe AP-2. Ce modèle s’est trouvé renforcé par l’observation selon laquelle des formes mutantes des βarr dépourvues des deux résidus arginine indispensables à l’interaction avec AP-2, ne sont plus recrutées au sein des CCP après stimulation des RCPG [30]. Ces données n’excluent pas, cependant, que l’interaction directe entre βarr et clathrine ait une fonction au cours du processus d’internalisation.
À la lumière de ces résultats, obtenus pour la plupart en utilisant le récepteur β2-adrénergique comme modèle, et de l’identification de nouveaux outils supposés inhiber spécifiquement les voies d’endocytose dépendante (mutants de la dynamine) ou indépendante de la clathrine (agents fixant le cholestérol qui inhibent l’endocytose via les cavéoles), de nombreuses études ont été conduites avec d’autres RCPG pour identifier leurs voies d’endocytose particulières. Pour chaque récepteur étudié, l’endocytose a ainsi été classée en fonction de sa sensibilité aux inhibiteurs mentionnés ci-dessus et aux mutants dominants négatifs des βarr (pour revue, voir [23]). Une telle approche systématique reflétait l’idée que chaque récepteur activé était capable de recruter sa propre machinerie d’endocytose.
Que faut-il penser de la multitude de voies d’endocytose des RCPG décrites dans la littérature à la suite de ces études ? Les arguments expérimentaux ayant permis de conclure à cette grande diversité ne résistent pas aux données récentes qui ont démontré que les inhibiteurs que l’on croyait spécifiques ne l’étaient pas ((→) m/s 2002, n°11, p.1126). De plus, l’endocytose de certains RCPG, apparue comme résistante à certains mutants de la dynamine, s’est ensuite avérée sensible à d’autres mutants de la même molécule. Les effets de la transfection de mutants dominants négatifs, qui dépendent de l’efficacité de la compétition entre les protéines mutantes et les protéines résidantes dans la cellule, peuvent donner des résultats variables en fonction du type cellulaire utilisé et de son contenu en βarr ou en dynamine endogènes. Enfin, dans certaines cellules, l’inhibition de l’endocytose dépendante de la clathrine peut démasquer des voies d’endocytose accessoires [31].
Le concept selon lequel les récepteurs activés sont capables d’induire des sites d’internalisation propres, justifiant ainsi la multiplicité potentielle des voies mises en jeu pour leur internalisation, a été remis en question par des études en temps réel sur la formation des CCP. Ces études, qui ont montré que les CCP se forment dans des endroits déterminés de la membrane plasmique ou hot spots [32], s’opposent à l’hypothèse d’une formation diffuse de CCP, sur l’ensemble de la membrane plasmique, coordonnée par des récepteurs activés. Ce point a été abordé par deux études indépendantes qui, utilisant des modèles différents de RCPG, ont suivi en temps réel leur redistribution par rapport aux CCP (Figure 2) [33, 34]. Ces études montrent que les RCPG activés n’induisent pas la formation de CCP spécifiques mais qu’ils sont, au contraire, dirigés vers les CCP préexistants.
Figure 2
Les récepteurs couplés aux protéines G (RCPG) activés sont recrutés dans des puits recouverts de clathrine préexistants.
Le recrutement des RCPG activés dans les puits recouverts de clathrine (CCP) peut théoriquement se faire de deux façons. Les RCPG peuvent nucléer leurs propres puits d’endocytose (modèle 1), ou bien ils peuvent s’accumuler dans des puits préexistants impliqués dans l’endocytose constitutive (modèle 2). Afin de tester ces deux possibilités, des cellules ont été transfectées avec de l’ADN codant pour le récepteur de la TRH (thyrotropin releasing hormone), la β-arrestine 2 fusionnée à la GFP (green fluorescent protein) et la protéine Eps15 (constituant constitutif des CCP) fusionnée à une protéine fluorescente rouge, le DsRed (RFP) [33], et étudiées par fluorescence en temps réel. Des expériences préliminaires ont montré que Eps15 marque de façon stable les puits recouverts de l’endocytose constitutive dans lesquels s’accumule le récepteur de la transferrine. Il a également été vérifié que la β-arrestine 2-GFP, cytosolique à l’état basal, est transloquée vers le récepteur activé de la TRH et se co-localise totalement avec lui dans des zones ponctuelles de la membrane plasmique. Si le modèle 1 est correct, l’activation par la TRH va conduire à la formation de nouvelles zones ponctuelles qui vont apparaître colorées en vert (dans le cas où elles ne contiennent que la β-arrestine 2-GFP) ou en jaune (en cas de colocalisation avec RFP-Eps-15) dans une image superposée. Si le modèle 2 est juste, on s’attend à ce que la β-arrestine 2-GFP s’accumule en totalité dans les puits recouverts préexistants, dont la coloration apparente va passer du rouge au jaune après superposition. La partie inférieure de la figure représente 3 photogrammes de la cinétique d’activation par le TRH dans les fenêtres rouge et verte, ainsi que la superposition des images obtenues après 60 secondes. La totalité de la β-arrestine 2-GFP se concentre dans des structures ponctuelles, marquées à l’état basal par RFP-Eps-15, qui apparaissent en jaune dans l’image superposée (trois de ces structures sont indiquées par des flèches blanches). Ce résultat est totalement en accord avec le modèle 2, la β-arrestine étant recrutée dans des CCP préexistants. La possibilité de visualiser dynamiquement le devenir des récepteurs activés par leurs ligands a marqué un tournant dans ce domaine de la recherche [3].
Conclusions et perspectives
Il apparaît ainsi que l’endocytose de la grande majorité des RCPG procède d’un mécanisme général commun impliquant la voie dépendante de la clathrine. Des différences peuvent subsister d’un récepteur à l’autre ou d’une cellule à l’autre quant à l’implication plus ou moins exclusive des βarr dans ce processus. Le fait que certains récepteurs puissent, dans des circonstances particulières (type cellulaire, nature du signal), être internalisés par d’autres voies, tels les cavéoles [35, 36], pourrait être un moyen de cibler ces récepteurs vers des compartiments intracellulaires différents. Des travaux récents indiquent, en effet, que des molécules accumulées dans les radeaux lipidiques sont internalisées via des vésicules non recouvertes vers une population d’endosomes distincts, en route pour l’appareil de Golgi [37].
Maintenant que des lois biologiques communes régissant l’endocytose des RCPG ont été établies, d’autres questions restent à élucider pour en comprendre complètement le mécanisme. Dans leur conformation de repos, les RCPG localisés dans la membrane plasmique sont retenus à l’écart des zones d’endocytose par des liens avec le cytosquelette. Il a été ainsi montré que certains RCPG interagissent avec la filamine, une protéine se liant à l’actine, qui assure l’amarrage des récepteurs à l’actine sous-corticale. Nous ne savons toujours pas comment la phosphorylation et/ou l’interaction avec les βarr permettent aux récepteurs activés d’être libérés de leurs liens avec le cytosquelette [38] et de rejoindre les puits recouverts de clathrine.
Appendices
Remerciements
Les auteurs remercient l’Inserm, le Cnrs, l’Université Paris 5, ainsi que l’Association pour la Recherche sur le Cancer, l’Agence Nationale de Recherches sur le Sida, qui ont contribué au financement des travaux exposés dans cet article. M.S. est boursier du Wellcome Trust Fund.
Références
- 1. Harden TK, Cotton CU, Waldo GL, Lutton JK, Perkins JP. Catecholamine-induced alteration in sedimentation behavior of membrane bound β-adrenergic receptors. Science 1980; 210: 441-3.
- 2. Mukherjee C, Lefkowitz RJ. Desensitization of β-adrenergic receptors by β-adrenergic agonists in a cell-free system: resensitization by guanosine 5’-(β, γ-imino)triphosphate and other purine nucleotides. Proc Natl Acad Sci USA 1976; 73: 1494-8.
- 3. Chen J, Simon MI, Matthes MT, Yasumura D, LaVail MM. Increased susceptibility to light damage in an arrestin knockout mouse model of Oguchi disease (stationary night blindness). Invest Ophthalmol Vis Sci 1999; 40: 2978-82.
- 4. Sibley DR, Lefkowitz RJ. Molecular mechanisms of receptor desensitization using the β-adrenergic receptor-coupled adenylate cyclase as a model. Nature 1985; 317: 124-9.
- 5. Lefkowitz RJ, Hausdorff WP, Caron MG. Role of phosphorylation in desensitization of the β-adrenoceptor. Trends Pharmacol Sci 1990; 11: 190-4.
- 6. Yu SS, Lefkowitz RJ, Hausdorff WP. β-adrenergic receptor sequestration. A potential mechanism of receptor resensitization. J Biol Chem 1993; 268: 337-41.
- 7. Hermans E, Vanisberg MA, Geurts M, Maloteaux JM. Down-regulation of neurotensin receptors after ligand-induced internalization in rat primary cultured neurons. Neurochem Int 1997; 31: 291-9.
- 8. Bouvier M, Hausdorff P, De Blasi A, et al. Removal of phosphorylation sites from the β2-adrenergic receptor delays onset of agonist-promoted desensitization. Nature 1988; 333: 370-3.
- 9. Hausdorff WP, Bouvier M, O’Dowd BF, Irons GP, Caron MG, Lefkowitz RJ. Phosphorylation sites on two domains of the β2-adrenergic receptor are involved in distinct pathways of receptor desensitization. J Biol Chem 1989; 264: 12657-65.
- 10. Lohse MJ, Lefkowitz RJ, Caron MG, Benovic JL. Inhibition of β-adrenergic receptor kinase prevents rapid homologous desensitization of β2-adrenergic receptors. Proc Natl Acad Sci USA 1989; 86: 3011-5.
- 11. Lohse MJ, Benovic JL, Codina J, Caron MG, Lefkowitz RJ. β-arrestin: a protein that regulates β-adrenergic receptor function. Science 1990; 248: 1547-50.
- 12. Krueger KM, Daaka Y, Pitcher JA, Lefkowitz RJ. The role of sequestration in G protein-coupled receptor resensitization. Regulation of β2-adrenergic receptor dephosphorylation by vesicular acidification. J Biol Chem 1997; 272: 5-8.
- 13. Pitcher JA, Payne ES, Csortos C, DePaoli-Roach AA, Lefkowitz RJ. The G-protein-coupled receptor phosphatase: a protein phosphatase type 2A with a distinct subcellular distribution and substrate specificity. Proc Natl Acad Sci USA 1995; 92: 8343-7.
- 14. Pippig S, Andexinger S, Lohse MJ. Sequestration and recycling of β2-adrenergic receptors permit receptor resensitization. Mol Pharmacol 1995; 47: 666-76.
- 15. Tsao PI, von Zastrow M. Type-specific sorting of G protein-coupled receptors after endocytosis. J Biol Chem 2000; 275: 11130-40.
- 16. Vrecl M, Anderson L, Hanyaloglu A, et al. Agonist-induced endocytosis and recycling of the gonadotropin-releasing hormone receptor: effect of β-arrestin on internalization kinetics. Mol Endocrinol 1998; 12: 1818-29.
- 17. Trejo J, Coughlin SR. The cytoplasmic tails of protease-activated receptor-1 and substance P receptor specify sorting to lysosomes versus recycling. J Biol Chem 1999; 274: 2216-24.
- 18. Oakley RH, Laporte SA, Holt JA, Barak, LS, Caron MG. Association of β-arrestin with G protein-coupled receptors during clathrin-mediated endocytosis dictates the profile of receptor resensitization. J Biol Chem 1999; 274: 32248-57.
- 19. Wang Y, Zhou Y, Szabo K, Haft CR, Trejo J. Down-regulation of protease-activated receptor-1 is regulated by sorting nexin 1. Mol Biol Cell 2002; 13: 1965-76.
- 20. Whistler JL, Enquist J, Marley A, et al. Modulation of postendocytic sorting of G protein-coupled receptors. Science 2002; 297: 615-20.
- 21. Shenoy SK, McDonald PH, Kohout TA, Lefkowitz RJ. Regulation of receptor fate by ubiquitination of activated β2- adrenergic receptor and β-arrestin. Science 2001; 294: 1307-13.
- 22. Gagnon AW, Kallal L, Benovic JL. Role of clathrin-mediated endocytosis in agonist-induced down-regulation of the β2-adrenergic receptor. J Biol Chem 1998; 273: 6976-81.
- 23. Ferguson SS. Evolving concepts in G protein-coupled receptor endocytosis: the role in receptor desensitization and signaling. Pharmacol Rev 2001; 53: 1-24.
- 24. Ferguson SS, Downey WER, Colapietro AM, Barak LS, Menard L, Caron MG. Role of β-arrestin in mediating agonist-promoted G protein-coupled receptor internalization. Science 1996; 271: 363-6.
- 25. Prasad SV, Laporte SA, Chamberlain D, Caron MG, Barak L, Rockman HA. Phosphoinositide 3-kinase regulates β2-adrenergic receptor endocytosis by AP-2 recruitment to the receptor/β-arrestin complex. J Cell Biol 2002; 158: 563-75.
- 26. Goodman OBJr, Krupnick JG, Santini F, et al. β-arrestin acts as a clathrin adaptor in endocytosis of the β2-adrenergic receptor. Nature 1996; 383: 447-50.
- 27. Goodman OBJr, Krupnick JG, Gurevich VV, Benovic JL, Keen JH. Arrestin/clathrin interaction. Localization of the arrestin binding locus to the clathrin terminal domain. J Biol Chem 1997; 272: 15017-22.
- 28. Krupnick JG, Goodman OB Jr, Keen JH, Benovic JL. Localization of the clathrin binding domain of nonvisual arrestins to the carboxy terminus. J Biol Chem 1997; 272: 15011-6.
- 29. Laporte SA, Oakley RH, Zhang J, et al. The β2-adrenergic receptor/β-arrestin complex recruits the clathrin adaptor AP-2 during endocytosis. Proc Natl Acad Sci USA 1999; 96: 3712-7.
- 30. Laporte SA, Oakley RH, Holt JA, Barak LS, Caron MG. The interaction of β-arrestin with the AP-2 adaptor is required for the clustering of β2-adrenergic receptor into clathrin-coated pits. J Biol Chem 2000; 275: 23120-6.
- 31. Damke H, Baba T, van der Bliek AM, Schmid, SL. Clathrin-independent pinocytosis is induced in cells overexpressing a temperature-sensitive mutant of dynamin. J Cell Biol 1995; 131: 69-80.
- 32. Gaidarov I, Santini F, Warren RA, Keen JH. Spatial control of coated-pit dynamics in living cells. Nat Cell Biol 1999; 1: 1-7.
- 33. Scott MG, Benmerah A, Muntaner O, Marullo S. Recruitment of activated G protein-coupled receptors to pre-existing clathrin-coated pits in living cells. J Biol Chem 2002; 277: 3552-9.
- 34. Santini F, Gaidarov I, Keen JH. G protein-coupled receptor/arrestin 3 modulation of the endocytic machinery. J Cell Biol 2002; 156: 665-76.
- 35. Dessy C, Kelly RA, Balligand JL, Feron O. Dynamin mediates caveolar sequestration of muscarinic cholinergic receptors and alteration in NO signaling. EMBO J 2000; 19: 4272-80.
- 36. Blanpain C, Vanderwinden JM, Cihak J, et al. Multiple active states and oligomerization of CCR5 revealed by the functional properties of monoclonal antibodies. Mol Biol Cell 2002; 13: 723-37.
- 37. Nichols BJ. A distinct class of endosome mediates clathrin-independent endocytosis to the Golgi complex. Nat Cell Biol 2002; 4: 374-8.
- 38. Lin R, Karpa K, Kabbani N, Goldman-Rakic P, Levenson R. Dopamine D2 and D3 receptors are linked to the actin cytoskeleton via interaction with filamin A. Proc Natl Acad Sci USA 2001; 98: 5258-63.
List of figures
Figure 1
Endocytose des récepteurs à sept domaines transmembranaires couplés aux protéines G (RCPG) après une activation de courte durée: mécanisme principal et devenir des récepteurs internalisés.
Lorsque le ligand se lie à un récepteur, ce dernier interagit avec une protéine G trimérique qui se dissocie en sous-unités α-GTP et βγ, capables d’activer des effecteurs cellulaires (E). Très rapidement les RCPG sont phosphorylés par des kinases spécifiques (GRK) et cette phosphorylation a pour effet d’augmenter l’affinité pour la β-arrestine. La liaison de la β-arrestine sur les RCPG favorise leur entrée dans la voie d’endocytose via les puits recouverts de clathrine. En effet, la β-arrestine interagit avec la sous-unité β d’AP-2 et cette protéine adaptatrice établit un pont moléculaire entre le complexe récepteur-β-arrestine et la principale protéine du manteau de la vésicule d’endocytose, la clathrine. Une fois le compartiment endosomique atteint, le devenir des récepteurs internalisés est variable. Le plus souvent, les récepteurs sont déphosphorylés et recyclés vers la membrane plasmique, où ils peuvent à nouveau être stimulés. Du fait de spécificités de structure propres, certains récepteurs ne recyclent pas et sont dirigés vers le compartiment lysosomial pour y être dégradés. Les mécanismes moléculaires qui dirigent les récepteurs vers les lysosomes semblent multiples, incluant une forte affinité pour les β-arrestines, l’ubiquitinylation de la région cytoplasmique, ou l’association avec des protéines de tri.
Figure 2
Les récepteurs couplés aux protéines G (RCPG) activés sont recrutés dans des puits recouverts de clathrine préexistants.
Le recrutement des RCPG activés dans les puits recouverts de clathrine (CCP) peut théoriquement se faire de deux façons. Les RCPG peuvent nucléer leurs propres puits d’endocytose (modèle 1), ou bien ils peuvent s’accumuler dans des puits préexistants impliqués dans l’endocytose constitutive (modèle 2). Afin de tester ces deux possibilités, des cellules ont été transfectées avec de l’ADN codant pour le récepteur de la TRH (thyrotropin releasing hormone), la β-arrestine 2 fusionnée à la GFP (green fluorescent protein) et la protéine Eps15 (constituant constitutif des CCP) fusionnée à une protéine fluorescente rouge, le DsRed (RFP) [33], et étudiées par fluorescence en temps réel. Des expériences préliminaires ont montré que Eps15 marque de façon stable les puits recouverts de l’endocytose constitutive dans lesquels s’accumule le récepteur de la transferrine. Il a également été vérifié que la β-arrestine 2-GFP, cytosolique à l’état basal, est transloquée vers le récepteur activé de la TRH et se co-localise totalement avec lui dans des zones ponctuelles de la membrane plasmique. Si le modèle 1 est correct, l’activation par la TRH va conduire à la formation de nouvelles zones ponctuelles qui vont apparaître colorées en vert (dans le cas où elles ne contiennent que la β-arrestine 2-GFP) ou en jaune (en cas de colocalisation avec RFP-Eps-15) dans une image superposée. Si le modèle 2 est juste, on s’attend à ce que la β-arrestine 2-GFP s’accumule en totalité dans les puits recouverts préexistants, dont la coloration apparente va passer du rouge au jaune après superposition. La partie inférieure de la figure représente 3 photogrammes de la cinétique d’activation par le TRH dans les fenêtres rouge et verte, ainsi que la superposition des images obtenues après 60 secondes. La totalité de la β-arrestine 2-GFP se concentre dans des structures ponctuelles, marquées à l’état basal par RFP-Eps-15, qui apparaissent en jaune dans l’image superposée (trois de ces structures sont indiquées par des flèches blanches). Ce résultat est totalement en accord avec le modèle 2, la β-arrestine étant recrutée dans des CCP préexistants. La possibilité de visualiser dynamiquement le devenir des récepteurs activés par leurs ligands a marqué un tournant dans ce domaine de la recherche [3].