Article body
Le système nerveux des vertébrés est composé du système nerveux périphérique et du système nerveux central comprenant lui-même le cerveau et la moelle épinière (ME). Il assure des fonctions très diverses comme le traitement des informations sensorielles et cognitives ou la genèse des comportements et de la motricité. Toutes ces fonctions nécessitent la différenciation et la mise en place d’un grand nombre de types cellulaires à des positions très spécifiques. Par exemple, le contrôle de la motricité nécessite l’établissement de connexions sélectives entre les neurones sensoriels proprioceptifs, les neurones moteurs (motoneurones, MN) et leurs cibles musculaires. La compréhension des mécanismes qui spécifient l’identité et la mise en place des neurones moteurs est particulièrement importante car elle permettrait d’envisager dans l’avenir de pallier les problèmes survenant au cours du développement ou dans des maladies neurodégénératives. En effet, dans des maladies comme la sclérose amyotrophique latérale, la dégénérescence partielle des neurones moteurs a des conséquences fonctionnelles graves.
Les mécanismes qui interviennent dans le développement des neurones moteurs spinaux des vertébrés commencent à être particulièrement bien décrits. Nous ne reviendrons pas ici sur les mécanismes précoces du développement des neurones moteurs (pour revues, voir [1-3]), mais nous présenterons les mécanismes de spécification des différents sous-types de neurones moteurs spinaux (comment leur diversité est acquise au cours du développement), c’est-à-dire l’ensemble des signaux extrinsèques ou intrinsèques qui permettent à ces cellules d’acquérir leur spécialisation.
Organisation des neurones moteurs dans la moelle épinière
Parmi les MN spinaux, on distingue les MN viscéraux qui innervent les ganglions du système sympathique et les MN somatiques innervant les muscles squelettiques ; seuls ces derniers sont l’objet de cet article. Les MN somatiques se localisent dans la partie ventrale de la moelle épinière (Figure 1B) selon une organisation spatiale très précise qui peut être définie selon trois axes, dorso-ventral, rostro-caudal et médio-latéral (Figure 1A) [2, 4, 5]. Ils sont organisés en deux colonnes longitudinales: la colonne motrice médiane (MMC) et la colonne motrice latérale (LMC), chacune subdivisée en une partie médiane (m) et une partie latérale (l). Les MN de la MMC médiane (MMCm) s’étendent tout le long de l’axe rostro-caudal et innervent les muscles axiaux du dos. Ceux de la MMC latérale (MMCl), situés au niveau thoracique, innervent les muscles de la paroi du corps. La colonne motrice latérale se trouve aux niveaux brachial et lombaire. Les MN de la LMC médiane (LMCm) innervent les muscles ventraux des membres et ceux de la LMC latérale (LMCl) innervent les muscles dorsaux des membres (Figure 1A).
Figure 1
Organisation des MN dans la ME.
A. Les MN sont organisés en colonnes motrices. Les trois axes de positionnement sont indiqués: rostro-caudal (R-C), dorso-ventral (D-V), médio-latéral (M-L). L’ensemble du système nerveux central est représenté: le cerveau qui possède des MN (non schématisés) est en grisé; la ME est subdivisée en cinq régions, cervicale, brachiale, thoracique, lombaire et sacrée. Différentes projections somatotopiques des axones des MN vers la périphérie sont représentées sur la partie gauche, chaque nerf ayant la couleur de la colonne à laquelle il appartient. Le code LIM de chaque colonne est indiqué. B. Schéma d’une coupe transversale au niveau lombaire de la ME de poulet; à ce niveau, il n’y a pas de MMCL. Chaque colonne motrice est composée de plusieurs groupes, chaque groupe innervant un muscle donné. Certains de ces groupes sont reconnaissables par l’expression de facteurs de transcription de la famille Ets; Er81 et Pea3. F: floor plate, N: notochorde.
Peu après leur sortie du cycle cellulaire, les MN post-mitotiques commencent à exprimer les facteurs de transcription à homéodomaine de la famille LIM. Des études menées chez le poulet ont permis d’identifier quatre facteurs Lim (Islet 1, Islet 2, LIM1 et Lhx3) dont l’expression combinatoire, appelée «code Lim», permet d’identifier les différents types de colonnes motrices (Figure 1A) [6, 7].
L’invalidation des gènes Lim a montré l’importance de ces facteurs de transcription dans la spécification de l’identité des MN et le guidage axonal. En effet, Islet-1 est nécessaire à la formation des MN et ceux-ci sont absents lorsque ce gène est muté [8]. En l’absence de Lim1 exprimé dans la LMCl, les MN projettent dans les muscles dorsaux mais aussi ventraux des membres [9]. Lim1 contrôlerait ce guidage axonal en contrôlant l’expression de EphA4, un récepteur des éphrines [10]. De plus, tous les MN spinaux expriment transitoirement les facteurs Lim, Lhx3 et Lhx4, et seuls ceux de la MMCm les expriment plus tardivement. Dans des embryons déficients pour Lhx3 et Lhx4, les MN se développent, mais sont localisés plus dorsalement [11]. Inversement, l’expression ectopique de Lhx3 dans les MN de type LMC les convertit en MN de type MMC [12].
Au sein des colonnes motrices, les MN sont organisés en «groupes», chaque groupe innervant un seul et même muscle. Cette organisation a été clairement identifiée chez le poulet en injectant dans les différents muscles de la peroxydase de raifort qui est transportée de manière rétrograde le long de l’axone jusqu’au corps cellulaire des MN [13]; ce type d’expérience a permis une représentation somatotopique de l’innervation des muscles. Différents groupes de MN peuvent être distingués grâce à l’expression de facteurs de transcription de type Ets : Pea3 et Er81 (Figure 1B) ou forkhead (TWH, thymocyte winged helix) [14, 15].
Spécification des neurones moteurs
Depuis longtemps, les chercheurs ont essayé de comprendre les mécanismes spécifiant ces différents groupes de MN, leur identité et la projection de leurs axones vers la bonne cible. Des signaux internes à la ME sont importants. Les MN de la LMCm quittent le cycle cellulaire avant ceux de la LMCl ; ils expriment l’enzyme RALDH2 permettant la synthèse de l’acide rétinoïque, essentiel aux MN de la LMCl pour coordonner leur position, leur nombre, leur identité et la cinétique de leur différenciation [16]. L’intervention de signaux externes au tube neural a aussi été prouvée, notamment chez le poulet : la greffe de tube neural thoracique en position cervicale (Figure 2A, C), ou de mésoderme paraxial brachial (tissu situé sur les flancs du tube neural) en position thoracique change le devenir des MN (Figure 2B, C) [5], qui ne présentent plus les caractéristiques de MN thoraciques mais celles du phénotype brachial.
Figure 2
Mise en évidence des tissus impliqués dans la spécification des MN.
(A, B) Greffes, effectuées avant la fermeture du tube neural, ayant pour effet la modification de l’identité des colonnes motrices [5]. (A) Diagramme d’une greffe de tube neural du niveau thoracique au niveau brachial ; (B) Diagramme d’une greffe du mésoderme paraxial du niveau brachial au niveau thoracique ; (C) Schémas de coupes transversales de la ME effectuées au niveau des lignes pointillées. C: cervicale, B: brachiale, T: thoracique, n: tube neural, p: mésoderme paraxial. (D à F) Trajets des axones suite à des déplacements du tube neural. (D) Contrôle; (E) Déplacement peu important après la genèse des MN. L’identité des MN n’est pas respécifiée et les axones suivent un trajet légèrement anormal mais vers les bonnes cibles, (F) Déplacement important après la genèse des MN. La plupart des axones suivent le trajet des nerfs existants vers des cibles incorrectes. Cependant, certains MN reçoivent un signal de leurs véritables cibles et leurs axones suivent alors un trajet anormal vers elles [13].
La croissance axonale des MN vers la cible appropriée dépend de l’expression de molécules leur permettant de répondre spécifiquement à des signaux de guidage extrinsèques. Des MN déplacés le long de l’axe antéropostérieur par rotation d’une partie du tube neural, sont capables de modifier leur trajectoire pour envoyer leurs axones vers leurs cibles, quitte à pénétrer dans le membre en position anormale (Figure 2D-F) [13]. De façon similaire la rotation des bourgeons des membres montre que les cônes de croissance des MN répondent à des signaux de guidage. Quand les MN sont déplacés sur des distances relativement grandes, leurs axones vont le plus souvent se diriger vers leurs cibles appropriées. Il existe donc des signaux produits par les membres auxquels les MN peuvent répondre différemment. Ces signaux sont soit attractifs soit répulsifs.
Va-et-vient entre la périphérie et le tube neural
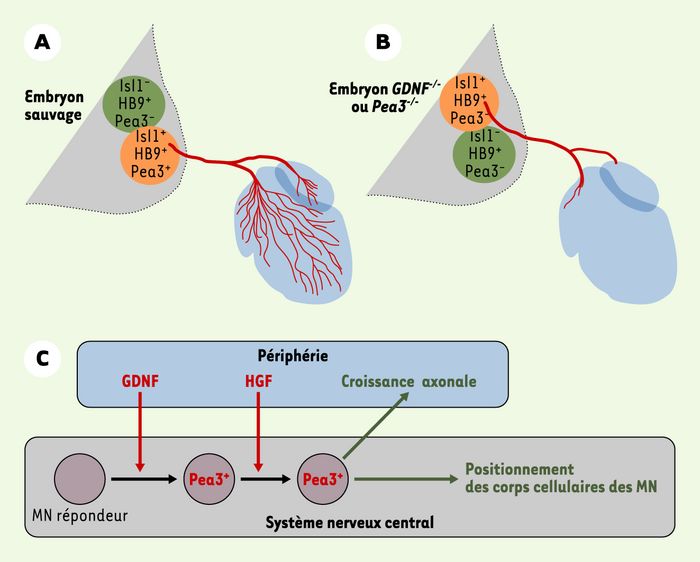
La périphérie n’a pas seulement un rôle attractif ou répulsif, elle est aussi capable d’influencer plusieurs aspects du développement des MN. En effet, l’ablation d’une patte entraîne la perte d’expression de certains facteurs de transcription de la famille Ets par les MN. L’induction de l’expression des gènes correspondants coïncide avec l’arrivée des axones à la base des membres, et, en l’absence de Pea3, les MN qui expriment normalement ce facteur n’innervent pas correctement leur cible, et leurs corps cellulaires n’atteignent pas leurs positions caractéristiques dans la LMC. Pea3 contrôle donc l’arborisation terminale et le positionnement final des corps cellulaires des MN [17-19]. Ces expériences ont permis de montrer que la périphérie délivre un signal qui est nécessaire à la spécification des MN et à l’expression des gènes Ets(Figure 2) [13, 15]. Il restait à déterminer comment la périphérie pouvait contrôler l’expression de facteurs de transcription dans les MN. Le GDNF (glial derived neurotrophic factor) joue un rôle déterminant: l’expression de GDNF est restreinte à certains muscles spécifiques et dans un mutant nul pour GDNF, l’expression de Pea3 est absente dans la plupart des MN [20]. Ceci conduit à un mauvais positionnement des groupes de MN et à une mauvaise innervation de leurs muscles cibles (Figure 3A, B). En fait, le recrutement des MN exprimant Pea3 se fait de manière séquentielle. Dans un premier temps, le GDNF induit l’expression de Pea3 dans les MN en position caudale. Puis ces MN, sous l’influence du HGF (hepatocyte growth factor), induisent l’expression de Pea3 dans les MN situés en position rostrale [21]. GDNF et HGF sont donc des facteurs sécrétés en périphérie qui contrôlent, dans certains MN, l’expression de Pea3 qui, à son tour, contrôle l’expression des gènes responsables de la position des corps cellulaires ainsi que du trajet des axones (Figure 3C).
Figure 3
Intervention du GDNF et de l’HGF dans la différenciation des motoneurones (MN).
Le GDNF puis le HGF, synthétisés à la périphérie, contrôlent la différenciation d’une sous population de MN en contrôlant l’expression de Pea3. Schémas montrant le positionnement des corps cellulaires des MN ainsi que leur croissance axonale à 12,5 du développement embryonnaire dans un embryon sauvage (A) et dans un embryon mutant pour GDNF ou Pea3 (B). L’absence du signal GDNF ou Pea3 entraîne le mauvais positionnement des MN qui auraient exprimé PEA3 ainsi qu’une arborisation axonale déficiente. Pour plus de clarté, seuls les MN impliqués ont été schématisés. (C) Schéma résumant le rôle de GDNF et de HGF dans la différenciation des groupes de MN via l’expression de PEA3 [17, 20, 21].
À chaque étape de développement des signaux extrinsèques et intrinsèques interviennent dans la spécification des MN [7, 22]. Les facteurs extrinsèques activent une cascade de facteurs de transcription qui conduit à la spécification des MN. Une bonne connaissance de ces voies de différenciation est nécessaire avant d’envisager l’utilisation de cellules souches dans le traitement des maladies neurodégénératives. Une première étape a été franchie récemment : des cellules souches embryonnaires de souris ont été soumises à un protocole induisant leur différenciation en MN ayant une identité cervicale et appartenant à la MMC [23]. Ces MN, implantés dans des tubes neuraux de poulet, sont capables de coloniser la moelle épinière embryonnaire en tant que MN, d’étendre leurs axones et de former des synapses présentant toutes les caractéristiques de synapses neuromusculaires fonctionnelles. Bien qu’encourageants, ces résultats ne sont qu’un tout premier pas vers des thérapies cellulaires utilisant des cellules souches différenciées en MN car il reste à maîtriser tous les signaux qui permettront d’obtenir un type bien précis de MN.
Appendices
Remerciements
Les auteurs remercient l’ensemble des membres de l’Unité 382. Les travaux de notre laboratoire ont été soutenus par l’AFM.
Références
- 1. Briscoe J, Ericson J. Specification of neuronal fates in the ventral neural tube.Curr Opin Neurobiol 2001 ; 11 : 43-9.
- 2. Jessell TM. Neuronal specification in the spinal cord: inductive signals and transcriptional codes. Nat Rev Genet 2000 ; 1 : 20-9.
- 3. Pfaff S, Kintner C. Neuronal diversification: development of motor neuron subtypes.Curr Opin Neurobiol 1998; 8 : 27-36.
- 4. Eisen JS. Patterning motoneurons in the vertebrate nervous system. Trends Neurosci 1999 ; 22 : 321-6.
- 5. Ensini M, Tsuchida T, Belting HG. Jessell TM. The control of rostrocaudal pattern in the developing spinal cord: specification of motor neuron subtype identity is initiated by signals from paraxial mesoderm.Development 1998 ; 125 : 969-82.
- 6. Sockanathan S. Towards cracking the code: LIM protein complexes in the spinal cord. Trends Neurosci 2003 ; 26 : 57-9.
- 7. Shirasaki R, Pfaff SL.Transcriptional codes and the control of neuronal identity. Annu Rev Neurosci 2002 ; 25 : 251-81.
- 8. Pfaff SL, Mendelsohn M, Stewart CL, Edlund T, Jessell TM. Requirement for LIM homeobox gene Isl1 in motor neuron generation reveals a motor neuron-dependent step in interneuron differentiation.Cell 1996 ; 84 : 309-20.
- 9. Kania A, Johnson RL, Jessell TM. Coordinate roles for LIM homeobox genes in directing the dorsoventral trajectory of motor axons in the vertebrate limb.Cell 2000 ; 102 : 161-73.
- 10. Kania A, Jessell TM. Topographic motor projections in the limb imposed by LIM homeodomain protein regulation of ephrin-A:EphA interactions.Neuron 2003 ; 38 : 581-96.
- 11. Sharma K, Sheng HZ, Lettieri K, Li H, Karavanov A, Potter S, Westphal H, Pfaff SL. LIM homeodomain factors Lhx3 and Lhx4 assign subtype identities for motor neurons. Cell 1998; 95 : 817-28.
- 12. Sharma K, Leonard AE, Lettieri K, Pfaff SL. Genetic and epigenetic mechanisms contribute to motor neuron pathfinding.Nature 2000 ; 406 : 515-9.
- 13. Landmesser LT. The acquisition of motoneuron subtype identity and motor circuit formation.Int J Dev Neurosci 2001; 19: 175-82.
- 14. Dou C, Ye X, Stewart C, Lai E, Li SC. TWH regulates the development of subsets of spinal cord neurons. Neuron 1997; 18: 539-51.
- 15. Lin JH, Saito T, Anderson DJ, Lance-Jones C, Jessell TM, Arber S. Functionally related motor neuron pool and muscle sensory afferent subtypes defined by coordinate ETS gene expression.Cell 1998; 95: 393-407.
- 16. Sockanathan S, Jessell TM. Motor neuron-derived retinoid signaling specifies the subtype identity of spinal motor neurons.Cell 1998; 94: 503-14.
- 17. Livet J, Sigrist M, Stroebel S. ETS gene Pea3 controls the central position and terminal arborization of specific motor neuron pools. Neuron 2002; 35: 877-92.
- 18. Koo SJ, Pfaff SL. Fine-tuning motor neuron properties: signaling from the periphery. Neuron 2002; 35 : 823-6.
- 19. Ladle DR, Frank E. The role of the ETS gene PEA3 in the development of motor and sensory neurons.Physiol Behav 2002; 77: 571-6.
- 20. Haase G, Dessaud E, Garces A, et al. GDNF acts through PEA3 to regulate cell body positioning and muscle innervation of specific motor neuron pools.Neuron 2002; 35: 893-905.
- 21. Helmbacher F, Dessaud E, Arber S, deLapeyriere O, Henderson CE, Klein R, Maina F. Met signaling is required for recruitment of motor neurons to PEA3-positive motor pools.Neuron 2003; 39: 767-77.
- 22. Jurata LW, Thomas JB, Pfaff SL. Transcriptional mechanisms in the development of motor control.Curr Opin Neurobiol 2000; 10: 72-9.
- 23. Wichterle H, Lieberam I, Porter JA, Jessell TM. Directed differentiation of embryonic stem cells into motor neurons. Cell 2002 ; 110 : 385-97.
List of figures
Figure 1
Organisation des MN dans la ME.
A. Les MN sont organisés en colonnes motrices. Les trois axes de positionnement sont indiqués: rostro-caudal (R-C), dorso-ventral (D-V), médio-latéral (M-L). L’ensemble du système nerveux central est représenté: le cerveau qui possède des MN (non schématisés) est en grisé; la ME est subdivisée en cinq régions, cervicale, brachiale, thoracique, lombaire et sacrée. Différentes projections somatotopiques des axones des MN vers la périphérie sont représentées sur la partie gauche, chaque nerf ayant la couleur de la colonne à laquelle il appartient. Le code LIM de chaque colonne est indiqué. B. Schéma d’une coupe transversale au niveau lombaire de la ME de poulet; à ce niveau, il n’y a pas de MMCL. Chaque colonne motrice est composée de plusieurs groupes, chaque groupe innervant un muscle donné. Certains de ces groupes sont reconnaissables par l’expression de facteurs de transcription de la famille Ets; Er81 et Pea3. F: floor plate, N: notochorde.
Figure 2
Mise en évidence des tissus impliqués dans la spécification des MN.
(A, B) Greffes, effectuées avant la fermeture du tube neural, ayant pour effet la modification de l’identité des colonnes motrices [5]. (A) Diagramme d’une greffe de tube neural du niveau thoracique au niveau brachial ; (B) Diagramme d’une greffe du mésoderme paraxial du niveau brachial au niveau thoracique ; (C) Schémas de coupes transversales de la ME effectuées au niveau des lignes pointillées. C: cervicale, B: brachiale, T: thoracique, n: tube neural, p: mésoderme paraxial. (D à F) Trajets des axones suite à des déplacements du tube neural. (D) Contrôle; (E) Déplacement peu important après la genèse des MN. L’identité des MN n’est pas respécifiée et les axones suivent un trajet légèrement anormal mais vers les bonnes cibles, (F) Déplacement important après la genèse des MN. La plupart des axones suivent le trajet des nerfs existants vers des cibles incorrectes. Cependant, certains MN reçoivent un signal de leurs véritables cibles et leurs axones suivent alors un trajet anormal vers elles [13].
Figure 3
Intervention du GDNF et de l’HGF dans la différenciation des motoneurones (MN).
Le GDNF puis le HGF, synthétisés à la périphérie, contrôlent la différenciation d’une sous population de MN en contrôlant l’expression de Pea3. Schémas montrant le positionnement des corps cellulaires des MN ainsi que leur croissance axonale à 12,5 du développement embryonnaire dans un embryon sauvage (A) et dans un embryon mutant pour GDNF ou Pea3 (B). L’absence du signal GDNF ou Pea3 entraîne le mauvais positionnement des MN qui auraient exprimé PEA3 ainsi qu’une arborisation axonale déficiente. Pour plus de clarté, seuls les MN impliqués ont été schématisés. (C) Schéma résumant le rôle de GDNF et de HGF dans la différenciation des groupes de MN via l’expression de PEA3 [17, 20, 21].