Abstracts
Résumé
Le traitement à la pression atmosphérique de solutions aqueuses d’urée et de thiourée par plasma d’arc rampant en atmosphère d’air humide conduit à la dégradation totale de ces composés. Les cinétiques globales d’ordre nul ont des constantes voisines proches de 3•10‑6 s‑1. Le procédé met en jeu les espèces actives créées dans la décharge, les radicaux OH et NO, responsables des caractères chimiques principaux du plasma : oxydation du fait de la présence de OH (E°OH H2O = 2,85 V/ENH) et acidification, provenant de la formation d’acides nitreux et nitrique en solution. Ces résultats sont relatifs à des molécules modèles, mais suggèrent l’extension du procédé à la dégradation de molécules toxiques et d’effluents industriels soufrés.
Mots clés:
- Dépollution,
- thiourée,
- urée,
- solutions aqueuses,
- dégradation oxydante,
- décharge électrique,
- plasma nonthermique,
- pression atmosphérique
Abstract
Electric discharges in humid air (i.e., a gliding arc discharge at atmospheric pressure and quasi-ambient temperature) are considered in the context of evaluating new techniques for pollution abatement. An electric discharge in a gas under specific conditions gives rise to a plasma, which involves activated gas species with enhanced reactivity. The main chemical properties of a discharge in humid air are attributed to NO and OH radicals formed in the discharge, which are able to react with solutes at the plasma/liquid interface. These activated species are formed in advanced oxidation processes and are respectively responsible for acid and oxidizing effects in the target solution: NO gives rise to nitrous and nitric acids, and OH is strongly oxidising [E°(OH/H2O) = 2.85 V/NHE].
To examine the degradation power of the plasma treatment on molecules of the same family and to evaluate the ability of the gliding arc system to oxidize sulphur-containing solutes (2 x 10‑3 M) in batch conditions, aqueous urea and thiourea were selected as suitable target solutions. The solutes were completely degraded within 180‑200 minutes of treatment and the concentrations decreased linearly with increasing exposure times in the discharge. This trend accounts for overall zero-order kinetic schemes with the relevant rate constants of kurea = 5.28 x 10‑6 s‑1 and kthiourea = 2.03 x 10‑6 s‑1.
The evolution of solutes with time was followed by total organic carbon (TOC) measurements for urea, and by the conductometric titration of the sulphate ions formed in the case of thiourea. Spectrophotometric measurements of the treated solutions at the solute absorption peaks were found to be unsuitable for analysis purposes due to the formation of nitrite/nitrate ions which absorb in the same wavelength range.
The extension of a gliding arc system from the laboratory level to an industrial scale for pollution abatement of industrial effluents is considered.
Keywords:
- Non thermal plasma,
- oxidation,
- gliding arc discharge,
- humid air plasma,
- thiourea,
- urea,
- pollution abatement
Article body
1. Introduction
1.1 Cadre de l’étude et objectifs
Le développement actuel des Procédés d’Oxydation Avancée (PAO) est justifié par la multiplication des problèmes endémiques posés par l’élimination des déchets. Parmi les technologies émergentes, l’emploi de décharges électriques présente un intérêt particulier, du fait de la souplesse d’emploi et de l’efficacité (HNATIUC et al., 2002) des plasmas gazeux ainsi créés, ce qu’attestent de multiples exemples d’application. L’utilisation de décharges électriques en dépollution est effectivement prometteuse, car elle permet d’éliminer des composés organiques résiduels provenant de processus industriels. Il est ainsi possible, entre autres applications et en opérant à la pression atmosphérique, de dégrader totalement des solvants d’extraction usés tels que le tributylphosphate ou des hydrocarbures aliphatiques (MOUSSA et BRISSET, 2003) - qu’ils soient ou non chlorés (FANMOE et al., 2003). Une autre application réside dans la diminution notable (ABDELMALEK et al., 2004; BURLICA et al., 2004) de la teneur en solutés organiques polluants d’effluents industriels (des colorants de l’industrie textile par exemple). Les exemples de molécules cibles dégradées par décharge électrique sont nombreux et concernent des composés à structure aliphatique ou aromatique.
Pour l’étude exploratoire présentée ici, nous avons considéré une nouvelle famille de composés, celle des composés soufrés, qui n’a été abordée jusqu’ici qu’en phase gazeuse par CZERNICHOWSKI (1992) et par BRETHES-DUPOUEY et al. (2000) : nous avons sélectionné la thiourée dont nous avons comparé les résultats de dégradation plasmachimique à ceux de l’urée. Les deux molécules modèles retenues sont de simples précurseurs de composés soufrés et oxygénés à longues chaînes (mercaptans, alcools, aldéhydes, cétones, etc.) souvent rencontrés dans le cadre de la dépollution des eaux.
L’urée constitue le produit le plus intéressant et le plus important des dérivés de l’acide carbamique (NH2COOH). Elle est utilisée en grandes quantités comme engrais, comme stabilisateur de la nitrocellulose, comme intermédiaire de chimie fine et comme intermédiaire de polymérisation. La thiourée intervient avec les amines grasses et les mercaptans comme inhibiteurs de corrosion (HABER et WEISS, 1934). Ces composés sont donc présents dans de nombreux effluents industriels et leur destruction constitue de ce fait un enjeu de taille qui interpelle toute l’industrie chimique.
1.2 L’outil plasma
Un plasma est un milieu gazeux électriquement neutre comportant des espèces « légères » (i.e., photons et électrons) et des espèces « lourdes » (molécules, radicaux, atomes, toutes espèces éventuellement ionisées et électroniquement activées). Il résulte d’un transfert énergétique entre une source et un gaz, celle-ci étant souvent constituée par une décharge électrique. Le transfert énergétique au gaz entraîne la formation de nouvelles espèces et leur élévation à un état énergétique excité. La modification de la répartition électronique engendre une réactivité nouvelle et accrue des espèces, qui rend le plasma collectivement plus réactif que le gaz d’origine.
Lorsque les électrons et les espèces lourdes ont une énergie voisine, le plasma est en équilibre thermique : c’est le cas d’un arc ou d’une torche à plasma, opérant à haute pression, et dont la température s’élève à plusieurs milliers de degrés Celsius. Le plasma est alors dit « thermique ».
À basse pression, l’énergie des électrons est largement supérieure à celle des espèces lourdes. L’équilibre thermodynamique n’est pas réalisé pour ces plasmas « non thermiques ».
Toutefois, à la pression atmosphérique, l’équilibre thermodynamique n’est pas toujours rigoureusement réalisé. De plus, certains dispositifs, tels que l’arc glissant (ou « glidarc ») que nous utilisons, permettent d’obtenir à la pression atmosphérique un plasma dit « trempé », mais dont la température macroscopique reste proche de l’ambiante, et qui est ainsi apte à traiter des milieux liquides aqueux ou hydro-organiques.
Les propriétés chimiques des entités lourdes créées dans de tels plasmas trempés dépendent de la nature du gaz plasmagène. Les décharges dans l’air humide comportent les radicaux OH et NO comme espèces réactives principales qui ont été identifiées et quantifiées (BENSTAALI et al., 2002; KOSSITSYN et al., 2003). Ces entités réagissent à la surface de la phase aqueuse et sont les principaux responsables (JANCA et MAXIMOV 1997; JANCA et al.,1999; BENSTAALI et al., 1998, 2002; DOUBLA et al., 2003; DELAIR, 2004) des propriétés fortement oxydantes (E°OH/H2O = 2,85 V/ENH) et acidifiantes. Ainsi, NO est un précurseur des acides nitreux et nitrique générés dans une solution aqueuse exposée à la décharge. L’apparition d’espèces stables NO3‑ en solution participe d’ailleurs au pouvoir oxydant du plasma du fait du pouvoir oxydant élevé du système NO3‑/HNO2 (potentiel normal : 0,94V).
La formation de H2O2 en solution a aussi été établie et résulte probablement de l’association de radicaux OH. Le peroxyde d’hydrogène ainsi introduit en solution intervient généralement dans des réactions lentes, nettement différenciées de l’exposition au plasma, comme par exemple lors des réactions de post-décharge (DOUBLA et al., 2003).
Les effets plasmachimiques ont été mis à profit en dépollution et en bio-décontamination (HNATIUC, 2002; MOREAU et al., 2005) et la présence déterminante de radicaux OH permet de ranger les décharges électriques dans l’air humide parmi les PAO.
2. Matériels et méthodes
2.1 Le réacteur plasma d’arc glissant (« glidarc »)
Le dispositif utilisé pour le traitement des gaz est décrit par LESUEUR et al. (1988) et une première modélisation a été proposée par FRIDMAN et al. (1994). Nous l’avons repris et adapté (Figure 1) à celui de liquides (MOUSSA et al., 1998) et de solutions aqueuses. Il comporte deux conducteurs divergents reliés à un transformateur à fuite Aupem-Sefli (50 Hz, 9 kV‑100 mA à vide; intensité moyenne en fonctionnement 160 mA) disposés symétriquement par rapport à un flux gazeux axial.
Un arc électrique, formé au minimum d’écartement des conducteurs portés à la haute tension, est poussé par le flux gazeux et « glisse » le long des électrodes jusqu’à éclater en panache et être remplacé par un nouvel arc qui le court-circuite. Une cible peut être disposée en regard du panache, de façon à assurer le contact plasma/cible et permettre aux réactions de se produire.
Figure 1
Schéma du réacteur à arc glissant alimenté en haute tension (HT).
Sketch of a gliding arc reactor fed with a HV transformer (HT).
Le gaz plasmagène utilisé dans l’étude est l’air (débit : 15 L•min‑1; diamètre de la buse : 1 mm) préalablement saturé en eau par passage dans un saturateur afin de favoriser la formation des radicaux actifs OH et de minimiser celle d’ozone.
La solution traitée est agitée à l’aide d’un agitateur magnétique pour assurer l’homogénéité de la cible. La réaction entre les espèces incidentes du plasma et la solution cible ayant lieu à l’interface liquide/gaz, une agitation efficace empêche l’accumulation des produits de réaction à la surface liquide et accroît ainsi la vitesse de réaction.
Enfin, le réacteur est muni d’une jaquette pour la circulation d’eau qui maintient la température de la cible au dessous de 40 °C pendant le traitement. Un réfrigérant est également fixé au couvercle du réacteur afin de condenser les vapeurs organiques entraînées par le flux d’air incident et de s’affranchir de tout risque d’atteindre le point flash lors du traitement de solvants organiques usés.
Dans cette étude, les solutions exposées au plasma sont des solutions aqueuses d’urée et de thiourée préparées à partir de produits commerciaux. Les solutés sont 5•10‑3 M dans l’eau permutée. Le volume exposé à la décharge est d’environ 200 mL.
2.2 Les méthodes d’analyse
La dégradation de l’urée a été suivie par mesures de carbone organique total sur COT‑mètre Shimadsu TOC‑VE après calibrage.
Par ailleurs, des mesures spectrophotométriques de l’absorbance dans le domaine UV‑visible (λ = 240 nm) ont permis de suivre l’apparition de nitrites.
La dégradation oxydante de la thiourée produit des ions sulfate.
Comme la formation de produits soufrés risque de perturber fortement le bon fonctionnement du COT‑mètre, il a été préféré de suivre la décomposition de la thiourée par titrage conductimétrique des sulfates par les ions baryum (conductimètre Tacussel CDRV 62). En complément, un suivi par mesures de spectrophotométrie d’absorption en UV‑visible a également été réalisé au pic d’absorption du composé (λ = 260 nm).
3. Résultats et discussion
3.1 Traitement de l’urée
3.1.1 Mesures spectrophotométriques
Les solutions d’urée absorbent dans l’UV lointain, à une longueur d’onde inférieure à 200 nm, dans un domaine largement occupé par la bande de l’oxygène. L’analyse spectrophotométrique dans le domaine UV de solutions d’urée ne pourra donc pas apporter de renseignements exploitables sur la disparition du soluté.
Néanmoins, des solutions 0,005 M d’urée ont été exposées au plasma pendant des durées diverses puis analysées par spectrophotométrie d’absorption UV‑visible à λ = 240 nm, à une longueur d’onde à laquelle les ions nitrite absorbent. La courbe A240 = f(t*), représentée sur la figure 2, montre que les valeurs d’absorbance mesurées augmentent en fonction de la durée de traitement t* et tendent vers 0,73 après 60 min de traitement. Une telle évolution ne peut être attribuée à l’urée, mais elle résulte de la formation d’un soluté nouveau au cours de la décharge, qui est identifié comme étant l’ion nitrite. Les espèces NO créées dans la décharge donnent en effet naissance à des ions nitrite selon un processus global à préciser, et, corrélativement, les ions nitrite disparaissent au profit d’ions nitrate, ce qui explique la présence d’un plateau de concentration d’ions nitrite résultant de deux réactions successives (ABDELMALEK 2003) :
Figure 2
Évolution de l’absorbance à 240 nm d’une solution d’urée (5 x 10‑3 M) en fonction de la durée de traitement. La courbe expérimentale (EX) indicatrice de la teneur en nitrites diffère sensiblement de la courbe théorique (TH) du fait de leur disparition au profit de nitrates.
Absorbance changes of an aqueous 5 x 10‑3 M urea solution at 240 nm vs. exposure time t* (min) to plasma due to the formation of nitrites. The experimental (EX) and theoretical (TH) exponential plots differ slightly because of the further transformation of nitrite to nitrate.
La courbe expérimentale de la figure 2 rend compte de l’apparition des nitrites. Son allure est globalement exponentielle et elle obéit approximativement à la relation A(t) = A∞(1-e‑kt) caractéristique d’une cinétique de premier ordre, l’écart provenant de la transformation des nitrites en nitrates.
La méthode spectrophotométrique se révèle inadaptée au suivi de la concentration de l’urée en solution après traitement par plasma. Toutefois, l’étude établit la présence de nitrites en concentration quasi stationnaire en solution, après une douzaine de minutes de traitement.
L’analyse de la demande chimique en oxygène (DCO) de la solution traitée d’urée s’est avérée aussi inopérante. Avec ce type de mesure, les nitrites, qui sont oxydables en nitrates, interfèrent et perturbent les valeurs obtenues de DCO.
3.1.2 Mesure du carbone organique total
Les mesures spectrophotométriques et de DCO suggèrent une conclusion négative, à savoir que la dégradation de l’urée ne s’effectue pas sous l’effet de la décharge. Un tel résultat doit être confirmé ou infirmé et, pour lever l’ambiguïté, nous avons procédé à des mesures du carbone organique total (COT).
Après calibrage du COT‑mètre avec des solutions étalon d’urée, les mesures de carbone sont effectuées sur des solutions traitées par le plasma pendant des temps variables mais contrôlés. La courbe résultante (Figure 3) montre que la teneur en carbone décroît linéairement en fonction de la durée de traitement. Ce résultat établit que l’urée est bien dégradée. De plus, la disparition quasi totale du soluté nécessite 180 min, ce qui signifie que la cinétique est lente. En début de traitement, c’est-à-dire pour les fortes valeurs de COT, la cinétique est limitée par le flux des espèces gazeuses incidentes : elle est alors d’ordre global zéro en soluté avec une constante k = 0,3174 mg•L‑1•min‑1 (soit exprimée en moles 5,28•10‑6 s‑1). Pour de longues durées de traitement (t*≥ 180 min), une évolution vers une cinétique d’ordre global 1 se dessine.
L’étude cinétique a été menée sur trois essais indépendants qui conduisent aux même résultats, ce qui établit en outre la reproductibilité du traitement.
Le rendement de la réaction, effectuée en bâchée (réacteur « batch »), est assez satisfaisant puisqu’il atteint 90,9 % avec les paramètres de fonctionnement du réacteur qui ont été fixés. L’efficacité du traitement pourrait probablement être améliorée en utilisant un système de circulation de la solution à traiter, mais une telle étude n’entre pas dans notre propos qui est focalisé sur la seule faisabilité.
En résumé, l’action de la décharge électrique sur l’air humide génère un plasma comportant OH et NO principalement, qui donnent, en phase aqueuse : OH, H2O2 et in fine NO3‑ + H+ via HNO2. Les espèces aqueuses OH, H2O2 et NO3‑ sont susceptibles de faciliter la décarboxylation de l’urée en CO2, NH4+ et H2O :
Figure 3
Évolution de la teneur en carbone de la solution d’urée en fonction de la durée de traitement t* (min). Pour t* < 90 min : Y = -0,38x + 60,94; R2 = 0,996. Pour t* < 200 min : Y = ‑0,3174x + 58,497; R2 = 0,9858.
Kinetics of the degradation of urea followed by TOC measurements vs. treatment time t* (min). For t* < 90 min: Y = -0.38x + 60.94; R2 = 0.996. For t* < 200 min: Y = ‑0.3174x + 58.497; R2 = 0.9858.
Les protons apparus en solution participent comme catalyseurs à la réaction d’hydrolyse classique des amides dont le bilan est :
En outre, les agents indispensables à une réaction de diazotation de l’urée sont réunis et constituent une voie parallèle et connue de destruction, avec formation d’azote et de CO2 :
Au total, et quel que soit le mode d’oxydation observé, puisque la diazotation est aussi un processus d’oxydation, il se forme du dioxyde de carbone et des ions ammonium ou CO2 et N2.
L’expérience montre l’apparition d’un dégagement gazeux comportant effectivement du dioxyde de carbone identifié à l’aide de tubes dosimètres Dräger. Par ailleurs, la formation d’ions ammonium est attestée par un test positif au réactif de Nessler. Ces résultats valident les diverses hypothèses avancées et il est donc probable que les réactions d’oxydation et d’hydrolyse des amides aient effectivement lieu.
Par ailleurs, nous avons comparé le spectre des solutions d’urée de même concentration soit après addition d’acide nitreux (un milieu nitrite acidifié) de façon à faciliter la diazotation, soit après exposition au plasma. Dans ce dernier cas, un signal faible apparaît à 480 nm, à la même longueur d’onde que le signal résultant de la formation normale du dérivé diazoté. Il est ainsi possible de conclure que la réaction de diazotation concourt, mais modestement, au processus de dégradation de l’urée.
3.2 Traitement de la thiourée
Le traitement par plasma de la thiourée, dans des conditions similaires à celles qui ont prévalu pour l’urée, présente un double intérêt, qui a d’ailleurs guidé notre démarche. D’une part, la molécule est très proche de l’urée, et l’on peut donc imaginer des similitudes profondes dans le comportement des solutés sous décharge électrique. D’autre part, nous abordons la dégradation de produits soufrés qui n’a, à notre connaissance, été traitée par arc rampant que dans le cas de H2S ou de mercaptans volatils (BRETHES-DUPOUEY et al., 2000; CZERNICHOWSKI, 1992; CZERNICHOWSKI et al., 2003).
3.2.1 Étude spectrophotométrique
Le protocole de l’étude spectrale de l’urée a été intégralement repris pour la thiourée. L’analyse spectrophotométrique de la solution à 0,005 M de thiourée exposée au plasma se traduit par l’apparition d’un pic d’absorbance à 260 nm après 10 min de traitement et une stabilisation de l’absorbance pour des expositions supérieures à 30 min qui n’évolue pas en l’absence de décharge (Figure 4).
Ces résultats expérimentaux peuvent être interprétés de la même façon que la dégradation de l’urée, par la compétition entre la formation de nitrites absorbant autour de 260 nm qui est prépondérante pour t* < 10 min, d’une part, et, d’autre part, la dégradation de l’urée concurrente de la transformation des nitrites en nitrates entraînant leur disparition partielle. L’absorbance de la solution à 260 nm est la somme des composantes dues aux nitrites et à la thiourée :
compte tenu du fait que l’absorbance des nitrites résulte de la différence de leurs vitesses de formation et de disparition en nitrates. Des études complémentaires ont établi que la concentration globale en nitrite croissait vers un plateau à la façon d’un processus autocatalytique en fonction de la durée t* d’exposition à la décharge. Très schématiquement, la concentration en nitrites est assimilable à un segment linéaire de pente positive suivi d’un plateau de pente quasi-nulle. Si l’on admet, en toute première approximation, une variation linéaire de la concentration en thiourée en fonction de t*, celle-ci sera rendue par une droite de pente négative. La somme des concentrations des espèces participant à l’absorption (et par suite l’absorbance) présente alors un maximum d’autant plus prononcé que la vitesse de formation des nitrites est plus élevée que celle de disparition de la thiourée. Pour de longues durées d’exposition, l’absorbance est limitée par la concentration en nitrites, la concentration en thiourée étant alors négligeable ou nulle (Figure 5).
Figure 4
Évolution de l’absorbance à 260 nm d’une solution de thiourée exposée au « glidarc ».
Changes in the absorbance at 260 nm of thiourea solutions exposed to the gliding arc.
L’illustration fournie par la figure 5 justifie la présence d’un maximum d’absorbance de la solution. Elle établit aussi que la méthode spectrophotométrique, pourtant sensible et précise, ne peut s’appliquer dans ce cas, ce qui conduit à mettre en jeu d’autres techniques parmi celles qui sont disponibles au laboratoire .
3.2.2 Étude conductimétrique
Établir de façon indiscutable que la dégradation de la thiourée implique le recours à une technique d’analyse indépendante et différente de la spectrophotométrie.
La mise en oeuvre de mesures de COT comme pour l’étude de l’urée doit cependant être écartée, du fait de la présence de soufre, qui agit comme poison du catalyseur du COT‑mètre.
L’application du test au Ba(NO3)2 sur la solution traitée par plasma a montré la formation d’un précipité blanc résistant à l’action de l’acide nitrique dilué ou concentré. Ce résultat indique qu’il s’est formé du BaSO4, et établit donc l’existence d’ions sulfates.
Nous avons donc opéré par titrage conductimétrique des sulfates formés par le chlorure de baryum. La rupture de pente de la conductance en fonction du volume délivré indique le point équivalent en sulfate, c’est‑à‑dire la teneur en thiourée dégradée.
Figure 5
Tentative de modélisation des courbes d’absorbance (ou de concentration) de solutions de thiourée traitées par plasma selon la formation de nitrites (traits noirs) : Composante thiourée (tu) : … + … Composante nitrites : a (trait continu); (b) tireté; (c) pointillé. Courbes somme (en gris) : (tu) + (a) continu; (tu) + (b) tireté gras; (tu) + (c) tireté. Les grandeurs en abscisse et ordonnée sont arbitraires.
A rough attempt to model the absorption (or concentration) plots of plasma treated thiourea (tu) solutions for various formation rates of nitrite (black plots): (a) line; (b) dashes; (c) dotted. Absorbance of (tu): ….+…. Resulting absorbance of (tu) + (nitrite) solutions in grey plots: (tu) +(a) line; (tu) + (b) dashed bold; (tu) + (c) dashed. Abscissa are in arbitrary units.
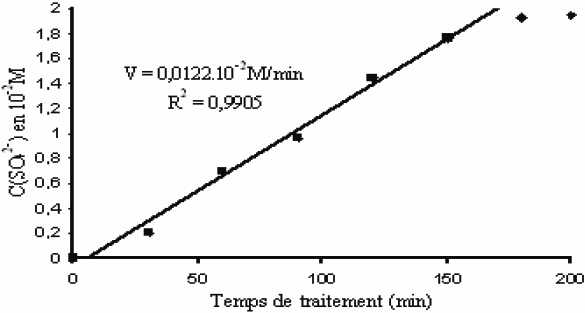
La courbe cinétique résultante est présentée sur la figure 6 pour une solution de thiourée. Elle indique une variation linéaire dans le temps de la concentration en sulfate formé, donc de la concentration en thiourée non dégradée restant en solution. La cinétique associée est donc d’ordre global zéro en thiourée pour t* < 150 min. La réaction est achevée en moins de 180 min dans les conditions opératoires retenues (200 mL de solution traitée de thiourée à 2•10‑2 M) et la constante k vaut 2,03•10‑6 s‑1. En fin de réaction, la surface de solution cible est appauvrie en molécules de thiourée et la courbe C(SO42-) = f(t*) s’écarte d’un comportement linéaire pour tendre vers une allure exponentielle associée à une cinétique d’ordre global 1.
4. Conclusion
Les résultats présentés indiquent que l’exposition à une décharge électrique d’arc rampant, qui induit la formation d’un plasma non thermique trempé, est capable de dégrader totalement des molécules de la famille de l’urée : urée et thiourée. Le traitement « batch » utilisé montre que la dégradation totale de 200 mL de solutions (2•10‑3 M) est obtenue pour 180‑200 min d’exposition.
Les cinétiques globales observées sont, dans les deux cas, d’ordre global zéro en début de traitement, et les constantes sont relativement voisines (kurée = 5,3•10‑6 s‑1; kthiourée = 2,03•10‑6 s‑1) comme il était prévisible du fait de la grande similitude des molécules traitées. Le mécanisme réactionnel global implique probablement l’hydrolyse de l’amide. Celle‑ci est catalysée par la présence d’acides, qui sont d’ailleurs formés in situ par la décharge. D’autres mécanismes sont aussi concevables, y compris la diazotation dans le cas de l’urée.
Figure 6
Teneur en sulfate formé à partir de thiourée par exposition au plasma.
Amount of sulphate formed by exposing thiourea solution to the gliding arc.
La formation de sulfate lors du traitement de la thiourée confirme le caractère oxydant du plasma d’air humide utilisé, et, implicitement, le rôle des radicaux OH présents dans la décharge.
Cette étude exploratoire illustre l’extension des procédés avancés d’oxydation aux décharges électriques à haute pression et basse température. Elle peut aisément être étendue à d’autres molécules carbonylées ou thiocarbonylées dont la destruction s’avérerait nécessaire si elles étaient présentes dans des effluents industriels. L’évolution vers un traitement industriel passe alors par un accroissement des vitesses de réaction, et par l’abandon du traitement en « batch » au profit d’un système de circulation aisé à mettre en oeuvre et dont nous avons déjà testé l’efficacité. Elle implique aussi une optimisation de l’interface plasma/solution et celle du transfert énergétique de la source électrique vers le gaz plasma. Un réacteur répondant à ces critères est en cours d’évaluation, ce qui laisse escompter que l’on dispose à très court terme d’un outil performant pour la dépollution de liquides chargés en polluants très variés.
Appendices
Remerciements
Les auteurs remercient la Francophonie pour le soutien matériel et scientifique apporté pour la réalisation de ce travail (programme AUF, 6301 PS 327).
Références bibliographiques
- ABDELMALEK F. (2003). Plasmachimie des solutions aqueuses. Application à la dégradation de composés toxiques. Thèse de Doctorat, Univ. Mostaganem, Algérie, 217 p.
- ABDELMALEK F., S. GHARBI, B. BENSTAALI, A. ADDOU et J.-L. BRISSET (2004). Plasmachemical degradation of azo dyes by humid air plasma: yellow supranol 4GL, scarlet nylosan F3GL and industrial waste. Water Res., 38, 2339-2347.
- BENSTAALI B., D. MOUSSA, A. ADDOU et J.-L. BRISSET (1998). Plasma treatment of aqueous solutes: some chemical properties of a gliding arc in humid air. Eur. Phys. J. AP, 4, 171-179.
- BENSTAALI B., P. BOUBERT, B.G. CHERON, A. ADDOU et J.-L. BRISSET (2002). Density and rotational temperatures measurements of the NO and OH radicals produced by a gliding arc in humid air and their interaction with aqueous solutions. Plasma Chem. Plasma Process., 22, 553-571.
- BRETHES-DUPOUEY S., R. PEYROUS et B.HELD (2000). Removal of H2S in air by using gliding arc discharges. Eur. Phys. J. AP, 11, 43-58.
- BURLICA R., M. KIRKPATRICK, W.C. FINNEY, R.J. CLARK et B.R. LOCKE (2004). Organic dye removal from aqueous solution by glidarc discharges. J. Electrostat., 62, 309-321.
- CZERNICHOWSKI A. (1992). Gliding discharge reactor for H2S valorization or destruction. Dans : Non-thermal plasma techniques for pollution control. B.M. PENETRANTE et S.E. SCHULTHEIS (Éditeurs), NATO ASI Série G, Vol. 34, Partie B, pp. 371-387.
- CZERNICHOWSKI A., P. CZERNICHOWSKI et M. CZERNICHOWSKI (2003). Glid-arc assisted removal of diluted hydrogen sulfide and methyl mercaptan from air. 16th International Symposium on Plasma Chemistry,, Taormina, Italy, PoB5, p.741.
- DELAIR L. (2004). Caractérisation de sources plasma dédiées à la simulation de rentrées atmosphériques et au traitement de polluants : arc soufflé basse pression et décharge glissante. Thèse de Doctorat, Univ. Rouen, France, 185 p.
- DOUBLA A., F. ABDELMALEK, K. KHELIFA, A. ADDOU et J.-L. BRISSET (2003). Post-discharge plasmachemical oxidation of iron (II) complexes. J. Appl. Electrochem., 3, 73-77.
- FANMOE J., J.O. KAMGANG, D. MOUSSA et J.-L. BRISSET (2003). Application de l’arc glissant au traitement de solvants industriels : cas du 1,1,1 trichloroéthane. Phys. Chem. News, 14, 1-4.
- FRIDMAN A.A., A. PETROUSOV, J. CHAPELLE, J.M. CORMIER, A. CZERNICHOWSKI, H. LESUEUR et J. STEVEFELT (1994). Physical model of the gliding arc. J. Phys. III, 4, 1449-1465.
- HABER F. et J. WEISS (1934). The catalytic decomposition of hydrogen peroxide. Proc. Royal Soc., A 147, 332- 351.
- HNATIUC E. (2002). Procédés électriques de mesure et de traitement des polluants, Lavoisier Tec&Doc, Paris, 370 p.
- JANCA J. et A. MAXIMOV (1997). Oxidation processes in the liquid solutions by means of gliding arc at atmospheric pressure. Proc. XXIIIrd International Conference on Phenomena in Ionized Gases (ICPIG-XXIII), Toulouse, France, 17-22 juillet, I-256.
- JANCA J., S. KUZMIN, A. MAXIMOV, J. TITOVA et A. CZERNICHOWSKI (1999). Investigation of the chemical action of the gliding and point arcs between the metallic electrode and aqueous solution. Plasma Chem. Plasma Process., 19, 53-67.
- KOSSITSYN M., A. GUTSOL et A. FRIDMAN (2003). Generation and diagnostics of non equilibrium plasma in gliding arc discharge. Proc. 16th International Conference on Phenomena in Ionized Gases (ICPIG), Taormina, Italie, Po4.6, p. 231.
- LESUEUR H., A. CZERNICHOWSKI et J. CHAPELLE (1988). Dispositif de génération de plasma basse température par formation de décharges électriques glissantes. Brevet français, No 2639172.
- MOREAU M., N. ORANGE et J.-L. BRISSET (2005). Application of electric discharges at atmospheric pressure to bio-decontamination. Ozone Sci. Eng., 27, 469-473.
- MOUSSA D., J.-L. BRISSET et S. BARGUES (1998). Procédé et dispositif de destruction de produits liquides par plasma froid. Brevet français, N° 98-13439.
- MOUSSA D. et J.-L. BRISSET (2003). Disposal of spent tributylphosphate by gliding arc plasma. J. Hazardous Mater., B102, 189-200.
List of figures
Figure 1
Schéma du réacteur à arc glissant alimenté en haute tension (HT).
Sketch of a gliding arc reactor fed with a HV transformer (HT).
Figure 2
Évolution de l’absorbance à 240 nm d’une solution d’urée (5 x 10‑3 M) en fonction de la durée de traitement. La courbe expérimentale (EX) indicatrice de la teneur en nitrites diffère sensiblement de la courbe théorique (TH) du fait de leur disparition au profit de nitrates.
Absorbance changes of an aqueous 5 x 10‑3 M urea solution at 240 nm vs. exposure time t* (min) to plasma due to the formation of nitrites. The experimental (EX) and theoretical (TH) exponential plots differ slightly because of the further transformation of nitrite to nitrate.
Figure 3
Évolution de la teneur en carbone de la solution d’urée en fonction de la durée de traitement t* (min). Pour t* < 90 min : Y = -0,38x + 60,94; R2 = 0,996. Pour t* < 200 min : Y = ‑0,3174x + 58,497; R2 = 0,9858.
Kinetics of the degradation of urea followed by TOC measurements vs. treatment time t* (min). For t* < 90 min: Y = -0.38x + 60.94; R2 = 0.996. For t* < 200 min: Y = ‑0.3174x + 58.497; R2 = 0.9858.
Figure 4
Évolution de l’absorbance à 260 nm d’une solution de thiourée exposée au « glidarc ».
Changes in the absorbance at 260 nm of thiourea solutions exposed to the gliding arc.
Figure 5
Tentative de modélisation des courbes d’absorbance (ou de concentration) de solutions de thiourée traitées par plasma selon la formation de nitrites (traits noirs) : Composante thiourée (tu) : … + … Composante nitrites : a (trait continu); (b) tireté; (c) pointillé. Courbes somme (en gris) : (tu) + (a) continu; (tu) + (b) tireté gras; (tu) + (c) tireté. Les grandeurs en abscisse et ordonnée sont arbitraires.
A rough attempt to model the absorption (or concentration) plots of plasma treated thiourea (tu) solutions for various formation rates of nitrite (black plots): (a) line; (b) dashes; (c) dotted. Absorbance of (tu): ….+…. Resulting absorbance of (tu) + (nitrite) solutions in grey plots: (tu) +(a) line; (tu) + (b) dashed bold; (tu) + (c) dashed. Abscissa are in arbitrary units.
Figure 6
Teneur en sulfate formé à partir de thiourée par exposition au plasma.
Amount of sulphate formed by exposing thiourea solution to the gliding arc.