Abstracts
Résumé
Ce travail porte sur l’étude de l’adsorption du colorant bleu de méthylène, colorant cationique utilisé dans la teinture du coton, du bois et de la soie sur l’argile brute et purifiée de la région de Safi (Maroc). Les essais d’adsorption ont montré que l’équilibre s’établit au bout de 20 minutes. Différents paramètres expérimentaux ont été analysés : pH, masse d’adsorbant et concentration initiale en colorant. Les résultats expérimentaux ont montré que l’adsorption du colorant bleu de méthylène sur l’argile brute et purifiée dépend du pH de la solution et de la concentration initiale en colorant.
La capacité d’adsorption a été déterminée en utilisant les isothermes de Langmuir et Freundlich. La capacité maximale d’adsorption de l’argile brute est de 50 mg•g-1, celle de l’argile purifiée est de 68,5 mg•g-1. La cinétique d’adsorption du bleu de méthylène a été étudiée en utilisant les équations du pseudo-premier-ordre et pseudo-second-ordre. L’adsorption du colorant bleu de méthylène sur l’argile brute et purifiée peut être décrite par une cinétique du pseudo-second-ordre. L’effet de la température sur l’adsorption du colorant a été également étudié et les paramètres thermodynamiques ont été déterminés.
Mots-clés :
- Adsorption,
- colorant cationique,
- argile,
- isothermes d’adsorption,
- paramètres thermodynamiques
Abstract
This study reports the adsorption of methylene blue dye, a cationic dye used in dyeing cotton, wood and silk, on the crude and purified clay from Safi (Morocco). The adsorption experiments demonstrated that adsorption equilibrium is established after 20 minutes. Various experimental parameters were analyzed: pH, adsorbent mass, initial dye concentration. The experimental results showed that adsorption of methylene blue onto crude and purified clay is related to the pH of the solution and the initial dye concentration.
The adsorption capacity was determined using the Langmuir and Freundlich isotherms. The monolayer adsorption capacity for methylene blue dye is 50 mg per g of crude clay while the monolayer adsorption capacity on purified clay is 68,5 mg per g clay. The adsorption kinetics of methylene blue were studied using the equations of the pseudo-first-order and pseudo-second-order reactions. The kinetics of adsorption of methylene blue dye onto the crude and purified clay can be described by a pseudo-second-order model. The effect of temperature on the adsorption of the dye was also evaluated and the thermodynamic parameters were determined.
Keywords:
- Adsorption,
- clay,
- cationic dye,
- adsorption isotherm,
- thermodynamic parameters
Article body
1. Introduction
Les colorants sont utilisés dans de nombreux secteurs industriels tels que les teintures du textile, du papier, du cuir et dans les industries alimentaires et cosmétiques (Batzias et Sidiras, 2007). Les colorants ont la réputation d’être des substances toxiques et persistantes dans l’environnement (Tanetal., 2007); ils nécessitent des techniques physico-chimiques pour les dégrader.
Le bleu de méthylène est le colorant le plus couramment utilisé dans la teinture du coton, du bois et de la soie. Il peut provoquer des brûlures oculaires responsables de blessures permanentes aux yeux de l’homme et des animaux. Son inhalation peut donner lieu à des difficultés respiratoires et son ingestion par la bouche produit une sensation de brûlure, provoque des nausées, des vomissements, transpiration et sueurs froides abondantes (Ghosh et Bhattacharyya, 2002). Le traitement des rejets industriels contenant ce type de colorant s’avère d’un grand intérêt.
Une large variété de techniques physiques, chimiques et biologiques a été développée et testée dans le traitement des effluents chargés en colorants. Ces procédés incluent la floculation, la précipitation, l’échange d’ions, la filtration sur membrane, l’irradiation et l’ozonation. Cependant, ces procédés sont coûteux et conduisent à la génération de grandes quantités de boues ou à la formation de dérivés (Robinsonet al., 2001).
Parmi les procédés de traitement des rejets liquides, l’adsorption reste une technique relativement utilisée et facile à mettre en oeuvre. Le charbon actif est l’adsorbant le plus largement utilisé en raison de sa grande capacité d’adsorption des matériaux organiques (Juang et al., 1997). Toutefois, cet adsorbant a un coût élevé et reste difficile à régénérer. La recherche d’un autre adsorbant efficace et moins couteux s’avère donc intéressante. Dans cette optique, l’utilisation de l’argile en tant qu’adsorbant présente un grand intérêt en raison de son efficacité, son coût accessible et son abondance (Roulia et Vassiliadis, 2005).
Dans le présent travail, nous nous sommes intéressés à l’étude de l’adsorption du colorant bleu de méthylène sur l’argile de la région de Safi (Maroc), qui est un adsorbant naturel et disponible. Cet adsorbant a été utilisé à l’état brut (sans traitement préalable, taille des particules < 80 µm) et à l’état purifié (taille des particules < 2 µm).
Différents paramètres expérimentaux ont été analysés : pH, masse d’adsorbant, concentration initiale en colorant. Les résultats expérimentaux ont montré que l’adsorption du colorant bleu de méthylène sur l’argile brute et purifiée dépend du pH de la solution et de la concentration initiale en colorant. Les capacités d’adsorption de l’argile brute et celle purifiée ont été déterminées en utilisant les isothermes de Langmuir et Freundlich. La cinétique d’adsorption du bleu de méthylène a été étudiée en utilisant les équations du pseudo-premier-ordre et du pseudo-second-ordre. L’effet de la température sur l’adsorption du colorant a été également étudié et les paramètres thermodynamiques ont été déterminés.
2. Matériels et méthodes
2 .1 Matériels
Le colorant bleu de méthylène est un colorant cationique d’indice CI 52015, sa formule est C16H18N3SCl et sa masse molaire est de 319,85 mol•g-1. Son spectre visible est donné par la figure 1.
Figure1
Spectre visible du colorant bleu de méthylène étudié (concentration en colorant 20 mg•L-1).
Visible spectrum of methylene blue dye (dye concentration 20 mg•L-1).
L’argile brute utilisée dans ce travail est une argile prélevée d’un bassin naturel de la région de Safi (Maroc), broyée et tamisée pour obtenir des fractions < 80 µm puis séchée à 105 °C pendant 24 h.
Pour obtenir l’argile purifiée, l’argile brute, préalablement broyée et tamisée à une taille inférieure à 80 µm, est mise en suspension avec un rapport de 10 g•100 mL-1 dans des flacons en polyéthylène contenant une solution de NaCl à 0,1 M. Après 4 heures d’agitation, les particules argileuses sont séparées de la phase aqueuse par centrifugation à une vitesse de 2 600 rpm pendant 15 min. Ce traitement de saturation-centrifugation est refait successivement à quatre reprises pour rendre l’argile homo-ionique sodique. Cette opération d’homogénéisation est suivie par plusieurs lavages, le culot obtenu après centrifugation avec l’eau distillée jusqu’à ce que le test de nitrate d’argent soit négatif est séché à 105 °c pendant 24 h. L’argile mono-ionique ainsi élaborée subit ensuite une attaque acide par l’ajout d’une solution tampon (pH = 4,2) afin d’éliminer les carbonates. L’argile obtenue est ensuite mise en suspension pendant un temps défini (8 h) et la partie supérieure est extraite de manière à ne récupérer que les particules de taille < 2 µm.
Les analyses chimiques de l’argile brute et celle purifiée ont été exécutées à l’aide du spectromètre de fluorescence X (Cement X ray spectrometer philips x’ cem), les résultats sont regroupés dans le tableau 1.
Tableau 1
Composition minéralogique de l'argile brute et purifiée.
Mineralogical composition of the crude and purified clay.
Pour identifier les phases prédominantes du minéral argileux, des analyses diffractométriques de rayon X ont été exécutées à l’aide du Diffractomètre Siemens D-5000. Les résultats sont regroupés dans la figure 2.
Figure 2
Analyse diffractométrique de l'argile brute et l'argile purifiée.
X-ray diffractometer analysis of the crude and purified clay.
2.2 Méthodes
2.2.1 Les expériences d’adsorption
Les expériences d’adsorption ont été effectuées en batch à différentes valeurs initiales du pH, de la température et de la concentration en colorant. Les expériences de l’adsorption ont été exécutées en introduisant une quantité précisément pesée d’adsorbant dans un volume de 100 mL de solution pure du colorant bleu de méthylène à 24 mg•L-1. Les prélèvements ont été effectués toutes les 8 min. La solution colorée a été séparée de l’adsorbant par centrifugation à 2 600 rpm pendant 4 min. L’absorbance de la solution du surnageant a été mesurée en utilisant un spectromètre [GBC (Ajax, Ontario) UV/visible 911] à la longueur d’onde qui correspond à l’absorbance maximale de l’échantillon (λ = 666 nm). La concentration en colorant résiduel dans le mélange de réaction a été calculée à l’aide de la courbe de calibrage dont l’équation est donnée par :
où A666 est l’absorbance de l’échantillon à la longueur d’onde 666 nm.
La capacité d’adsorption du colorant bleu de méthylène a été calculée en utilisant la formule suivante :
où qt (mg•g-1) est la quantité adsorbée à l’instant t (min), C0 (mg•L-1) est la concentration initiale en colorant, Ct est la concentration en colorant à l’instant t, V est le volume de la solution (mL) et W est la quantité de l’adsorbant en solution.
2.2.2 L’influence du pH
L’influence du pH de la solution sur l’adsorption a été étudiée en utilisant différentes valeurs du pH : 4, 6, 9,5 et 12. Les expériences ont été réalisées en ajoutant 40 mg d’argile brute ou d’argile purifiée à 100 mL de la solution du bleu de méthylène (100 mL, 24 mg•L-1 à température constante 25 °C). Le pH du système eaux colorées - argile a été ajusté aux valeurs désirées par l’addition de HNO3 pour acidifier ou de NaOH pour basifier.
2.2.3 L’influence de la température
L’influence de la température a été étudiée en utilisant un bain thermostat permettant le maintien de la température à la valeur désirée (30 °, 40 °, 50° ou 60 °C). Les expériences ont été réalisées en ajoutant 40 mg d’argile brute ou purifiée à 100 mL de la solution du bleu de méthylène (100 mL, 24 mg•L-1 à température constante 25 °C).
2.2.4 L’influence de la concentration initiale en colorant
Quarante mg d’argile brute ou purifiée ont été ajoutés à 100 mL de chacune des trois solutions du bleu de méthylène dont la concentration initiale est de 16, 20 et 24 mg•L-1.
2.2.5 Mécanisme de la cinétique d’adsorption
Afin d’examiner le mécanisme d’adsorption, les modèles cinétiques du pseudo-premier-ordre et du pseudo-second-ordre ont été utilisés pour tester les données expérimentales dynamiques.
2.2.5.1 Le modèle du pseudo-premier-ordre
Le modèle cinétique du pseudo-premier-ordre est exprimé comme suit : (Gürseset al., 2006; Önalet al., 2007) :
où qe et qt sont respectivement les quantités du colorant (mg•g-1) adsorbées sur l’argile à l’équilibre et à l’instant t. k1 est la constante de vitesse (min-1). En intégrant et en appliquant les conditions initiales (à t = 0, qt = 0 et à t = te, qt = qe), l’équation 3 prend la forme :
k1 et qe sont obtenues en représentant Log(qe - qt) en fonction de t.
2.2.5.2 Le modèle du pseudo second ordre
Les données d’adsorption ont aussi été analysées selon le modèle cinétique du pseudo-second-ordre exprimé comme suit (Gürseset al., 2006; Önalet al., 2007) :
k2 est la constante de vitesse du pseudo-second-ordre (g•mg-1•min-1). En intégrant et appliquant les conditions (à t = 0, qt = 0 et à t = te, qt = qe), l’équation 5 prend la forme linéaire :
qe et k2 sont obtenues en représentant t/qt en fonction de t.
3. Résultats et discussion
3.1 Caractérisation de l’adsorbant
3.1.1 Analyse chimique quantitative
La composition chimique est donnée en pourcentage massique des oxydes présents sous formes combinée ou libre. Les résultats obtenus pour l’argile brute et l’argile purifiée sont représentés sur le tableau 1. Ils montrent que SiO2 et Al2O3 sont les principaux constituants des deux argiles (brute et purifiée). La teneur en calcium dans l’argile purifiée relativement faible en comparaison avec l’argile brute indique que cet élément provient essentiellement des carbonates.
3.1.2 Composition minéralogique
Les diagrammes DRX permettent d’identifier les différents minéraux qui constituent l’argile brute et l’argile purifiée (Figure 2). L’examen du diagramme de diffraction de l’argile brute montre la présence des raies intenses (9,99 Å; 7,16 Å; 5,02 Å; 4,47 Å; 4,25 Å; 3,579 Å; 3,34 Å; 3,03 Å et 2,9 Å) qui caractérisent respectivement l’illite, la kaolinite, l’illite, la kaolinite, le quartz, la kaolinite, le quartz + l’illite, la calcite et la dolomite. Après la purification de l’argile brute, les pics du quartz, calcite et dolomite sont devenus peu significatifs (4,25 Å; 3,03 Å; et 2,9 Å respectivement), alors que ceux de l’illite et de la kaolinite sont devenus plus intenses (9,99 Å, 7,16 Å, 5,02 Å, 4,47 Å).
3.2 Effet de la quantité d’adsorbant
Afin d’estimer la quantité optimale d’argile brute ou purifiée à ajouter à la solution colorée, les expériences ont été menées en utilisant 100 mL de la solution de bleu de méthylène à 24 mg•L-1, à laquelle différentes quantités d’argile ont été ajoutées. La figure 3 montre que la quantité de colorant adsorbée augmente avec l’ajout d’adsorbant jusqu’à la masse 40 mg. À partir de 40 mg d’argile, la quantité adsorbée du colorant n’évolue plus. Ce comportement peut être dû au nombre de sites d’adsorption qui augmente avec la quantité d’adsorbant jusqu’à la masse 40 mg à partir de laquelle le nombre de sites devient stable (Guptaet al., 2005; Tsaiet al., 2007). Ce comportement peut être expliqué par :
Tant que la quantité d’adsorbant ajoutée à la solution de colorant est faible, les cations du colorant peuvent accéder facilement aux sites d’adsorption. L’ajout d’adsorbant permet d’augmenter le nombre de sites d’adsorption mais les cations du colorant ont plus de difficultés à approcher ces sites à cause de l’encombrement;
Une grande quantité d’adsorbant crée des agglomérations de particules, d’où une réduction de la surface totale d’adsorption et, par conséquent, une diminution de la quantité d’adsorbat par unité de masse d’adsorbant.
Figure 3
Influence de la masse d'adsorbant (argile brute et argile purifiée) sur la concentration résiduelle du colorant.
Influence of the amount of adsorbent (crude and purified clay) on the residual concentration of methylene blue.
3.3 Effet de la concentration initiale en colorant
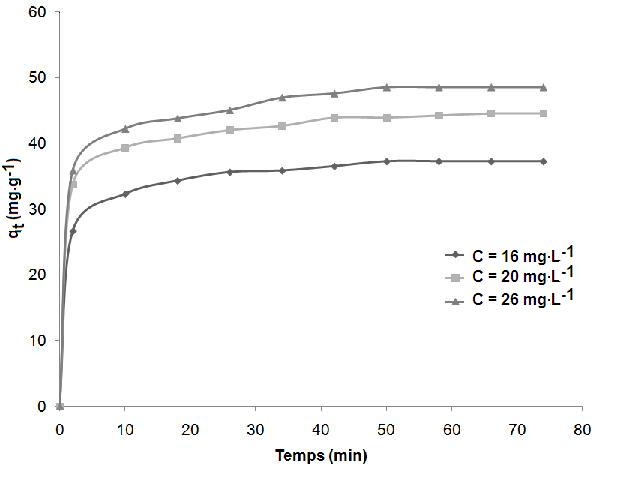
Les figures 4 et 5 représentent les courbes d’évolution de la quantité du colorant adsorbée par gramme d’argile en fonction du temps de contact à différentes concentrations initiales (16, 20 et 26 mg•L-1) en colorant pour l’argile brute et l’argile purifiée. On remarque que le temps d’équilibre est indépendant de la concentration et que la quantité adsorbée à l’équilibre augmente avec la concentration. On remarque également que la vitesse initiale d’adsorption augmente avec la concentration, ceci est dû au fait que la diffusion des molécules du colorant de la solution à la surface de l’adsorbant est accélérée par l’augmentation de la concentration en colorant (Karagozogluet al., 2007).
Figure 4
Influence de la concentration initiale en colorant sur l'adsorption du bleu de méthylène sur l'argile brute.
Influence of the initial dye concentration on the adsorption of methylene blue on crude clay.
Figure 5
Influence de la concentration initiale en colorant sur l'adsorption du bleu de méthylène sur l'argile purifiée.
Influence of the initial dye concentration on the adsorption of methylene blue on purified clay.
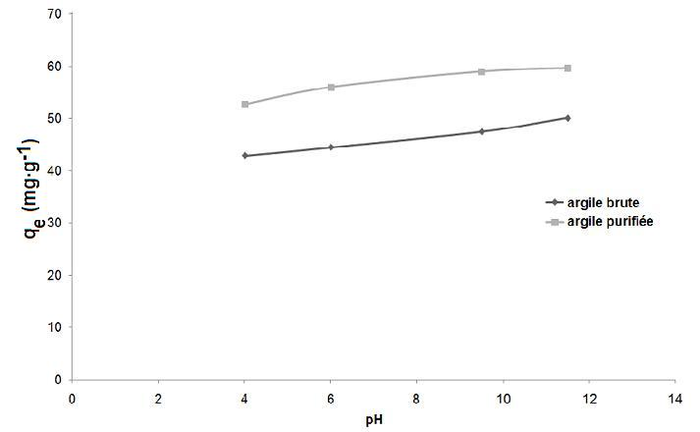
3.4 Effet du pH sur la capacité de rétention du colorant bleu de méthylène
Le comportement de l’adsorption du colorant bleu de méthylène sur les deux adsorbants a été étudié sur une large gamme de pH 4-12. La figure 6 montre une légère augmentation de la quantité adsorbée de colorant par l’argile brute ou purifiée avec le pH de la solution. Les PZC de l’argile brute et purifiée étant, respectivement, 9,5 et 8; ce comportement peut être dû au fait que la surface de l’argile est chargée négativement aux pH > PZC, ce qui favorise l’adsorption du colorant cationique bleu de méthylène. Par contre, pour des valeurs de pH < PZC, la surface de l’argile est chargée positivement, et donc susceptible de repousser les cations du colorant. Plus le pH diminue, plus le nombre des sites chargés négativement diminue et le nombre des sites chargés positivement augmente (Tahir et Naseem Rauf, 2006; Tsaiet al. 2007; Weng et Pan, 2007). Toutefois, cette augmentation de la capacité d’adsorption (de 52,7 à 59,6 mg•g-1 pour l’argile purifiée et de 42,8 à 50 mg•g-1 pour l’argile brute) reste faible dans cette gamme de pH 4-12.
Figure 6
Influence du pH de la solution sur l'adsorption du colorant bleu de méthylène sur l'argile brute et purifiée.
Influence of pH on the adsorption of methylene blue on crude and purified clay.
3.5 Étude cinétique
Les essais d’adsorption du colorant bleu de méthylène à différentes concentrations initiales sur l’argile brute ou l’argile purifiée ont été menés pendant 120 min. L’adsorption du colorant bleu de méthylène par l’argile brute ou l’argile purifiée se fait rapidement pendant les dix premières minutes (Figures 4 et 5), puis évolue lentement et se stabilise au bout de 40 min.
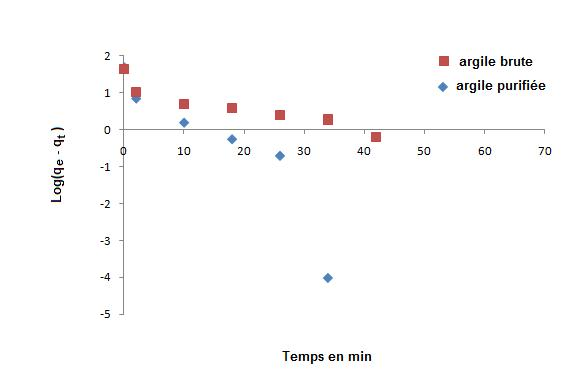
Deux modèles ont été appliqués pour décrire le mécanisme de la cinétique d’adsorption : le pseudo-premier-ordre et le pseudo-second-ordre. La figure 7 montre que Log(qe-qt) en fonction du temps est non linéaire. On en déduit que la cinétique d’adsorption du bleu de méthylène sur l’argile brute et celle purifiée ne peut être décrite par une cinétique du pseudo-premier-ordre. Par contre, la représentation linéaire (Figure 8) de t/qt en fonction du temps, les capacités d’adsorption à l’équilibre et les coefficients de corrélation calculés pour le pseudo-second-ordre (Tableau 2), montrent que ce modèle peut décrire le comportement cinétique de l’adsorption du bleu de méthylène sur l’argile brute et celle purifiée. En effet, on remarque que les coefficients de corrélation r2 sont très proches de 1 et les valeurs des capacités d’adsorption calculées (qe cal) à partir du modèle du pseudo-second-ordre sont très proches des valeurs obtenues expérimentalement (qe exp) (Tableau 2). Des résultats similaires ont été observés (Gürseset al., 2006; Tsaiet al., 2007).
Figure 7
Représentation du modèle cinétique 'pseudo-premier-ordre' pour l'adsorption d'une solution du colorant bleu de méthylène (20 mg•L-1) sur l'argile brute et purifiée.
Pseudo-first-order kinetic model for adsorption of methylene blue dye (20 mg•L-1) on crude and purified clays.
Figure 8
Représentation du modèle cinétique 'pseudo-second-ordre' pour l'adsorption d'une solution du colorant bleu de méthylène (20 mg•L-1) sur l'argile brute et purifiée.
Pseudo-second-order kinetic model for adsorption of methylene blue dye (20 mg•L-1) on crude and purified clays.
Tableau 2
Paramètres cinétiques d'adsorption du colorant bleu de méthylène à différentes concentrations pour l'argile brute et l'argile purifiée.
Kinetic parameters for methylene blue adsorption onto crude and purified clay.
On remarque aussi que les valeurs des constantes de vitesse (Kads) diminuent de 0,016 à 0,011 mg•g-1•min-1 pour l’argile brute et de 0,092 à 0,012 pour l’argile purifiée au fur et à mesure que la concentration augmente. Les capacités d’adsorption augmentent de 37 mg•g-1 à 48 mg•g-1 pour l’argile brute et de 50 mg•g-1 à 59 mg•g-1 pour l’argile purifiée (Tableau 2).
3.6 Paramètres thermodynamiques
L’influence de la température sur l’adsorption du colorant bleu de méthylène par l’argile de Safi a été déterminée. Les résultats obtenus montrent que la capacité d’adsorption augmente avec la température, indiquant que l’adsorption est de nature endothermique (Tableau 3).
Tableau 3
Paramètres thermodynamiques de l'argile brute et purifiée.
Thermodynamic parameters for the adsorption of methylene blue dye on the crude and purified clay.
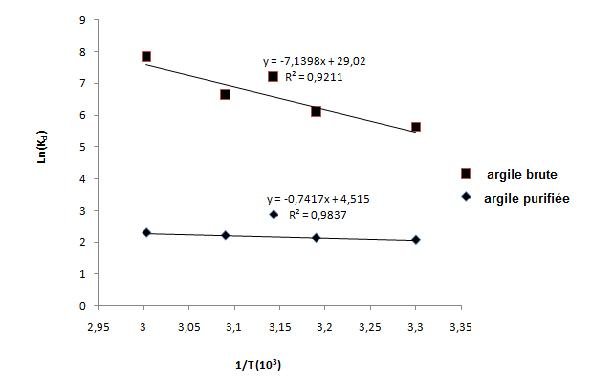
Les paramètres thermodynamiques de l’adsorption ont été déterminés à partir des résultats expérimentaux obtenus à différentes températures en utilisant les équations suivantes :
où Kd est le coefficient de distribution. L’enthalpie standard ΔH° et l’entropie ΔS° de l’adsorption peuvent être déterminées à partir de l’équation de Van’t Hoff suivante :
R est la constante des gaz parfaits. Les valeurs de ΔH° et ΔS° ont été obtenues à partir de la pente et de l’intersection avec l’ordonnée à l’origine de Ln (Kd) en fonction de 1/T (Figure 9). Les paramètres thermodynamiques sont groupés dans le tableau 3. La nature endothermique du processus est confirmée par la valeur positive de l’enthalpie libre (Karagozogluet al., 2007; Weng et Pan, 2007). Les valeurs négatives de ΔG° (Tableau 3) indiquent que l’adsorption du colorant bleu de méthylène sur l’argile brute et purifiée est spontanée (Karagozogluet al., 2007; Weng et Pan, 2007). La valeur positive de ΔS montre l’affinité de l’adsorbant vis-à-vis du colorant (Weng et Pan, 2007). Les valeurs de ΔG° obtenues sont ≤ -4,7 kcal•mol-1 pour les deux adsorbants indiquent que l’adsorption du colorant bleu de méthylène sur l’argile brute et l’argile purifiée est de nature physique (Weng et Pan, 2007).
Figure 9
Représentation de Ln(Kd) en fonction de la température (1/T) pour une concentration en colorant de 24 mg•L-1.
Plot of Ln(Kd) versus temperature (1/T) for dye solution concentration of 24 mg•L-1.
3.7 Les isothermes d’adsorption
3.7.1 L’isotherme de Langmuir
Langmuir suppose que l’adsorbant présente un nombre constant de sites et que l’adsorption est réversible. Une supposition fondamentale de la théorie de Langmuir est que l’adsorption a lieu aux sites homogènes spécifiques de l’adsorbant. Il est alors supposé qu’une fois qu’une molécule de colorant occupe un site, aucune adsorption supplémentaire ne peut avoir lieu dans ce site, une valeur de saturation est donc atteinte au-delà de laquelle aucun autre type d’adsorption ne peut avoir lieu.
La forme linéaire de l’isotherme de Langmuir est donnée par l’équation suivante :
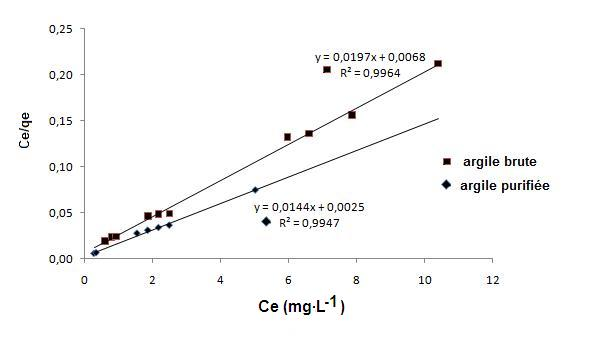
où Ce (mg•L-1) est la concentration à l’équilibre, qe (mg•g-1) est la quantité adsorbée à l’équilibre, qmax (mg•g-1) est la quantité maximale adsorbée et KL (L•mg-1) est la constante de Langmuir. Deux droites sont obtenues en traçant Ce/qe en fonction de Ce dans la gamme de concentration en colorant allant de 10 à 30 mg•L-1 pour l’argile brute et l’argile purifiée respectivement (Figure 10). On constate (Tableau 4) que le coefficient de corrélation r2 (r2 = 0,99) du modèle de Langmuir est très proche de un pour l’argile brute et purifiée. Cette bonne corrélation entre les données d’adsorption et le modèle de Langmuir indique la nature homogène de la surface de l’argile brute et purifiée (Karagozogluet al., 2007; Panneer Selvamet al., 2008). Les valeurs de qmax et KL ont été obtenues, respectivement, à partir de l’intersection avec l’ordonnée à l’origine et la pente de la droite Ce/qe = f(Ce). Les capacités maximales d’adsorption sont, respectivement, de 50 mg•g-1 et 68 mg•g-1 pour l’argile brute et purifiée.
Figure 10
L'isotherme de Langmuir pour l'argile brute (■) et l'argile purifiée (◆).
Langmuir isotherm for adsorption of methylene blue on crude clay (■) and purified clay (◆).
Tableau 4
Paramètres de Langmuir et de Freundlich pour l'argile brute et purifiée.
Table 4. Langmuir and Freundlich parameters for the adsorption of methylene blue dye on crude and purified clay.
Pour savoir si l’adsorption est favorable, l’isotherme de Langmuir peut être exprimée en matière de facteur de séparation RL défini par la relation suivante :
où C0 est la concentration initiale (mg•L-1) et KL est la constante de Langmuir (L•mg-1). (RL > 1) indique que l’adsorption est défavorable, (RL = 1) indique que l’adsorption est linéaire, (0 < RL < 1) indique que l’adsorption est favorable et (RL = 0) indique que l’adsorption est irréversible. La valeur calculée de RL est de 0,77 pour l’argile brute et 0,2 pour l’argile purifiée, ce qui indique que l’adsorption est favorable pour l’argile brute et purifiée.
3.7.2 L’isotherme de Freundlich
La forme linéaire de l’isotherme de Freundlich est donnée par l’équation suivante :
1/n est l’intensité d’adsorption et Kf représente la capacité d’adsorption qui peut être reliée à l’énergie de surface par :
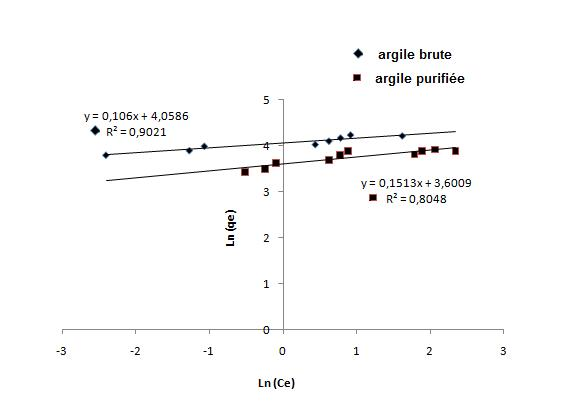
La représentation graphique de ln (qe) en fonction de ln (Ce) pour l’argile brute et l’argile purifiée est une droite de coefficient directeur « 1/n » et d’ordonnée à l’origine ln (Kf) (Figure 11). La valeur de 1/n donne une indication sur la validité de l’adsorption du système adsorbant-adsorbat. Une valeur de 1/n comprise entre 0 et 1 indique une adsorption favorable (Tsaiet al., 2005). Les valeurs numériques de Kf et de 1/n calculées respectivement, à partir de l’intersection avec l’ordonnée à l’origine et la pente de la droite pour l’argile brute et l’argile purifiée, sont représentées sur le tableau 4. La valeur numérique de 1/n = 0,14 pour l’argile brute et 0,1 pour l’argile purifiée (Tableau 4) indiquent que l’adsorption est favorable (Weng et Pan, 2007). Le modèle de Langmuir présente un coefficient de corrélation r2 meilleur que celui du modèle de Freundlich pour les deux adsorbants; ceci indique que l’isotherme de Langmuir décrit mieux l’adsorption que celle de Freundlich.
Figure 11
Isotherme de Freundlich de l’adsorption du bleu de méthylène sur l'argile brute (◆) et l'argile purifiée (■).
Freundlich isotherm for the adsorption of methylene blue on purified clay (◆) and crude clay (■).
4. Conclusion
Cette étude porte sur l’adsorption du colorant bleu de méthylène sur l’argile brute et purifiée de la région de Safi (Maroc). Les résultats expérimentaux montrent que le processus d’adsorption dépend du pH de la solution et de la concentration initiale en colorant : la quantité de colorant adsorbée par gramme d’argile brute ou purifiée augmente avec le pH et la concentration initiale en colorant. L’étude cinétique de l’adsorption du colorant sur l’argile brute et purifiée montre que le processus d’adsorption est très rapide; 95 % de la quantité adsorbée du colorant est atteinte pendant les dix premières minutes et que le mécanisme d’adsorption peut être décrit par une cinétique du pseudo-second-ordre.
Les isothermes d’adsorption du colorant bleu de méthylène sur l’argile brute et l’argile purifiée sont décrites de manière satisfaisante par le modèle de Langmuir et les paramètres thermodynamiques obtenus indiquent que l’adsorption du colorant bleu de méthylène sur l’argile brute et l’argile purifiée est un processus spontané et endothermique.
Les capacités d’adsorption maximales, déterminées à partir de l’isotherme de Langmuir, sont respectivement de 50 et 68,49 mg•g-1 pour l’argile brute et celle purifiée. Ces valeurs montrent que l’argile purifiée présente une meilleure capacité d’adsorption du fait qu’elle renferme un pourcentage de fraction argileuse plus important.
Appendices
Références bibliographiques
- Batzias F.A. et D.K. Sidiras, (2007). Dye adsorption by prehydrolysed beech sawdust in batch and fixed-bed systems. Bioresour. Technol., 98, 1208-1217.
- Ghosh D. et K.G. Bhattacharyya (2002). Adsorption of methylene blue on kaolinite. Appl. Clay Sci., 20, 295-300.
- Gupta V.K., A. Mittal et V. Gajbe (2005). Adsorption and desorption studies of water soluble dye, Quinoline Yellow, using waste materiels. J. Colloid. Interf. Sci., 284, 89-98.
- Gürses A., Ç. Dogar, M. Yalçin, M.Açikyildiz, R. Bayrak et S. Karaca (2006). The adsorption kinetics of the cationic dye, methylene blue, onto clay. J. Hazard. Mater., B131, 217-228.
- Juang R.S, F.C. Wu et R.L. Tseng (1997). The ability of activated clay for the adsorption of dyes from aqueous solutions. Environ. Technol., 18, 525-531.
- Karagozoglu B., M. Tasdemir, E. Demirbas et M. Kobya (2007). The adsorption of basic dye (Astrazon Lue FGRL) from aqueous solutions onto sepiolite, fly ash and apricot shell activated carbon : Kinetic and equilibrium studies. J. Hazard. Mater., 147, 297-306.
- Önal Y., C. Akmil-Basar et Ç. Sarici-Özdemir (2007). Investigation kinetics mechanisms of adsorption malachite green onto activated carbon. J. Hazard. Mater., 146,194-203.
- Panneer Selvam P., S. Preethi, P. Basakaralingam, N. Thinakaran, A. Sivasamy et S. Sivanesan (2008). Removal of Rhodamine B from aqueous solution by adsorption onto sodium montmorillonite. J. Hazard. Mater., 155, 39-44.
- Robinson T., G. McMullan, R. Marchant et P. Nigam (2001). Remediation of dyes in textile effluent: a critical review on current treatment technologies with a proposed alternative. Bioresour. Technol., 77, 247-255.
- Roulia M. et A.A. Vassiliadis (2005). Interactions between C.I. Basic Blue 41 and aluminosilicate sorbents. J. Colloid Interf. Sci., 291, 37-44.
- Tan I.A.W, B.H. Hameed et A.L. Ahmad (2007). Equilibrium and kinetic studies on basic dye adsorption by oil palm fibre activated carbon. Chem. Eng. J., 127, 111-119.
- Tahir S.S. et Naseem Rauf (2006). Removal of cationic dye from aqueous solutions by adsorption onto bentonite clay. Chemosphere. 63, 1842-1848.
- Tsai W.T., H.C. Hsu, T.Yi Su, K.Yu Lin, C. Ming Lin et T.H. Dai (2007). The adsorption of cationic dye from aqueous solution onto acid-activated andesite. J. Hazard. Mater., 147, 1056-1062.
- Tsai W.T., Y.M.Chang, C.W. Lai et C.C. Lo (2005). Adsorption of basic dyes in aqueous solution by clay adsorbent from regenerated bleaching earth. Appl. Clay Sci., 29, 149-154.
- Weng C.H. et Y.F. Pan, (2007). Adsorption of a cationic dye (methylene blue) onto spent activated clay. J. Hazard. Mater., 144, 355-362
List of figures
Figure1
Spectre visible du colorant bleu de méthylène étudié (concentration en colorant 20 mg•L-1).
Visible spectrum of methylene blue dye (dye concentration 20 mg•L-1).
Figure 2
Analyse diffractométrique de l'argile brute et l'argile purifiée.
X-ray diffractometer analysis of the crude and purified clay.
Figure 3
Influence de la masse d'adsorbant (argile brute et argile purifiée) sur la concentration résiduelle du colorant.
Influence of the amount of adsorbent (crude and purified clay) on the residual concentration of methylene blue.
Figure 4
Influence de la concentration initiale en colorant sur l'adsorption du bleu de méthylène sur l'argile brute.
Influence of the initial dye concentration on the adsorption of methylene blue on crude clay.
Figure 5
Influence de la concentration initiale en colorant sur l'adsorption du bleu de méthylène sur l'argile purifiée.
Influence of the initial dye concentration on the adsorption of methylene blue on purified clay.
Figure 6
Influence du pH de la solution sur l'adsorption du colorant bleu de méthylène sur l'argile brute et purifiée.
Influence of pH on the adsorption of methylene blue on crude and purified clay.
Figure 7
Représentation du modèle cinétique 'pseudo-premier-ordre' pour l'adsorption d'une solution du colorant bleu de méthylène (20 mg•L-1) sur l'argile brute et purifiée.
Pseudo-first-order kinetic model for adsorption of methylene blue dye (20 mg•L-1) on crude and purified clays.
Figure 8
Représentation du modèle cinétique 'pseudo-second-ordre' pour l'adsorption d'une solution du colorant bleu de méthylène (20 mg•L-1) sur l'argile brute et purifiée.
Pseudo-second-order kinetic model for adsorption of methylene blue dye (20 mg•L-1) on crude and purified clays.
Figure 9
Représentation de Ln(Kd) en fonction de la température (1/T) pour une concentration en colorant de 24 mg•L-1.
Plot of Ln(Kd) versus temperature (1/T) for dye solution concentration of 24 mg•L-1.
Figure 10
L'isotherme de Langmuir pour l'argile brute (■) et l'argile purifiée (◆).
Langmuir isotherm for adsorption of methylene blue on crude clay (■) and purified clay (◆).
Figure 11
Isotherme de Freundlich de l’adsorption du bleu de méthylène sur l'argile brute (◆) et l'argile purifiée (■).
Freundlich isotherm for the adsorption of methylene blue on purified clay (◆) and crude clay (■).
List of tables
Tableau 1
Composition minéralogique de l'argile brute et purifiée.
Mineralogical composition of the crude and purified clay.
Tableau 2
Paramètres cinétiques d'adsorption du colorant bleu de méthylène à différentes concentrations pour l'argile brute et l'argile purifiée.
Kinetic parameters for methylene blue adsorption onto crude and purified clay.
Tableau 3
Paramètres thermodynamiques de l'argile brute et purifiée.
Thermodynamic parameters for the adsorption of methylene blue dye on the crude and purified clay.
Tableau 4
Paramètres de Langmuir et de Freundlich pour l'argile brute et purifiée.
Table 4. Langmuir and Freundlich parameters for the adsorption of methylene blue dye on crude and purified clay.