Abstracts
Résumé
L’adsorption d’une solution aqueuse d’iode a été étudiée, en régime discontinu, sur quatre échantillons de charbons actifs des résidus de Moabi (Baillonella toxisperma Pierre) d’origine camerounaise (C1, C2, C3, C4) et sur trois échantillons de charbons actifs commerciaux (C5, C6, C7). Le calcul de l’indice d’iode et l’analyse des isothermes d’adsorption par utilisation des théories de Langmuir et de Freundlich ont permis de déterminer le type d’adsorption. Il apparaît que la valeur de l’indice d’iode de l’un des échantillons des charbons des résidus de Moabi (C4) est proche des valeurs de celui des échantillons commerciaux. De plus, l’adsorption de l’iode obéit aux isothermes de Langmuir avec des capacités maximales d’adsorption variant entre 9,35 mmol∙g‑1 (C4) et 13,18 mmol∙g‑1 (C7).
Mots-clés:
- Charbon actif,
- activation,
- adsorption,
- isothermes de Langmuir et de Freundlich,
- Moabi
Abstract
The removal of iodine through adsorption on four types of activated carbon (C1, C2, C3, C4) obtained from local Cameroonian Moabi (Baillonella toxisperma Pierre) residues and on three commercial activated carbons (C5, C6, C7) was studied in a batch mode. The calculation of the iodine index and the analysis of adsorption isotherms obtained using the Langmuir and Freundlich theories allow for the determination of the classification of adsorption. It was found that the iodine index of one activated carbon obtained from Moabi residues (C4) is near to those obtained for the commercial activated carbons. Moreover, the iodine adsorption is clearly described by the Langmuir theory with the maximum capacity of adsorption varying between 9.35 mmol∙g‑1 (C4) and 13.18 mmol∙g‑1 (C7).
Key Words:
- Activated carbon,
- activation,
- adsorption,
- Langmuir and Freundlich isotherms,
- Moabi
Article body
1. Introduction
L’activité humaine dans le monde est à l’origine des gaz à effet de serre à travers les déchets industriels, dont les résidus du bois. Beaucoup de ces résidus issus de la transformation industrielle des billes de bois sont brûlés, jetés ou enfouis dans le sol et contribuent à la pollution de l’environnement. Leur gestion est impérative et pose un ensemble de problèmes, dont la pollution de l’environnement. D’autre part, l’industrie textile consomme de très grandes quantités d’eau. Celles-ci une fois rejetées provoquent des altérations du milieu aquatique à cause de leurs charges en colorants stables, très toxiques et faiblement biodégradables. L’élimination de ces colorants s’effectue par des procédés économiquement acceptables, utilisant plusieurs techniques : traitement biologique pour les biodégradables (ALTINBAS et al., 1995), coagulation, adsorption sur charbon actif (EL-GUENDI, 1991), par méthode électrochimique (LIN et PENG, 1994) et par des procédés membranaires (RIVET, 1989).
Le charbon actif est un adsorbant carboné fortement poreux, hydrophobe et apolaire préparé de façon à avoir un haut degré de porosité qui lui confère une surface spécifique considérable. Il est obtenu à partir de matières végétales (AVOM et HAJAL, 1983; NKO’O et al., 2013), de matières d’origine minérale (LYUBCHIK et al., 1997) et de matières organiques animales (AVOM, 2004). Il fait partie des adsorbants les plus couramment utilisés dans de nombreuses applications en phase liquide et en phase gazeuse pour ses propriétés adsorbantes liées à la porosité et à la surface spécifique. La diversité de ses applications, son impact sur le développement industriel et la santé, montrent son importance à l’heure actuelle.
Dans le cadre des recherches sur la valorisation de la biomasse camerounaise, nous nous sommes intéressés au Moabi (Baillonella toxisperma Pierre) dont l’abondance est signalée et dont l’usage se limite très souvent à la menuiserie, laissant ainsi beaucoup de déchets non valorisés. La présente étude porte sur la détermination et la comparaison des propriétés adsorbantes de charbons actifs de résidus de Moabi et de charbons actifs commerciaux par adsorption de l’iode. Ce travail vise deux objectifs : valoriser les résidus de Moabi en préparant les charbons actifs et contribuer au traitement des eaux : domestique et industrielle. D’après AVOM et al. (1997), le diamètre relativement petit de la molécule d’iode (d < 4,94 Ǻ) par rapport à celui des pores des charbons actifs (d = 10-30 Ǻ) permet son adsorption sélective en solution sur la surface de ces matériaux. Ainsi, l’adsorption de l’iode par les charbons actifs est une alternative à l’adsorption en phase gazeuse dans l’établissement des isothermes d’adsorption.
2. Matériels et méthodes
2.1 Préparation des charbons actifs
Les charbons (C1, C2, C3, C4) proviennent des copeaux de Moabi de la région de Yaoundé et ont été préparés par activation chimique. Après séchage à l’étuve à 110 °C pendant 24 h, les copeaux ont été imprégnés pendant un temps déterminé par une solution d’agent activant (NaOH, H2SO4, H3PO4) de concentration pondérale connue, puis carbonisés dans un réacteur fermé (à fort défaut d’oxygène) à une vitesse de chauffe précise jusqu’à la température requise. Après refroidissement, les charbons obtenus ont été lavés à l’acide chlorhydrique à 5 %, puis à l’eau distillée et enfin séchés. Les réactions d’activation ont été effectuées dans le four électrique ISUNI (type MINI 51A, Rubí, Espagne) à régulation automatique, muni d’un programmateur de température relié au four par un thermocouple de type K, d’un réacteur en quartz. Les charbons (C5, C6, C7) sont des charbons actifs commerciaux granulés d’origine végétale préparés et vendus par la société CHEMVIRON CARBON (Feluy, Belgique).
Tous les charbons ont été broyés et les fractions retenues (d ≤ 80 μm) ont été placées pendant 24 h dans une étuve à 110 °C puis conservées, à température ambiante, dans un dessiccateur. Les tableaux 1 et 2 présentent respectivement les échantillons de charbons de résidus de Moabi et de charbons actifs commerciaux.
Tableau 1
Échantillons des charbons de résidus de Moabi
Samples of activated carbons from Moabi residue
Tableau 2
Échantillons des charbons actifs commerciaux
Samples of commercial activated carbons
2.2 Détermination des indices d’iode
Les études (AVOM et al., 2002) montrent que la détermination des indices d’iode présente un double objectif : elle permet d’une part l’étude du rôle joué par l’activation sur l’augmentation du diamètre des pores, d’autre part c’est un test de contrôle de l’efficacité des charbons actifs obtenus dans les applications en phase aqueuse.
D’après MAREC (1996), l’indice d’iode (mg∙g‑1) ou la quantité en milligramme d'iode adsorbé par gramme de charbon actif est donné par la relation suivante :
où Co est la concentration de la solution initiale d’iode (mol∙L‑1), Cn la concentration de la solution de thiosulfate de sodium (mol∙L‑1), Vn le volume de la solution de thiosulfate de sodium à l’équivalence (mL), le volume de solution d’iode dosé (10 mL), la masse molaire moléculaire de l'iode (254 g∙mol‑1), Vabs le volume d’adsorption (20 mL) et mCA la masse de charbon actif (g).
En prenant Co = 0,1 mol∙L‑1, Cn = 0,1 mol∙L‑1, Vabs = 20 mL, = 10 mL, = 254 g∙mol‑1, Vn (mL) et mCA (g), la relation 1 devient alors la formule 2 de GUEYE et al. (2011) :
Le mode opératoire utilisé est la méthode suggérée par GUEYE et al. (2011) en utilisant la solution d’iode de 0,200 ± 0,001 N normalisée. Un volume de 20 mL de la solution d’iode a été traité par 0,2000 ± 0,0001 g de charbon actif. Après l’équilibre, l’iode restant dans le filtrat a été titré par 0,1 N de thiosulfate de sodium.
2.3 Détermination des isothermes d’adsorption
Pour l’établissement d’une isotherme, le mode opératoire utilisé est le protocole mis au point par AVOM et al. (2002). La masse d’iode adsorbée à l’équilibre par gramme de charbon (Qe) est calculée de la même manière que pour l’indice d’iode, et pour le calcul de la concentration de l’iode en solution à l’équilibre (Ce), il faut tenir compte de l’équilibre I2 + KI ↔ KI3 dont la constante d’équilibre Kc = 870 à 25 °C, par application de la loi d’action des masses :
Pour une meilleure exploitation de l’isotherme d’adsorption, notons qu’il faut considérer la concentration de l’iode libre en solution et non la concentration totale de l’iode à l’équilibre.
3. Résultats et discussion
3.1 Indices d’iode
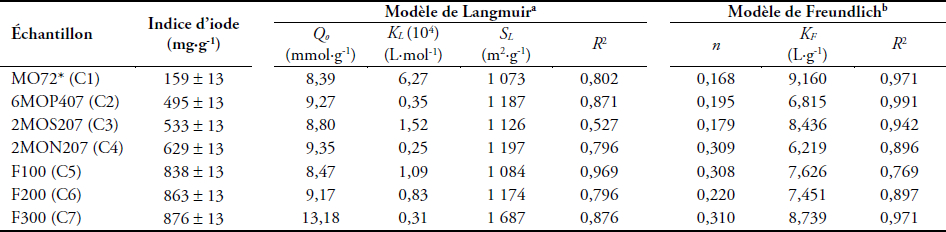
D’après AWWA (1991), la détermination de l’indice d’iode est un test simple et rapide donnant une indication sur la microporosité des charbons actifs. Les valeurs des indices d’iode des charbons actifs préparés à partir des copeaux de Moabi sont comparables à celles des charbons actifs commerciaux étudiés. Ces valeurs sont présentées au tableau 3.
Tableau 3
Résultats relatifs à l’isotherme d’adsorption de l’iode
Adsorption isotherm results for iodine
Qo : quantité de soluté nécessaire pour recouvrir la surface de l’adsorbant d’une monocouche de molécules adsorbées ; KL : constante caractéristique du couple adsorbant-adsorbat; SL : surface spécifique de l'adsorbant
n : constante permettant de décrire l'isotherme d'adsorption; KF : constante caractéristique du couple adsorbant-adsorbat
Les charbons actifs des résidus de Moabi ont donc des pores accessibles à la molécule d’iode. La caractérisation de la porosité permet de choisir le type de charbons actifs à utiliser pour éliminer une catégorie de polluants donnés. Pour éliminer les polluants macromoléculaires, les charbons actifs possédant beaucoup de macropores et de mésopores sont plus indiqués, alors que les charbons actifs disposant majoritairement de micropores sont plus adaptés pour traiter les molécules de faibles poids moléculaires. L’ordre croissant des valeurs des indices d’iode obtenues C1 < C2 < C3 < C4 < C5 < C6 < C7 confirme que l’activation chimique entraîne non seulement la création de nouveaux pores, mais aussi l’élargissement des pores disponibles. De plus, le type d’agent activant utilisé dans la préparation des charbons actifs a une influence sur l’efficacité de ces charbons. Ces tests de caractérisation à l’indice d’iode montrent une microporosité plus forte chez le charbon actif C4 (préparé à partir de NaOH) pour ce qui est des charbons de résidus de Moabi avec un indice d’iode de 629 mg∙g‑1 et C7 pour les charbons actifs commerciaux avec 876 mg∙g‑1. Cette microporosité est très faible pour le charbon non activé C1 avec un indice d’iode de 159 mg∙g‑1. Ainsi, NaOH est le meilleur agent activant dans notre étude.
3.2 Isothermes d’adsorption
3.2.1 Détermination de Qe et de Ce
3.2.1.1 Détermination de Qe (masse d’iode adsorbée à l’équilibre par gramme de charbon)
La masse d’iode adsorbée à l’équilibre par gramme de charbon (Qe) est calculée à partir de la formule de l’indice d’iode :
où les constantes gardent la même signification que dans la relation 1.
3.2.1.2 Détermination de Ce (concentration de l’iode en solution à l’équilibre)
Pour le calcul de Ce des études (AVOM, 2004) montrent qu’il faut tenir compte de l’équilibre I2 + KI ↔ KI3 dont la constante d’équilibre Kc = 870 à 25 °C. Le dosage par le thiosulfate permet de déterminer la concentration en iode total en solution sous forme de I2 (iode libre) et I3ˉ (iode combiné) et d’après HILL et MARSH (1968) l’adsorption de l’iode par le charbon ne dépend que de l’iode libre en solution. L’expression de Ce est :
où est la concentration de l’iode total à l’équilibre (mol∙L‑1) et est obtenue par dosage volumétrique en utilisant une solution de thiosulfate de sodium de concentration connue, CKI étant la concentration de la solution initiale de KI.
3.2.2 Modèles
Les modèles mathématiques utilisés sont les modèles de Langmuir et de Freundlich, car plus appropriés pour des substances hydrophobes à l’instar des charbons actifs.
3.2.2.1 Modèle de Langmuir
Le modèle de Langmuir suppose la formation d’une couche monomoléculaire à la surface de l’adsorbant. L’équation de Langmuir relative à l’adsorption d’une monocouche est :
où Qe est la quantité de soluté adsorbée à l’équilibre par unité de masse d’adsorbant (mg∙g‑1), Qo la quantité de soluté nécessaire pour recouvrir la surface de l’adsorbant d’une monocouche de molécules adsorbées (mg∙g‑1), KL la constante caractéristique du couple adsorbant-adsorbat dans l’équation de Langmuir, Ce la concentration d’adsorbat en solution à l’équilibre (soluté non adsorbé), par unité de masse de solide (mg∙L‑1∙g‑1).
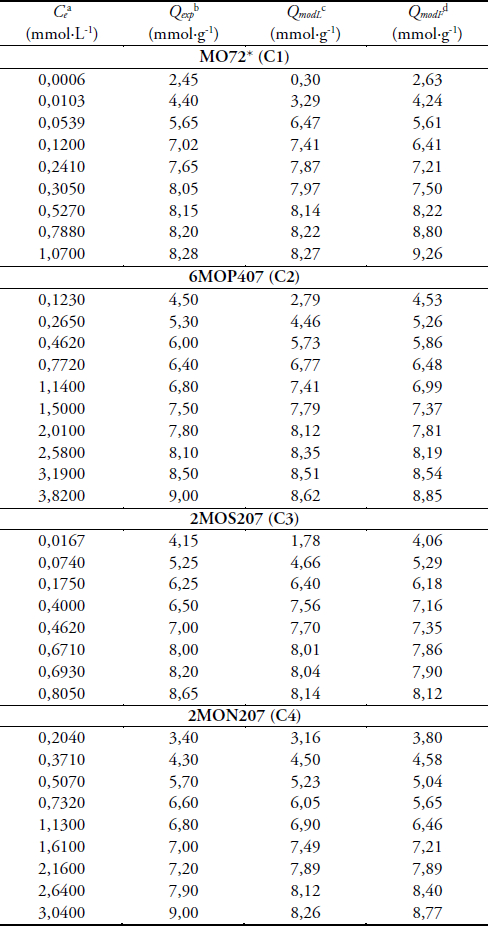
Les valeurs de Qe (Qexp) et de Ce, reportées dans les tableaux 4 et 5, ont permis de construire les isothermes de Langmuir Qe = f(Ce). Ces isothermes, réalisées suivant la régression non linéaire, sont rassemblées dans les figures 1 et 2. En effet, différentes méthodes peuvent être utilisées pour la détermination des paramètres de Langmuir, comme, par exemple, la transformation des données expérimentales sous une forme linéaire. La meilleure alternative de la linéarisation est la régression non linéaire (BOULINGUIEZ et al., 2008).
Tableau 4
Résultats expérimentaux des charbons de résidus de Moabi
Experimental results for the Moabi residue activated carbons
Tableau 5
Résultats expérimentaux des charbons commerciaux
Experimental results for the commercial activated carbons
Ce : concentration de l’iode en solution à l’équilibre
Qexp : valeur expérimentale de Qe (masse d’iode adsorbée à l’équilibre par gramme de charbon)
QmodL : valeur de Qe obtenue par le modèle de Langmuir
QmodF : valeur de Qe obtenue par le modèle de Freundlich
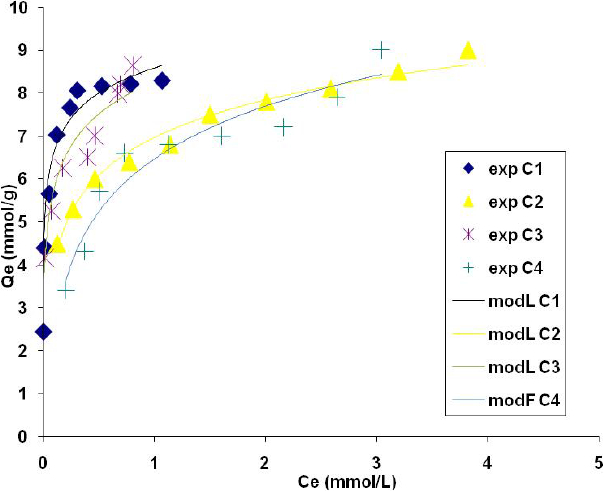
Figure 1
Isothermes d’adsorption de l’iode suivant le modèle de Langmuir (charbons de Moabi). Exp : valeurs expérimentales; modL et modF : valeurs obtenues par le modèle de Langmuir et celui de Freundlich
Iodine adsorption isotherms according to the Langmuir model (Moabi activated carbons). Exp: experimental values; modL and modF: values obtained using the Langmuir and Freundlich models
Figure 2
Isothermes d’adsorption de l’iode suivant le modèle de Langmuir (charbons commerciaux). Exp : valeurs expérimentales; modL : valeurs obtenues par le modèle de Langmuir
Iodine adsorption isotherms according to the Langmuir model (commercial activated carbons). Exp: experimental values; modL: values obtained using the Langmuir model
La connaissance de la valeur de Qo conduit à la détermination de la surface spécifique SL par application de la relation :
L’aire occupée par une molécule d’iode est égale à σ = 21,3 Ǻ2. NA = 6,023 x 1023 est le nombre d’Avogadro.
L’équation 7 devient alors la relation :
Les valeurs des surfaces spécifiques (SL) et de la constante Qo sont rapportées au tableau 3.
Une classification des différentes formes d’isothermes d’adsorption a été proposée par BRUNAUER et al. (1940). Des mécanismes d’adsorption, ainsi que des caractéristiques de porosité d’adsorbant y ont été associés (GIRAUDET, 2006). Par exemple, l’isotherme de type II concerne des adsorptions où le nombre de couches de molécules adsorbées n’est pas limité. L’isotherme de type IV représente une adsorption multicouche avec condensation capillaire dans les pores de l’adsorbant. Pour que ce phénomène de capillarité existe, il faut que l’isotherme présente une hystérésis au cours d’un cycle d’adsorption-désorption. Cette hystérésis, pendant la phase de désorption, peut également indiquer la présence de mésopores. Le type I ne s’observe qu’avec des adsorbants microporeux où l’adsorption semble limitée à une ou deux couches. Ceci est une conséquence de l’encombrement stérique des molécules adsorbées.
Les isothermes d’adsorption des échantillons C1, C2 pour les charbons de résidus de Moabi et C5, C6 pour les charbons commerciaux sont de type I dans la classification de Brunauer présentée par certaines études (ANDERSON et BOUDART, 1993), alors que les échantillons C3, C4 et C7 donnent des isothermes de type II (figures 1 et 2).
Les charbons C1, C2, C5 et C6 peuvent être considérés comme des adsorbants microporeux où l’adsorption semble limitée à une ou deux couches. D’après SFYRAKIS et al. (1995), ces charbons ont des pores dont le diamètre moyen se situe entre 0 et 25 Å. Par contre, les échantillons C3, C4 et C7 concernent des adsorptions où le nombre de couches de molécules adsorbées n’est pas limité. En effet, plus les pores sont fins, plus leur contribution à la surface est importante. Le charbon C7 possède donc la structure la plus fine. L’ordre croissant du pouvoir adsorbant déterminé par rapport à la valeur de Qo est le suivant : C1 < C5 < C3 < C6 < C2 < C4 < C7. Cet ordre n’est pas très différent de celui déduit par mesure de l’indice d’iode. La légère différence peut être liée, aux erreurs d’expérience, au phénomène de condensation capillaire dans les pores de l’adsorbant ou au remplissage irrégulier de la surface du charbon, résultat qui est confirmé par ceux d’AVOM et al. (2002). Tous les charbons actifs faisant l’objet de notre étude ont une capacité d’adsorption supérieure à celle du charbon non activé C1; ceci est conforme au schéma classique de l’activation qui est la création des pores par le départ des solides et fluides amorphes, suivie de l’élargissement des pores disponibles par l’attaque du squelette carboné.
3.2.2.2 Modèle de Freundlich
L’équation empirique de Freundlich, basée sur l’hypothèse qu’une couche monomoléculaire est adsorbée, est donnée par la relation 9 :
où Qe est la quantité de soluté adsorbée à l’équilibre par unité de masse d’adsorbant (mg∙g‑1), KF la constante caractéristique du couple adsorbant-adsorbat dans l’équation de Freundlich, n la constante permettant de décrire l’isotherme d’adsorption, Ce la concentration d’adsorbat en solution à l’équilibre (soluté non adsorbé) par unité de masse de solide (mg∙L‑1∙g‑1).
Les valeurs de Qe (Qexp) et de Ce, consignées dans les tableaux 4 et 5, ont permis de tracer la courbe Qe = f(Ce) en réalisant la régression non linéaire sur le modèle de Freundlich. Les isothermes de Freundlich obtenues sont rassemblées dans les figures 3 et 4. Cette méthode de régression a permis de déterminer les valeurs des constantes de Freundlich consignées dans le tableau 3.
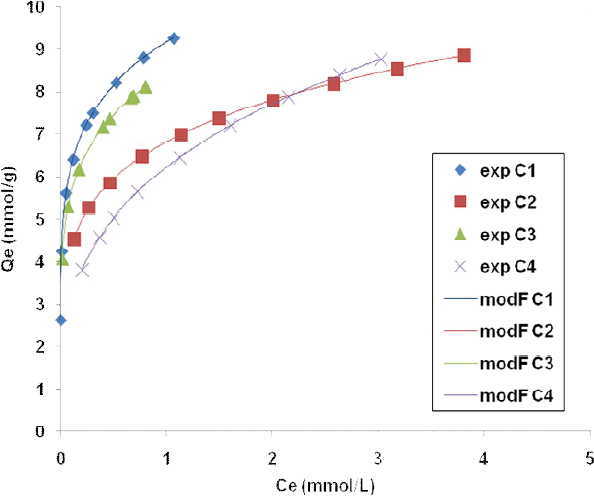
Figure 3
Isothermes d’adsorption de l’iode suivant le modèle de Freundlich (charbons de Moabi). Exp : valeurs expérimentales; modF : valeurs obtenues par le modèle de Freundlich
Iodine adsorption isotherms according to the Freundlich model (Moabi activated carbons). Exp: experimental values; modF: values obtained using the Freundlich model
Figure 4
Isothermes d’adsorption de l’iode suivant le modèle de Freundlich (charbons commerciaux). Exp : valeurs expérimentales; modF : valeurs obtenues par le modèle de Freundlich
Iodine adsorption isotherms according to the Freundlich model (commercial activated carbons). Exp: experimental values; modF: values obtained using the Freundlich model
Le modèle de Freundlich est caractérisé par la constante n qui est une indication sur l’amplitude et la diversité des énergies liées à un type particulier d’adsorption alors que KF indique la capacité d’adsorption. D’après WEBER et al. (1992), plus la valeur de KF est élevée, plus grande est l’affinité de l’adsorbant pour l’adsorbat et plus l’adsorbant est poreux. L’ordre croissant du pouvoir adsorbant déterminé par rapport à la valeur de KF est le suivant : C4 < C2 < C5 < C6 < C3 < C7 < C1. En outre, les études (ANWAR, 2007) montrent que la constante n est un paramètre compris entre 0 et 1 et traduit l’état de surface de l’adsorbant (degré d’homogénéité). Plus cette constante s’approche de l’unité, plus la surface est homogène; lorsqu’elle tend vers zéro, la surface devient hétérogène. L’ordre croissant du degré d’homogénéité est le suivant par rapport à la valeur de la constante n : C1 < C3 < C2 < C6 < C5 < C4 < C7.
Les résultats obtenus par exploitation des données expérimentales par le modèle de Freundlich sont différents de ceux déduits par le modèle de Langmuir. La différence pourrait s’expliquer par les restrictions liées aux hypothèses d’application de ces modèles, car, d’après PORQUET (1999), l’adsorption avec le modèle de Langmuir ne permet pas la superposition de molécules sur les sites déjà occupés et cette adsorption est monomoléculaire. D’après les résultats obtenus, on peut dire que l’adsorption de l’iode par les charbons étudiés est mieux décrite par le modèle de Freundlich (coefficient de corrélation proche de 1).
4. Conclusion
La présente étude montre que les charbons actifs de résidus de Moabi pourraient être utilisés pour l’élimination des colorants organiques en solution aqueuse. Le plus adsorbant des charbons préparés est l’échantillon C4, obtenu après imprégnation pendant 2 h dans la soude (20 %) et carbonisé à 700 °C. La valeur de l’indice d’iode de ce charbon (629 mg∙g‑1) est comparable à celle du meilleur charbon commercial C7 (876 mg∙g‑1). Le meilleur agent activant dans nos conditions de travail est la soude. La théorie de Freundlich permet de mieux décrire l’adsorption de l’iode dans notre étude.
Des études complémentaires (surface BET, distribution de la taille des pores, point de charge nulle) sont en cours pour optimiser les applications des charbons préparés.
Appendices
Remerciements
Nous remercions particulièrement le professeur M. Ndikontar pour toutes les suggestions.
Références bibliographiques
- ALTINBAS U., S. DOKMECI et A. BARISTIRAN (1995). Treatability study of wastewater from textile industry. Environ. Technol., 16, 389-394.
- AMERICAN WATER WORKS ASSOCIATION (AWWA) (1991). B600-90: AWWA standard of powder activated carbon. American Water Works Association, STB_0029782, Denver, USA, 28 p.
- ANDERSON J.R. et M. BOUDART (1993). Morphology and scaling macromolecules. Catal. Sci. Technol., 2, 171.
- ANWAR E. (2007). Réactivité thermique et cinétique de dégradation du bois d’arganier. Application à l’élaboration de charbon actif par activation chimique à l’acide phosphorique. Thèse de doctorat, Univ. Mohammed V, Maroc, 150 p.
- AVOM J. et I.J. HAJAL (1983). Préparation et étude physico-chimique des charbons de rafles de régime de palmes. Sci. Technol., 3 (1, 2), 1-8.
- AVOM J., J.M. KETCHA, C. NOUBACTEP et P. GERMAIN (1997). Adsorption of methylene blue from an aqueous solution on to activated carbons from palm-tree cobs. Carbon, 35 (3), 365-369.
- AVOM J., J.M. KETCHA, D.D. BABALE, A.I. NGONO et G. PATRICK (2002). Adsorption de l’iode par des charbons actifs de rafles de régimes de palmes. Déchets Sci. Tech., 28, 26-32.
- AVOM J. (2004). Contribution à la valorisation de l’Ayous (Triplochiton scleroxylon), de l’Akom (Terminalia superba) et des rafles de régime de palmes : Carbonisation - Activation - Propriétés adsorbantes. Application au traitement des eaux.Thèse de doctorat, Univ. Yaoundé I, Cameroun, pp. 14-170.
- BOULINGUIEZ B., P. LE CLOIREC et D. WOLBERT (2008). Revisiting the determination of Langmuir parameters - application to tetrahydrothiophene adsorption onto activated carbon. Langmuir, 24, 6420-6424.
- BRUNAUER S., L.S. DEMING, W.E. DEMING et E. TELLER (1940). On a theory of the Van der Waals adsorption of gases. J. Am. Chem. Soc., 62 (7), 1723-1732.
- EL-GUENDI M.S. (1991). Colour removal from textile effluents by adsorption techniques. Water Res., 25 (3), 271-273.
- GIRAUDET S. (2006). Performances et sécurité des procédés de traitement des composés organiques volatils par adsorption sur charbon actif. Thèse de doctorat, Univ. de Nantes, France, pp. 83-109.
- GUEYE M., J. BLIN et C. BRUNSCHWIG (2011). Étude de la synthèse des charbons actifs à partir de biomasses locales par activation chimique avec H3PO4. 6ème édition Journées Scientifiques du 2iE, 4 au 8 avril, Ouagadougou, Burkina Faso.
- HILL A. et H. MARSH (1968). A study of the adsorption of iodine and acetic acid from aqueous solutions. Carbon, 6 (1), 31-39.
- LIN S.H. et C.F. PENG (1994). Treatment of textile wastewater by electrochemical method. Water Res., 28 (2), 277-282.
- LYUBCHIK S.B., H. BENADDI, V.V. SHAPRANOV et F. BEGUIN (1997). Activated carbons from chemically treated anthracite. Carbon, 35 (1), 162-165.
- MAREC J. F. (1996). Fabrication et caractérisation d’un charbon actif rustique issu de la biomasse. Thèse de doctorat, Univ. de Technologie de Compiègne, France, pp. 29-32.
- NKO’O A.M.C., J. AVOM, R. MPON, J.M. KETCHA et B.J.P. BELIBI (2013). Valorization of a Cameroonian species: Moabi (Baillonella toxisperma Pierre) into activated carbon. Int. J. Curr. Res. Rev., 5 (8), 1-10.
- PORQUET C. (1999). Élaboration des charbons actifs magnétisables. Thèse de doctorat, Univ. de Technologie de Compiègne, France, 24 p.
- RIVET P. (1989). Traitement et valorisation des eaux résiduaires dans l’industrie textile. L’Eau, L’Industrie, Les Nuisances, 130, 31-32.
- SFYRAKIS J., A.J. FALIAGAS et J. SIMITZIS (1995). Influence of pyrolysis temperature on the adsorptive properties of adsorbents produced from novolac and biomass. J. Appl. Polym. Sci., 55 (13), 1739-1746.
- WEBER W.J., P.M. McGINLEY et L.E. KATZ (1992). A distributed reactivity model for sorption by soils and sediments. Conceptual basis and equilibrium assessments. Environ. Sci. Technol., 26 (10), 1955-1962.
List of figures
Figure 1
Isothermes d’adsorption de l’iode suivant le modèle de Langmuir (charbons de Moabi). Exp : valeurs expérimentales; modL et modF : valeurs obtenues par le modèle de Langmuir et celui de Freundlich
Iodine adsorption isotherms according to the Langmuir model (Moabi activated carbons). Exp: experimental values; modL and modF: values obtained using the Langmuir and Freundlich models
Figure 2
Isothermes d’adsorption de l’iode suivant le modèle de Langmuir (charbons commerciaux). Exp : valeurs expérimentales; modL : valeurs obtenues par le modèle de Langmuir
Iodine adsorption isotherms according to the Langmuir model (commercial activated carbons). Exp: experimental values; modL: values obtained using the Langmuir model
Figure 3
Isothermes d’adsorption de l’iode suivant le modèle de Freundlich (charbons de Moabi). Exp : valeurs expérimentales; modF : valeurs obtenues par le modèle de Freundlich
Iodine adsorption isotherms according to the Freundlich model (Moabi activated carbons). Exp: experimental values; modF: values obtained using the Freundlich model
Figure 4
Isothermes d’adsorption de l’iode suivant le modèle de Freundlich (charbons commerciaux). Exp : valeurs expérimentales; modF : valeurs obtenues par le modèle de Freundlich
Iodine adsorption isotherms according to the Freundlich model (commercial activated carbons). Exp: experimental values; modF: values obtained using the Freundlich model
List of tables
Tableau 1
Échantillons des charbons de résidus de Moabi
Samples of activated carbons from Moabi residue
Tableau 2
Échantillons des charbons actifs commerciaux
Samples of commercial activated carbons
Tableau 3
Résultats relatifs à l’isotherme d’adsorption de l’iode
Adsorption isotherm results for iodine
Qo : quantité de soluté nécessaire pour recouvrir la surface de l’adsorbant d’une monocouche de molécules adsorbées ; KL : constante caractéristique du couple adsorbant-adsorbat; SL : surface spécifique de l'adsorbant
n : constante permettant de décrire l'isotherme d'adsorption; KF : constante caractéristique du couple adsorbant-adsorbat
Tableau 4
Résultats expérimentaux des charbons de résidus de Moabi
Experimental results for the Moabi residue activated carbons
Tableau 5
Résultats expérimentaux des charbons commerciaux
Experimental results for the commercial activated carbons