Corps de l’article
HTLV (pour human T-cell leukemia virus) est le premier rétrovirus identifié chez l’homme [1]. Depuis, deux types, HTLV-1 et 2 ont été identifiés. On estime à plus de 20millions le nombre de personnes infectées par les HTLV dans le monde, avec des foyers endémiques de forte prévalence sur tous les continents en dehors des populations caucasoïdes chez lesquelles les infections restent sporadiques. HTLV se transmet par voie sanguine et sexuelle et, semble-t-il plus communément, de la mère à l’enfant au cours de l’allaitement. Deux maladies sont associées à HTLV-1: le lymphome à cellules T de l’adulte (ATL) et la paraparésie spastique tropicale appelée aussi myélopathie associée au HTLV (TSP/HAM) [2]. Moins de 5% des personnes séropositives pour HTLV-1 développent une ATL, généralement plusieurs décennies après l’infection, et moins de 1 % développent une TSP/HAM. D’autres syndromes sont également associés aux HTLV. Les mécanismes sous-jacents de ces effets pathogènes ne sont pas encore élucidés.
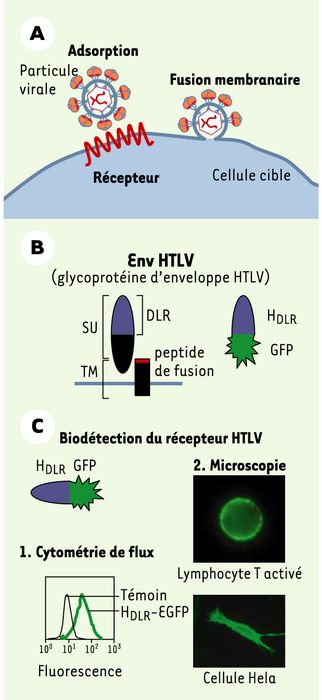
Comme tous les rétrovirus, HTLV s’adsorbe à la surface de la cellule cible puis le contenu nucléoprotéique viral est introduit dans le cytoplasme après la fusion des membranes virale et cellulaire (Figure 1A). Cette fusion se produit après interaction de la glycoprotéine virale d’envoloppe (Env) avec des composants membranaires cellulaires faisant office de récepteurs. Chaque molécule d’Env comprend deux sous-unités issues du clivage d’une seule protéine précurseur: la sous-unité de surface (SU) entièrement extracellulaire et la sous-unité d’ancrage transmembranaire TM (Figure1B). L’in-teraction Env/récepteur est accompagnée de changements conformationnels qui entraînent le démasquage du peptide de fusion de la TM et son ancrage dans la membrane plasmique de la cellule cible. Si l’organisation modulaire de nombreuses Env rétrovirales et l’identité de certains récepteurs ont été élucidées, les régions de l’Env du HTLV qui interagissent avec la cellule cible et la nature des récepteurs cellulaires restaient mystérieuses. Cette ignorance est en partie due à l’expression ubiquitaire du récepteur HTLV sur toutes les cellules de mammifères en culture; à la faible efficacité des infections HTLV réalisées à partir de préparations virales acellulaires, la transmission semblant nécessiter un contact direct entre cellule infectée et cellule cible; enfin, la production d’une Env entière est cytotoxique empêchant toute étude cytologique appropriée.
Figure1
Infection cellulaire par HTLV.
A. Les premières étapes d’une infection rétrovirale. La glycoprotéine d’Env est responsable de l’interaction avec un récepteur à la surface cellulaire (étape d’adsorption), conduisant à la fusion des membranes et à l’infection virale. B. Organisation des glycoprotéines d’enveloppe du HTLV. Les glycoprotéines d’enveloppe (Env) sont constituées d’une sous-unité de surface totalement extracellulaire (SU) qui contient le domaine de liaison au récepteur (DLR) et d’une sous-unité TM d’ancrage transmembranaire qui porte le peptide inducteur de la fusion des membranes. C. Utilisation du HDLR comme marqueur du récepteur HTLV. Le DLR de HTLV, fusionné par exemple à la protéine fluorescente GFP (green fluorescent protein), sert d’outil comme marqueur du récepteur HTLV par cytométrie de flux ou par microscopie. DLR: domaine de liaison au récepteur.
En comparant les séquences primaires des Env des virus leucémogènes murins (MLV), de type simple, avec celles des HTLV, de type complexe (voirEncadré), nous avons mis en évidence des homologies inattendues au niveau de leurs SU [3, 4]. Sur la base de ces homologies, et sachant que le domaine de liaison au récepteur (DLR) de l’Env MLV avait été localisé précisément dans la partie amino-terminale de la SU [5], nous avons réussi à dériver des Env chimères HTLV/MLV fonctionnelles, capables de reconnaître le récepteur HTLV [3]. Celles-ci nous ont permis de délimiter et de produire un module de 159 acides aminés amino-terminaux de la SU de HTLV (HDLR) et de montrer que ce module est nécessaire et suffisant pour la liaison au récepteur [6]. Produit sous forme soluble, lié à une étiquette fluorescente (Figure 1B), ce domaine de liaison au récepteur de l’Env HTLV n’est pas cytotoxique, nous offrant ainsi un outil de choix pour évaluer l’expression du récepteur du HTLV par cytométrie de flux ou par microscopie (Figure 1C).
Récepteur HTLV, activation lymphocytaire et dissémination virale in vivo
L’action pathogène principale de HTLV-1 étant une ATL, nous avons évalué l’expression du récepteur HTLV à la surface des lymphocytes T. De façon inattendue, nous avons observé que les cellules T fraîchement isolées de donneurs sains, qui sont en phase G0 du cycle cellulaire, n’expriment pas le récepteur HTLV. Au contraire, les cellules T activées par un antigène ou in vitro par des anticorps dirigés contre le TCR (récepteur des lymphocytes T), expriment de façon transitoire le récepteur HTLV à leur surface, démontrant que l’expression de ce récepteur dépend directement de l’état d’activation des cellules T [7]. Après leur infection par HTLV, et leur retour en quiescence, les lymphocytes peuvent constituer un réservoir in vivo du virus, compte tenu de leur très longue durée de vie (>20 ans). Ces données nous permettent également de spéculer que la transmission du HTLV puisse avoir lieu essentiellement dans les endroits où résident les cellules activées, c’est-à-dire les sites inflammatoires et les organes lymphoïdes secondaires.
Les modalités de la transmission préférentielle mère-enfant du HTLV ne sont pas connues. Or les lymphocytes T présents dans le sang de cordon, récents émigrants du thymus, présentent des caractéristiques d’activation distinctes de celles des cellules T périphériques de l’adulte. Une fois activées par l’IL-7, ces cellules, contrairement aux lymphocytes T de l’adulte [8, 9], expriment le récepteur HTLV, les rendant ainsi théoriquement susceptibles à l’infection par HTLV [7]. Cette sensibilité à l’IL-7 des cellules T naïves pourrait ainsi expliquer la transmission préférentielle du virus HTLV de la mère infectée à l’enfant, même en l’absence de stimulation antigénique.
Identification du récepteur HTLV et impact sur le métabolisme cellulaire
La majorité des récepteurs rétroviraux furent identifiés au cours des vingt dernières années par une stratégie de clonage d’expression qui n’était pas envisageable dans le cas du récepteur HTLV car toutes les lignées cellulaires cultivées in vitro présentent ce récepteur à leur surface.
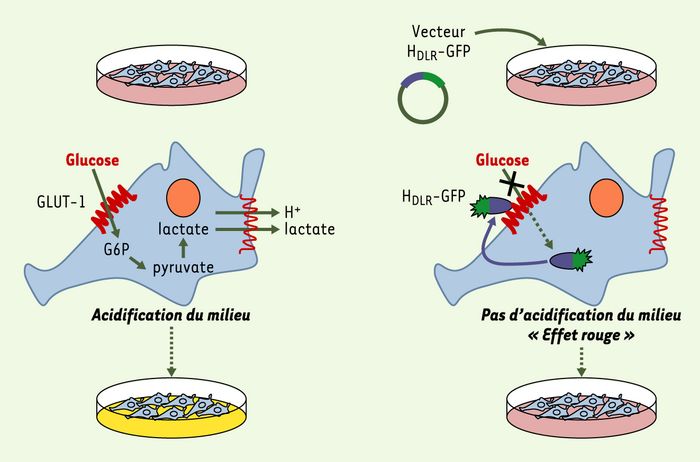
Tous les récepteurs des Env des différentes classes de MLV déjà identifiés ainsi que ceux des Env de rétrovirus apparentés de mammifères font partie de la superfamille des transporteurs de métabolites à plusieurs domaines transmembranaires [10]. Ainsi, ont été identifiés comme récepteurs deux transporteurs de phosphate inorganique, les transporteurs d’acides aminés cationiques et d’acides aminés neutres, ainsi que le transporteur du myo-inositol. L’homologie observée entre les SU des Env MLV et HTLV nous a conduits à émettre l’hypothèse selon laquelle le récepteur HTLV pourrait lui aussi être un membre de cette superfamille de transporteurs. Les cultures in vitro de cellules de vertébrés s’accompagnent généralement d’un changement de couleur du milieu de culture dû à une acidification révélée par l’indicateur colorimétrique rouge phénol; de couleur rouge, il vire au jaune pour un pH inférieur à 6,2 et au rouge pourpre pour un pH supérieur à 8. Au cours de nos travaux, nous avons remarqué que l’expression de Env bloquait ce changement de couleur. L’expression du HDLR suffisait à produire cet effet, qui était abrogé par l’expression de HDLR mutants incapables de lier le récepteur HTLV. L’acidification des milieux de culture est majoritairement due à la sécrétion par les cellules de protons et de lactate. Ce dernier, catabolite de la glycolyse anaérobie, provient de la consommation de glucose à partir du milieu extracellulaire. Or l’absence d’acidification en présence de Env était corrélée à un blocage du transport de glucose depuis le milieu extracellulaire vers l’intérieur de la cellule (Figure 2).
Figure 2
Blocage du transport du glucose via le transporteur ubiquitaire GLUT-1, par le DLR du HTLV.
Les cellules de vertébrés en culture fermentent le glucose extracellulaire en lactate, ce qui conduit à une acidification du milieu de culture (jaune). Lorsque le HDLR est exprimé dans ces cellules, l’import du glucose facilité par GLUT-1 est bloqué entraînant une chute de la fermentation, de la production du lactate et de l’acidification du milieu extracellulaire qui reste rougeâtre. DLR: domaine de liaison au récepteur.
Le transporteur de glucose ubiquitaire des lignées cellulaires est GLUT-1 (glucose transporter 1). Parmi les 13 membres de la superfamille des GLUT, il est le seul à partager in vivo les caractéristiques d’expression du récepteur HTLV, en particulier il est indétectable sur les cellules T au repos et fortement exprimé au cours de l’activation. Par des mesures de cytométrie de flux et par co-immunoprécipitation nous avons montré que GLUT-1 interagit avec le HDLR. Afin d’évaluer le rôle de GLUT-1 dans l’infection par HTLV, nous avons développé trois systèmes expérimentaux: blocage de GLUT-1 par la cytochalasine B, un inhibiteur du transport du glucose; blocage du récepteur HTLV après introduction d’une Env, et levée de ce blocage par introduction de l’ADNc codant pour GLUT-1 [11]; inhibition spécifique de l’expression de GLUT-1 à l’aide d’ARN interférent (ARNi). L’ensemble de ces différents tests nous ont permis de conclure que GLUT-1 est capable de relayer une infection rétrovirale via l’Env du HTLV [12].
GLUT-1 est donc un nouveau membre de la famille des transporteurs de métabolites qui sert de récepteur pour un rétrovirus. Par extension, il devient tentant de considérer les rétrovirus comme une réelle source de métabolites pour la cellule. Cependant, il n’existe encore pas d’explication formelle démontrant que les récepteurs rétroviraux ont été sélectionnés sur la base de leur fonction de transporteur. Notamment, il est possible qu’une propriété commune aux transporteurs de métabolites, mais indépendante de la fonction de transport per se, ait été sélectionnée: localisation, environnement lipidique, trafic vésiculaire [4, 6, 13]. Au-delà de l’interaction Env/récepteur, nos résultats suggèrent que l’environnement métabolique des cellules cibles conditionne fortement le cycle de réplication des rétrovirus.
Parties annexes
Références
- 1. Poiesz BJ, Ruscetti FW, Gazdar AF, et al. Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proc Natl Acad Sci USA 1980; 77 : 7415-9.
- 2. Gessain A, de Thé G. Virus HTLV-I, leucémies T de l’adulte et neuromyélopathies chroniques. Med Sci (Paris) 1987; 3: 471-8.
- 3. Kim FJ, Seiliez I, Denesvre C, et al. Definition of an amino-terminal domain of the human T-cell leukemia virus type 1 envelope surface unit that extends the fusogenic range of an ecotropic murine leukemia virus. J Biol Chem 2000; 275: 23417-20.
- 4. Kim FJ, Manel N, Battini JL, Sitbon M. Emergence of vertebrate retroviruses and envelope capture. Virology 2004;318: 183-91.
- 5. Battini JL, Danos O, Heard JM. Receptor-binding domain of murine leukemia virus envelope glycoproteins. J Virol 1995; 69: 713-9.
- 6. Kim FJ, Manel N, Battini JL, Sitbon M.La capture d’enveloppe par les rétrovirus.Med Sci (Paris) 2004 (sous presse).
- 7. Manel N, Kinet S, Battini JL, et al. The HTLV receptor is an early T-cell activation marker whose expression requires de novo protein synthesis. Blood 2003; 101: 1913-8.
- 8. Dardalhon, V, Jaleco S, Kinet S, et al. IL-7 differentially regulates cell cycle progression and HIV-1-based vector infection in neonatal and adult CD4+ T cells. Proc Natl Acad Sci USA 2001; 98: 9277-82.
- 9. Hassan J, Reen DJ. Human recent thymic emigrants-identification, expansion, and survival characteristics. J Immunol 2001; 167: 1970-6.
- 10. Heard JM, Rodrigues P, Salaün C. Une collaboration étroite et efficace: les enveloppes rétrovirales et leurs récepteurs cellulaires. Med Sci (Paris) 2002; 15: 994-8.
- 11. Corbin A, Sitbon M. Interférence à la surinfection: un mécanisme non immunitaire de vaccination contre les maladies rétrovirales. Med Sci (Paris) 1993; 9: 967-70.
- 12. Manel N, Kim FJ, Kinet S, et al. The ubiquitous glucose transporter GLUT-1 is a receptor for HTLV. Cell 2003; 115: 449-59.
- 13. Basyuk E, Galli T, Mougel G, et al. Retroviral genomic RNAs are transported to the plasma membrane by endosomal vesicles. Dev Cell 2003; 5: 161-74.
Liste des figures
Figure1
Infection cellulaire par HTLV.
A. Les premières étapes d’une infection rétrovirale. La glycoprotéine d’Env est responsable de l’interaction avec un récepteur à la surface cellulaire (étape d’adsorption), conduisant à la fusion des membranes et à l’infection virale. B. Organisation des glycoprotéines d’enveloppe du HTLV. Les glycoprotéines d’enveloppe (Env) sont constituées d’une sous-unité de surface totalement extracellulaire (SU) qui contient le domaine de liaison au récepteur (DLR) et d’une sous-unité TM d’ancrage transmembranaire qui porte le peptide inducteur de la fusion des membranes. C. Utilisation du HDLR comme marqueur du récepteur HTLV. Le DLR de HTLV, fusionné par exemple à la protéine fluorescente GFP (green fluorescent protein), sert d’outil comme marqueur du récepteur HTLV par cytométrie de flux ou par microscopie. DLR: domaine de liaison au récepteur.
Figure 2
Blocage du transport du glucose via le transporteur ubiquitaire GLUT-1, par le DLR du HTLV.
Les cellules de vertébrés en culture fermentent le glucose extracellulaire en lactate, ce qui conduit à une acidification du milieu de culture (jaune). Lorsque le HDLR est exprimé dans ces cellules, l’import du glucose facilité par GLUT-1 est bloqué entraînant une chute de la fermentation, de la production du lactate et de l’acidification du milieu extracellulaire qui reste rougeâtre. DLR: domaine de liaison au récepteur.