Résumés
Résumé
Cette étude présente une stratégie antibiofilm appliquée à une membrane de dialyse, l’AN69; il s’agit de réaliser une modification initiale de la surface de la membrane par un polyélectrolyte cationique, le poly(diallyldiméthyl-ammonium), noté PDADMA, selon un protocole de type « layer-by-layer ». Les caractéristiques physico-chimiques des deux membranes, l’AN69 et l’AN69 modifiée par le PDADMA, sont suivies par la détermination de la modification de la charge de la membrane en mettant en oeuvre des mesures de potentiels d’écoulement et de nombres de transports de Li+, de perméabilité hydraulique et des analyses morphologiques et topographiques effectuées par les microscopies électroniques à balayage et à force atomique, respectivement avant et après exposition à E. coli et à un biofilm marin. Nos résultats montrent tout d’abord un rôle majeur joué par l’attraction électrostatique entre les microorganismes et l’AN69 modifiée par le PDADMA à l’origine d’une adhésion forte des bactéries.
Par ailleurs, nous avons mis au point un protocole original d’élimination du biofilm marin. Ce protocole consiste à immerger la membrane modifiée par le PDADMA et encrassée, dans une solution de chlorure de sodium 2M afin d’écranter les charges électrostatiques à l’origine de l’accroche du polyélectrolyte et permettre le décrochage du PDADMA qui entraîne avec lui l’encrassement (constitué de bactéries et autres résidus de biofilm). La recharge d’un film frais de PDADMA permet alors une réutilisation à l’infini de la membrane AN69. La simplicité de ce protocole « de régénération » ouvre la possibilité d’une modification non permanente des membranes de dialyse, dans le but de limiter les problèmes récurrents de biocolmatage et d’augmenter les durées de vie des membranes en milieu marin.
Mots clés:
- revêtement antibiofilm,
- poly(diallyldiméthyl-ammonium),
- membrane de dialyse AN69,
- Escherichia coli,
- bio-colmatage marin
Abstract
The harmful effects generated by biofilms have an extremely high cost. In this study, we were interested in the formation of marine biofilms forming on the wellknown anionic dialysis membrane AN69 used in the reduction of seawater salinity for the preparation of body-washing solutions. We focused our study on two membranes: AN69 and AN69 modified (denoted AN69 mod) by the sorption of poly(diallyldimethyl-ammonium), a cationic polyelectrolyte denoted by PDADMA. Physico-chemical characteristics (membrane charge from Li+ transport and streaming potential measurements, water flux from hydraulic permeability measurements and morphological/topographical measurements using SEM and AFM, respectively) were monitered during the exposure of both membranes to E. coli and natural marine biofouling solutions. Our results showed that the modification of the AN69 membrane by PDADMA its charge and increased its electrostatic affinity for bacteria. Electrostatics forces are, therefore, the main forces responsible for membrane biofouling. Furthermore we developed a simple antibiofilm protocol based on a one-step dipping operation applied to the fouled AN69 membrane which eliminates the PDADMA and associated bacteria. For the first time, all deposited marine bacteria were easily eliminated allowing for the regeneration and sustainable use of the AN69 membrane.
Key words:
- dialysis membrane AN69,
- antifouling coating,
- poly(diallyldimethylammonium),
- Escherichia coli,
- marine biofouling
Corps de l’article
1. Introduction
Il a été montré récemment par PONTIE et al. (2005) que la sélectivité d’une membrane de dialyse en poly(acrylonitrile- co‑methallyl sulfonate), plus communément appelée AN69, vis-à-vis des ions Mg2+ et K+, pouvait être modifiée par inversion de sa charge de surface en imprégnant la membrane par un polyélectrolyte cationique, le chlorure de poly(diallyldiméthyl-ammonium), (PDADMA). Avant le développement industriel de ce procédé de dialyse pour les préparations d’eaux de mer, nous souhaitions étudier l’affinité de ces deux membranes, l’AN69 et l’ AN69 mod vis-à-vis de la bactérie Escherichia coli (E. coli) et d’un biofilm marin naturel. En particulier, ce travail participe à l’amélioration de l’adaptabilité au milieu d’étude de membranes synthétiques organiques soumises à une colonisation bactérienne (biofouling). Les modifications physico-chimiques de ces deux membranes en présence de E. coli et de l’eau de l’océan atlantique, prise en Bretagne (France), ont été suivies par différents outils d’analyses physico-chimiques : (i) les modifications des charges de surface sont évaluées par les variations du nombre de transports de l’ion Li+ (tLi+) et des mesures de potentiel d’écoulement, (ii) les modifications des propriétés de perméation à l’eau par des mesures de perméabilité hydraulique et (iii) les modifications morphologique et topographique par les microscopies électroniques à balayage (MEB) et à force atomique (AFM), respectivement.
2. Matériel et méthodes
2.1 Membranes étudiées
La membrane utilisée est une membrane symétrique élaborée au laboratoire des polymères, biopolymères et membranes de l’Université de Rouen (UMR CNRS N° 6522), de dénomination AN69. Il s’agit d’un copolymère de poly(acrylonitrile-co-methallyl sulfonate) de charge globale négative car possédant des groupements ‑SO3-. Cette membrane d’ultrafiltration possède un seuil de coupure d’environ 20 kDa, d’après NGUYEN et al. (2004).
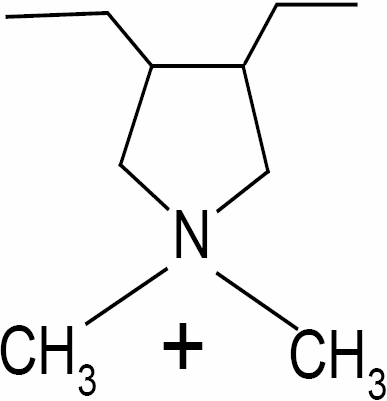
Le chlorure de poly(diallyldiméthylammonium) (Figure 1) est employé pour modifier la membrane AN69. Il s’agit d’un polyélectrolyte cationique qui possède une masse molaire moyenne de 400 kDa. Lorsqu’il est employé pour l’imprégnation de l’AN69, il est dilué 250 fois dans une solution aqueuse de NaCl à 0,5 mol•L‑1. Avant leur utilisation, les membranes subissent une étape de déconditionnement. Cette étape consiste à éliminer leur principal produit de conditionnement, la glycérine. Pour réaliser cela, chaque membrane est immergée dans de l’eau ultra-pure (EUP) (eau milliQ, (Millipore, France), de pH = 5,8 et de conductivité 1 µS/cm), pendant 12 h, puis stockée au réfrigérateur dans du bisulfite de sodium. Avant leur utilisation, elles sont rincées abondamment à l’EUP pour éliminer toutes traces de bisulfite de sodium, qui est un antibactérien.
Figure 1
Formule chimique du monomère de PDADMA.
Chemical formula of PDADMA monomer.
2.2 Principe de la modification de la membrane par le PDADMA
L’adsorption du PDADMA sur l’AN69 se fait par simple trempage de la membrane dans la solution du polyélectrolyte de PDADMA. Cette méthode de modification est très facile à mettre en oeuvre, elle a été proposée récemment par NGUYEN et al. (2004). Il s’agit de remplacer les contre-ions de la membrane vierge chargée négativement par un poly-électrolyte cationique. Ce dernier se fixe par simple affinité électrostatique. Dans le même temps, les contre-ions sont éliminés et le PDADMA se déforme avant de subir un confinement qui garantit son accrochage durable sur la membrane jusqu’à des forces ioniques de 1 M. D’autres protocoles de modification de l’AN69 de type « layer-by-layer » ont été rapportés par THOMAS et al. (2000) afin notamment d’améliorer la biocompatibilité de ce matériau, constituant essentiel des reins artificiels employés lors des opérations d’haemodialyse.
2.3 Souche bactérienne
La souche utilisée dans cette étude est une souche de E. coli (K12 5947) gracieusement fournie par l’INRA d’Angers (France). Comme la plupart des bactéries, E. coli est chargée négativement. Ses dimensions sont de 2 à 3 µm x 0,7 µm.
2.4 Milieux de culture et solution bactérienne
E. coli a été cultivée sur milieu Tryptone Soy Agar (Biokar, Beauvais, France) et incubée à 37 °C. Les essais de colonisation des membranes ont été réalisés en milieu Tryptone sel (Biokar, France). Ce milieu a été choisi car il permet la survie des bactéries tout en limitant leur croissance.
2.5 Solutions et produits
Au cours de toutes les manipulations réalisées, l’EUP utilisée est autoclavée. Les solutions de chlorure de sodium, de chlorure de potassium et de chlorure de lithium sont préparées à partir de leurs sels (pris de qualité pour analyse et fournis par Sigma-Aldrich, France) à partir de l’EUP. Ces solutions sont également autoclavées. L’eau de mer employée est une eau du littoral breton, prise au niveau de Brest (lieu-dit Le Dellec). Elle est utilisée telle que prélevée le 7 mai 2005.
2.6 Protocole d’immersion
Les membranes exposées à E. coli sont préalablement découpées en morceaux de 2 à 3 cm de côté; elles sont ensuite immergées dans 30 mL de milieu Tryptone sel ensemencé à une concentration de 109 bactéries/mL. Elles ont été maintenues au contact des bactéries pendant 24 h à température ambiante. Après 24 h de mise en contact sous agitation modérée, les membranes ont été rincées dans de l’EUP stérile afin d’éliminer les bactéries n’ayant pas adhéré au support, selon le protocole décrit par RUBIO (2002). Concernant les membranes exposées à l’eau de mer, elles sont également découpées en morceaux de 2 à 3 cm de côté, puis laissées en contact avec l’eau de mer à la température ambiante; l’eau de mer est renouvelée tous les deux jours par perfusion afin d’éviter toute perturbation hydrodynamique.
2.7 Outils analytiques
2.7.1 Les analyses MEB
L’appareillage MEB utilisé est un microscope électronique avec émission à effet de champs (JSM-6301F JEOL France) utilisé au Service Commun d’Imageries et de Microanalyses de l’université d’Angers (SCIAM). Les images ont été obtenues à l’aide des électrons secondaires sous une tension d’accélération de 3 kV et à des grossissements variant de 2 000 à 10 000. Les membranes ont été déshydratées dans un dessiccateur afin d’éliminer toute trace résiduelle d’eau, puis l’échantillon est fixé sur un plot en aluminium à l’aide d’un scotch carbone double face et rendu conducteur par dépôt d’une couche de carbone (évaporation sous vide : BAL-TEC MED 020 Balzers Lichentstein). Ce protocole est employé pour tous les échantillons analysés au MEB.
2.7.2 Les analyses AFM
Le microscope à force atomique utilisé est un thermomicroscope autoprobe CP-research (Veeco, Dourdan, France). Tous les échantillons ont été analysés en mode contact avec des leviers ULCT‑AUMT‑AB (pointe en nitrure de silicium), une vitesse de balayage de 1 Hz et une force d’appui de 10 nN. L’analyse topographique des images a consisté à déterminer la rugosité moyenne (notée Ra) des surfaces de membranes au cours des différentes modifications. Le traitement des images est effectué avec le logiciel SPMLab602 de VEECO, licence GAP (Angers, France). La rugosité moyenne obtenue par l’analyse des images AFM est calculée par la relation (1) :
avec Lx et Ly : dimensions de la surface considérée, z(x,y) : hauteur de la surface par rapport au plan moyen au point (x, y).
Les principes des mesures ayant permis de déterminer tLi+, le potentiel d’écoulement (PE) et la perméabilité hydraulique des membranes étudiées sont comme expliqués par la suite.
2.7.3 La détermination du nombre de transport de Li+
Lorsqu’une membrane établit une jonction entre deux solutions ioniques à des concentrations différentes, les ions diffusent de la solution la plus concentrée vers la solution la plus diluée à travers la membrane. La diffusion des ions à travers la membrane crée un potentiel de membrane que l’on peut mesurer en employant des électrodes impolarisables (électrodes au calomel saturée, ECS). Cette mesure permet de calculer le nombre de transports des ions et d’en déduire la densité de charge de surface de la membrane (11). Nous rappelons que le nombre de transport ti de l’espèce i dans une solution homogène est la fraction du courant total transportée par cette espèce.
À pression et température constantes, il existe une différence de potentiel de membrane notée ∆Φ qui est la somme d’un potentiel de diffusion provoqué par le gradient de concentration de l’électrolyte et d’un potentiel de Donnan de chaque interface membrane/solution dû aux co-ions exclus de la membrane. En l’absence de potentiel de Donnan, en considérant comme constants le coefficient d’activité des ions et leur nombre de transports dans la membrane, le potentiel de diffusion pour deux solutions à des concentrations différentes C1 et C2 (C1 > C2), s’exprime par :
On mesure ∆Φ à une concentration fixe en C2 en faisant varier C1. L’évolution de ∆Φ en fonction de ln(C1/C2) donne une droite dont la pente permet de calculer le nombre de transports de l’ion Li+ (t+Li+) et donc également celui de son contre-ion Cl- (avec t+Li+ + t+Cl- = 1). On rappelle les données numériques suivantes : R = 8,314 J.K-1, T = 295 K et F = 96 500 C/mol.
2.7.4 Mesures de perméabilité hydraulique
La perméabilité transmembranaire permet de visualiser l’évolution du flux de solvant J (en m•s-1) en fonction de la pression transmembranaire ∆P en Pa, conformément à la loi de Hagen-Poiseuille, valable pour un régime d’écoulement laminaire, au travers d’un milieu poreux et énoncée comme suit :
avec µ étant la viscosité dynamique de la solution en Pa•s, R la résistance de la membrane au transfert de matière en m‑1, L l’épaisseur de la couche active en m et d le diamètre moyen des pores en m.
Expérimentalement la perméabilité hydraulique, Lp, est obtenue par la mesure du débit transmembranaire (en L•m‑2•h‑1) en fonction de la variation de pression ∆P (en bar). Ce paramètre est évalué à partir d’une eau ultrapure, de conductivité inférieure à 1 µS•cm‑1, de pH 5,6 et à une température de 20 °C. Lors de ces mesures, nous avons suivi les instructions données par la norme AFNOR.
2.7.5 Mesures de potentiel d’écoulement
La relation d’Helmholtz-Smoluchovsky énoncée ci-dessous met en évidence la proportionnalité existant entre la variation de pression transmembranaire appliquée (∆P) et la différence de potentiel résultante (∆Φ) :
avec ε la constante diélectrique du solvant, µ sa viscosité dynamique en Pa•s, χ la conductivité de la solution d’électrolyte en µS•cm‑1 et ζ le potentiel zéta du matériau de filtration en V. De la mesure des variations de la différence de potentiel entre deux électrodes Ag/AgCl avec la pression transmembranaire, il est possible de suivre les modifications de l’état de charge de la surface des pores membranaires car la différence de potentiel mesurée par unité de pression (défini dans la suite de l’article comme le potentiel d’écoulement) est directement proportionnelle au potentiel zétâ du matériau de filtration d’après l’équation 4.
La cellule Amicon employée pour l’ensemble de ces mesures, comme rapportée récemment par PONTIE et al. (2005), permet de travailler avec une surface de membrane de 1,35 cm2.
3. Résultats et discussions
3. 1 Modification de la membrane AN69 par le PDADMA
Des images MEB et AFM de la membrane AN69 sont rapportées sur les figures 2a et 2b. L’image de la figure 2b permet de déterminer une valeur de Ra, de 200 ± 50 nm. Après imprégnation 18 h dans la solution de PDADMA, le Ra obtenue pour la membrane AN69 mod est légèrement plus faible (140 ± 50 nm). La couche de PDADMA déposée sur l’AN69 n’est pas visible compte tenu de sa faible épaisseur (de l’ordre de quelques nm) mais elle semble jouer un rôle de lissage de la surface. Toutefois, dans les deux cas, les fortes rugosités observées pourraient influer notablement sur l’accrochage physique des bactéries, ainsi que rapporté par HILAL et al. (2003 et 2004). Les autres propriétés des membranes AN69 et AN69 mod sont résumées dans les tableaux 1 et 2.
3. 2 Caractérisations des membranes AN69 et AN69 mod sans et avec E. coli
3. 2. 1. Nombre de transports, perméabilités hydrauliques et potentiels d’écoulement
Le tableau 1 regroupe les résultats de nombre de transports tLi+, de potentiel d’écoulement (PE) et de perméabilité hydraulique, avant et après modification de la surface des membranes par E. coli. En présence de PDADMA, la membrane AN69 mod montre une perméabilité hydraulique plus faible de 52 % par rapport à l’AN69, probablement due à une obstruction des pores.
Figure 2
a) Image 2D (grossissement x5000); b) Image 3D de l’AN69 obtenue en mode contact par l’AFM.
a) 2D image of AN69 (zoom x5000; b) 3D image of AN69 obtained in contact mode.
(a)
(b)
Tableau 1
Récapitulatif des résultats de nombres de transports de Li+, de perméabilités hydrauliques et de potentiels d’écoulement, pour l’AN69 vierge et modifiée, en présence et en l’absence de E. coli.
Physico-chemical properties of cleaned and modified AN69 in the presence and absence of E. coli.
Membrane |
Perméabilité hydraulique (L•m‑2•h‑1•bar‑1) (± 0,1) |
Nombre de transports tLi+* (± 0,02) |
Potentiel d’écoulement (mV/bar) (± 0,2) |
|---|---|---|---|
AN69 |
0,94 |
0,75 |
‑2,3 |
AN69 mod. |
0,45 |
0,40 |
+2,2 |
AN69 – E.coli |
0,42 |
nd |
‑3,3 |
AN69 mod – E.coli |
0,31 |
nd |
0,5 |
Tableau 2
Dénombrement des bactéries (bactéries/mm2) sur les membranes étudiées.
Bacterial counts on the studied membranes.
Membranes |
Bactéries /mm2 |
|---|---|
AN69 |
306 ± 177 |
AN69 mod |
798 ± 279 |
La présence de E. coli provoque une diminution plus importante de ce paramètre tant sur la membrane AN69 que sur la AN69 mod. Les bactéries restent en surface des membranes et ne s’insèrent pas dans les pores en raison de leur taille importante (> 1 µm) comparativement à celle des pores (diamètre moyen des pores < 5 nm). Toutefois, si les dimensions des bactéries (2 à 3 µm x 0,7 µm) ne leur permettent pas physiquement de traverser les membranes, les résultats du tableau 2 montrent qu’elles peuvent, malgré tout, pénétrer dans leurs anfractuosités, en raison probablement des rugosités de surface importantes des membranes étudiées.
Par ailleurs, le nombre de transport de Li+ (tLi+) diminue en passant de la membrane vierge à la membrane modifiée. Cette diminution est due à la fois aux effets stériques liés à la diminution de la taille des pores mais aussi aux interactions électrostatiques répulsives entre l’AN69m et l’ion Li+. Enfin, le rôle de l’hydratation peut également intervenir notablement sur le transport de l’ion Li+ car si c’est le cation monovalent le plus petit en matière de rayon ionique, c’est aussi le cation le plus hydraté et donc celui qui possède le rayon hydraté le plus grand.
De plus, les résultats de PE sont intéressants car ils nous renseignent sur les modifications internes des charges de ces membranes. Il s’agit en effet d’une grandeur physico-chimique représentative de l’état de charge des pores des membranes poreuses. L’inversion du signe de la charge membranaire est également visualisable par les résultats de PE comme rapportés dans le tableau 1. Ainsi ces résultats montrent que la modification par le PDADMA se fait en profondeur. En effet, l’imprégnation de la membrane AN69 par le polyélectrolyte cationique PDADMA change le signe de la charge membranaire qui est initialement négative (-2,3 mV/bar) et devient positive (+2,2 mV/bar) après imprégnation. Enfin, la relative symétrie des valeurs de PE des membranes AN69 et AN69 mod nous permet de constater que tous les sites négatifs de l’AN69 ont été occupés par la chaîne du polyélectrolyte de PDADMA. Toutefois, l’inversion presque symétrique de cette charge pourrait être attribuée à un échange de type 1-2, c’est‑à‑dire une charge fournie par la membrane pour deux charges apportées par le PDADMA.
Enfin, il est aussi possible de remarquer dans le tableau 1 une légère diminution du PE de +2,2 mV/bar à +0,5 mV/bar lors de la mise en présence de l’AN69 mod avec E. coli. Cela montre que, malgré sa taille, E. coli peut pénétrer dans les anfractuosités de la membrane AN69 mod et écranter partiellement sa charge positive. Dans ce cas, même si la situation est répulsive, la rugosité peut apporter une explication quant à l’accrochage physique qui peut l’emporter sur la répulsion électrostatique.
3.2.2 Comptage des E. coli par microscopie électronique à balayage
Des dénombrements d’E. coli sur les deux membranes étudiées ont été réalisés au MEB. Chaque dénombrement correspond au résultat moyen de trois essais effectués pour chaque membrane (à raison de cinq champs par essai, au grossissement de x2000).
Comme illustré sur les figures 3a et 3b, et dans le tableau 2, les dénombrements montrent une nette différence entre les membranes AN69 et AN69 mod. Sur les trois essais effectués, la membrane AN69 mod présente plus de bactéries (Figure 3b) que la membrane vierge (Figure 3a).
Il est possible d’expliquer ces différences d’affinité entre les membranes et les bactéries E. coli par leurs différences de charge. En effet, globalement E. coli présente une charge négative, comme la plupart des bactéries, même si cette charge peut s’avérer délocalisée d’après des travaux récents (Ganz, 2001), cela induit une plus grande affinité électrostatique de E. coli avec le PDADMA alors que l’intéraction est répulsive avec la membrane anionique AN69.
Outre les effets électrostatiques prépondérants, il est également possible que l’adhérence due aux fortes rugosités des deux membranes intervienne, toutefois dans une moindre mesure.
D’autre part, dans les conditions de l’expérience, le dénombrement moyen des bactéries après 24 h de contact n’a pas dépassé 800 bactéries/mm2 (Tableau 2). Ces résultats indiquent que, dans ces conditions, les bactéries ne sont pas capables de coloniser les deux membranes étudiées jusqu’à la formation d’un biofilm. Ce résultat nous a décidés à travailler directement avec des solutions d’eau de mer, comme rapporté par la suite.
3.3 Mise au point d’un protocole d’élimination d’un biofilm marin
Dans un premier lieu, les membranes AN69 et AN69 mod ont été mises en contact avec l’eau de mer durant une semaine afin d’étudier la formation d’un biofilm naturel sur les surfaces membranaires. Comme illustré sur les figures 4a-b et 4d-f, en présence d’eau de mer, la membrane AN69 mod se couvre de bactéries, algues et autres constituants du milieu marin, et cela d’autant plus que le temps d’exposition est élevé. D’ailleurs, il apparaît nettement que dans ces conditions aussi, comme pour E. coli, l’AN69 mod se recouvre plus rapidement de bactéries que l’AN69 (Figures 4a‑4b et 4d‑4f), ce qui semble confirmer la prédominance des interactions électrostatiques sur les autres types d’interaction non spécifiques susceptibles d’intervenir pour expliquer l’affinité entre les bactéries et les matériaux étudiés.
Figure 3
a) Membrane AN69 en présence de E. coli; b) Membrane AN69 mod en présence de E. coli (grossissement x 2000).
a) AN69 membrane in presence of E. coli; b) AN69 mod membrane in presence of E. coli (magnified 2000x).
(a)
(b)
Figure 4
Images MEB de l’AN69, l’AN69 mod et l’AN69 mod nettoyée après immersion dans de l’eau de mer; temps d’élimination :18 h, grossissements x2000.
MEB images of AN69, AN69 mod and cleaned AN69 mod after immersion in sea water; Elimination time: 18 h., magnified 2000x.
Un protocole simple d’élimination du biofilm naturel a été mis en oeuvre; il consiste à immerger la membrane à traiter dans une solution de chlorure de sodium de concentration 2M. En effet, après rinçage de la membrane AN69 mod encrassée par cette solution, le PDADMA se décroche par simple écrantage des charges impliquées par l’adhésion du polyélectrolyte à la membrane.
Afin d’évaluer l’efficacité du protocole de nettoyage mis au point, il s’avère indispensable d’évaluer les modifications physico-chimiques avant et après élimination du PDADMA pour les comparer à celles de la membrane AN69. Le tableau 3 regroupe des caractéristiques physico-chimiques de la membrane vierge et celles des membranes modifiées par les dépôts de PDADMA et du biofilm naturel avant et après application du protocole décrit ci-dessus.
Les résultats montrent que les membranes modifiées ont récupéré une grande partie des propriétés physico-chimiques de la membrane de référence AN69. En matière de perméabilité hydraulique, la membrane modifiée par le dépôt de PDADMA et mise en contact avec l’eau de mer pendant 3 j a récupéré ~77 % de sa valeur initiale. La membrane modifiée et immergée pendant 6,5 j a récupéré ~72 % de la valeur initiale.
D’autre part, les mesures de PE ont permis de constater que la présence du biofilm n’induisait pas de changement de charges dans les pores. De la même façon, après nettoyage, les membranes modifiées retrouvent la charge de surface négative de l’AN69. Il est important de signaler que la membrane modifiée et immergée pendant 3 j dans l’eau de mer a retrouvé une charge négative après application du protocole de « nettoyage » très proche de celle de la membrane AN69. Ainsi, après application du protocole de rinçage, la charge négative initiale de la membrane AN69 est retrouvée.
L’élimination du PDADMA encrassé entraîne avec lui l’ensemble des bactéries mais également les autres résidus du biofilm déposés sur la membrane, comme illustré sur les figures 4c et 4f. Ensuite il est possible de redéposer sur l’AN69 un film frais de PDADMA puis de redémarrer les opérations de filtration (résultats non présentés).
Ces premiers résultats encourageants montrent la facilité d’enlever un dépôt de PDADMA qui a vieilli et s’est recouvert de bactéries et ouvre la possibilité de le renouveler très régulièrement par un film frais pour une réutilisation à l’infini du support, la membrane AN69.
Cependant, la perméabilité hydraulique reste affectée, de même que les nombres de transports de Li+, ce que l’on peut attribuer à un colmatage en profondeur dû aux résidus de biofilm (protéines, polysaccharides, etc.), comme rapporté récemment par AKTHAKUL et al. (2004) et VIOLLEAU et al. (2005). La mise au point d’un nettoyage plus poussé est en cours de développement à l’échelle du procédé pour l’élaboration de solutions isotoniques et hypertoniques à destination de la santé humaine.
4. Conclusion et perspectives
Dans cette étude, nous nous sommes intéressés à la modification par imprégnation du polyélectrolyte cationique PDADMA de la membrane anionique AN69, dans le but d’améliorer son adaptabilité au milieu en réel et en particulier lorsqu’elle est soumise à une colonisation bactérienne par E. coli et par un biofilm marin.
Tableau 3
Récapitulatif des résultats des nombres de transports tLi+, de PE et de PH pour l’AN69 mod avant et après le nettoyage.
Physico-chemical properties of modified AN69 before and after cleaning.
Membranes |
Nombre de transports tLi+ (± 0,02) |
Potentiel d’écoulement (mV/bar) (± 0,2) |
Perméabilité hydraulique (L•m‑2•h‑1•bar‑1) (± 0,1) |
|---|---|---|---|
N69 |
0,75 |
‑2,3 |
0,94 |
AN69mod |
0,40 |
2,2 |
0,45 |
AN69mod mer 3j |
0,41 |
2,0 |
0,41 |
AN69mod mer 6,5j |
0,43 |
2,5 |
0,38 |
AN69mod (mer 3j) N |
0,52 |
‑2,5 |
0,72 |
AN69mod (mer 6,5j) N |
0,58 |
‑3,1 |
0,68 |
Nous nous sommes focalisés sur ses modifications physico-chimiques avant et après imprégnation, en l’absence et en présence de E. coli et du biofilm marin.
Nos résultats montrent un rôle majeur joué par l’attraction électrostatique entre les microorganismes et l’AN69 modifiée par le PDADMA par comparaison avec l’AN69 non modifiée.
Toutefois, la forte rugosité des surfaces étudiées joue également un rôle non négligeable même si les forces électrostatiques sont prépondérantes.
Par ailleurs, nous avons mis au point un protocole original d’élimination d’un biofilm marin. Ce protocole de nettoyage consiste à immerger la membrane modifiée par le PDADMA et encrassée dans une solution de chlorure de sodium 2M puis à la rincer dans l’eau ultrapure. La simplicité de ce protocole « de nettoyage » ouvre la possibilité d’une modification non permanente des membranes de dialyse, dans le but de limiter les problèmes récurrents de biocolmatage et d’augmenter les durées de vie des membranes en milieu marin.
Parties annexes
Remerciements
Nous remercions l’INRA d’Angers pour la fourniture de E. coli ainsi que le CEMAGREF, et tout particulièrement A.M. Pourcher, pour son assistance lors de la mise au point des protocoles d’ensemencement.
Références bibliographiques
- Afnorn°45-101 (juillet 1996). Filtration des liquides : perméabilité à une eau de référence. ISSN 0335-3931.
- Akthakul A., R. Salinaro, A.M. Mayes (2004). Design of biodegradable amphiphilic polymers: Well-defined amphiphilic polyphosphates with hydrophilic graft chains via ATRP. Macromolec., 37, 7663- 7668.
- Ganz T. (2001). Fatal attraction evaded. How pathogenic bacteria resist cationic polypeptides. J. Exper. Med., 1939, F31-F33.
- Hilal N., l. Al-Khatib, p.b. Atkin, v. Kochkodan et n. Potapchenko (2003). Photochemical modification of membrane surfaces for (bio)fouling reduction: a nano-scale study using AFM. Desalinatn, 158, 65‑72.
- Hilal N., l. Al-Khatib, p.b. Atkin, v. Kochkodan et n. Potapchenko (2004). Surface modified polymeric membranes to reduce (bio)fouling: a microbiological study using E. coli. Desalinatn, 167, 293‑300.
- Nguyen T.Q., k. Glinel, m. Pontié et z. Ping (2004). Immobilization of bio-macromolecules onto membranes via an adsorbed nanolayer: An insight into the mechanism. J. Membr. Sci., 232, 123-132.
- Pontié M., c. Diawara, m. Rumeau, d. Aureau et p. Hemmery (2003). Seawater nanofiltration (NF): Fiction or reality? Desalinatn, 158, 277-280.
- Pontié M., h. Essis-Tomé, a. Elana et t.q. Nguyen (2005). Fabrication and physicochemical characterization of a novel dialysis membrane by adsorption of inverse polyelectrolyte nanolayers. C.R.A.S., Chim. 8, 1135-1147.
- Rubio, C. (2002). Compréhension des mécanismes d’adhésion des biofilms en milieu marin en vue de la conception de nouveaux moyens de prévention, Thèse de Doctorat, Univ. Paris VI, France, 53 p.
- Thomas M, p. Valette, a.l. Mausset et p. Dejardin (2000). High molecular weight kininogen adsorption on hemodialysis membranes: influence of pH and relationship with contact phase activation of blood plasma. Influence of pre-treatment with poly(ethyleneimine). Int. J. Artif. Organs., 23, 20-26.
- Violleau D., j.p. Croué, h. Essis-Tome, h. Habarou et m. Pontié (2005). Fouling studies of a polyamide nanofiltration membrane by selected natural organic matter: an analytical approach. Desalinatn, 173, 223-238.
Liste des figures
Figure 1
Formule chimique du monomère de PDADMA.
Chemical formula of PDADMA monomer.
Figure 2
a) Image 2D (grossissement x5000); b) Image 3D de l’AN69 obtenue en mode contact par l’AFM.
a) 2D image of AN69 (zoom x5000; b) 3D image of AN69 obtained in contact mode.
(a)
(b)
Figure 3
a) Membrane AN69 en présence de E. coli; b) Membrane AN69 mod en présence de E. coli (grossissement x 2000).
a) AN69 membrane in presence of E. coli; b) AN69 mod membrane in presence of E. coli (magnified 2000x).
(a)
(b)
Figure 4
Images MEB de l’AN69, l’AN69 mod et l’AN69 mod nettoyée après immersion dans de l’eau de mer; temps d’élimination :18 h, grossissements x2000.
MEB images of AN69, AN69 mod and cleaned AN69 mod after immersion in sea water; Elimination time: 18 h., magnified 2000x.
Liste des tableaux
Tableau 1
Récapitulatif des résultats de nombres de transports de Li+, de perméabilités hydrauliques et de potentiels d’écoulement, pour l’AN69 vierge et modifiée, en présence et en l’absence de E. coli.
Physico-chemical properties of cleaned and modified AN69 in the presence and absence of E. coli.
Membrane |
Perméabilité hydraulique (L•m‑2•h‑1•bar‑1) (± 0,1) |
Nombre de transports tLi+* (± 0,02) |
Potentiel d’écoulement (mV/bar) (± 0,2) |
|---|---|---|---|
AN69 |
0,94 |
0,75 |
‑2,3 |
AN69 mod. |
0,45 |
0,40 |
+2,2 |
AN69 – E.coli |
0,42 |
nd |
‑3,3 |
AN69 mod – E.coli |
0,31 |
nd |
0,5 |
Tableau 2
Dénombrement des bactéries (bactéries/mm2) sur les membranes étudiées.
Bacterial counts on the studied membranes.
Membranes |
Bactéries /mm2 |
|---|---|
AN69 |
306 ± 177 |
AN69 mod |
798 ± 279 |
Tableau 3
Récapitulatif des résultats des nombres de transports tLi+, de PE et de PH pour l’AN69 mod avant et après le nettoyage.
Physico-chemical properties of modified AN69 before and after cleaning.
Membranes |
Nombre de transports tLi+ (± 0,02) |
Potentiel d’écoulement (mV/bar) (± 0,2) |
Perméabilité hydraulique (L•m‑2•h‑1•bar‑1) (± 0,1) |
|---|---|---|---|
N69 |
0,75 |
‑2,3 |
0,94 |
AN69mod |
0,40 |
2,2 |
0,45 |
AN69mod mer 3j |
0,41 |
2,0 |
0,41 |
AN69mod mer 6,5j |
0,43 |
2,5 |
0,38 |
AN69mod (mer 3j) N |
0,52 |
‑2,5 |
0,72 |
AN69mod (mer 6,5j) N |
0,58 |
‑3,1 |
0,68 |