Résumés
Résumé
Les effluents textiles contenant des colorants réactifs sont souvent très complexes et nécessitent des traitements intensifs. De nos jours, la combinaison de deux ou plusieurs techniques opératoires, en se servant des progrès scientifiques permettant une bonne commande du procédé, est devenue une alternative intéressante. Par ailleurs, les argiles et les minéraux argileux, du fait d’avoir des propriétés leur permettant d’être à la fois adsorbants et adjuvants de floculation, attirent un intérêt particulier des chercheurs dans le domaine du traitement des effluents industriels. Dans cette étude, un effluent textile qui représente les eaux résiduaires de l’unité de teinture du coton Denitex, Tlemcen en Algérie, a été traité par un procédé combiné. Le traitement comporte deux étapes : la première est une coagulation-floculation (CF) à l’aide des sels d’aluminium pré-neutralisés jusqu’à un rapport OH/Al égal à 2,25, donnant naissance au polycation de structure AlO4Al12(OH)24(H2O)12, appelé aussi Al13, en association avec une bentonite algérienne (B). Dans la deuxième étape, qui succède à la première, l’électroflottation (EF) a été utilisée pour exploiter son rôle de séparation solide-liquide, et aussi pour améliorer l’efficacité du traitement. Dans les deux techniques utilisées : (CF) et (EF), les conditions opératoires, telles que le pH, la concentration des réactifs, le temps de contact, d’une part, et aussi la densité du courant électrique et la consommation d’énergie, d’autre part, ont été déterminées. Les résultats obtenus indiquent que l’effluent traité par cette méthode ne contient pratiquement plus de couleur ni de DCO : 99,71 % et 99,07 % d’élimination sont obtenus, respectivement.
Mots clés:
- Effluent textile,
- colorants réactifs,
- coagulation,
- floculation,
- bentonite,
- électroflottation
Abstract
Textile effluents containing reactive dyes are often very complex and require intensive treatments. Nowadays, the combination of two or more techniques has become an interesting alternative, because of scientific progress allowing for a good control of the processes. Clays and clay minerals, because of their properties enabling them to be simultaneous adsorbents and flocculation additives, are of particular interest to researchers in industrial wastewater treatment. In this study, a textile effluent that represents the wastewater of a cotton dyeing plant (Denitex, Tlemcen, Algeria) was treated by a combined process. The treatment was divided into two stages: the first was a coagulation-flocculation (CF) stage using pre-neutralized aluminium salts, called Al13 polycations (AlO4Al12(OH)24(H2O)12), as a coagulant associated with an Algerian bentonite (B); in the second stage, an electroflotation technique (EF) was used. The EF technique was not only used as a solid-liquid separation operation, but also in the improvement of the effectiveness of the treatment. For the CF and EF treatments of wastewater, the effects of pH, reagent concentrations, contact times as well as electric current and energy consumption were investigated. The effluent treated by this combined method contained essentially no colour or COD: 99.7% and 99.1% elimination were obtained, respectively.
Keywords:
- Textile effluent,
- reactive dyes,
- coagulation,
- flocculation,
- bentonite,
- electroflotation
Corps de l’article
1. Introduction
L’industrie textile est l’une des industries consommatrices de grandes quantités d’eau. PETRINIC’ et al., (2007) ont indiqué que cette quantité est de l’ordre de 200 L d’eau par kg de produit textile fini.
Les colorants réactifs sont solubles et anioniques en solution aqueuse (CHEN-LU et McGARRAHAN, 2005). Cette classe de colorants et surtout leurs dérivés de dégradation ont été identifiés comme toxiques et causent des effets néfastes à la vie aquatique (PAPIC et al., 2004). Ils ont des structures aromatiques compliquées qui résistent aux traitements conventionnels des eaux usées et sont stables vis-à-vis des agents oxydants (AHMAD et PUASA, 2007).
Plusieurs procédés d’épuration ont été testés pour les éliminer des eaux de rejet. Nous pouvons citer : l’oxydation chimique (ARSLAN ET BALCIOGLU, 1999; KOCH et al., 2002; MARCO S et al., 2007; MURUGANANDHAM et SWAMINATHAN, 2004), l’électrolyse (ALINSAFI et al., 2005; KÖRBAHTI et TANYOLAC, 2008; RAJKUMAR et al., 2007; SHUANG et al., 2007), la biodégradation (CARLIELL et al., 1995; GATUT et al., 2006), l’adsorption (ANNADURAI et al., 2007; KARCHER et al., 2001; ONG et al., 2007; PAPIC et al., 2004; RUJIRA et al., 2007), la coagulation chimique (ALLEGRE et al., 2004; AHMAD et PUASA, 2007; BOON et al., 2000; DUK et al., 2007; PAPIC et al., 2000 et 2004; VERA et al., 2005) et les procédés membranaires (ALLEGRE et al., 2006; PETRINIC’ et al., 2007).
Dans l’industrie textile, le choix de tel ou tel procédé de traitement repose sur deux critères importants : le coût et l’efficacité. Pour assurer ce dernier critère, on est amené à combiner deux ou plusieurs procédés, suivant la nature des colorants utilisés et des méthodes de teinture employées pendant la production (VERA et al., 2005). Le traitement physico-chimique conventionnel des effluents textiles par coagulation/précipitation est souvent incapable de séparer les colloïdes à faible densité. La technique utilisant l’électroflottation (EF) présente une alternative très intéressante et compétitive par rapport aux systèmes traditionnels de séparation solide-liquide et de décontamination des eaux usées (ALEXANDROVA et al., 1994; ARAYA-FARIAS et al., 2008; BEN MANSOUR et al., 2007 et 2008; CALVIN, 1997; CASQUEIRA et al., 2006; KETKAR et al., 1991; KHELIFA et al., 2005; HOSNY, 1992 et 1996; MERZOUK et al., 2008; MURUGANANTHAN et al., 2004; OUSSEDIK et KHELIFA, 2001).
L’objectif de ce travail consiste en la décoloration d’une eau résiduaire textile réelle contenant des colorants appartenant au groupe des plus récalcitrants (les colorants réactifs) par coagulation/électroflottation. Il s’agit d’un premier traitement par coagulation-floculation à l’aide de Al13 et la bentonite, suivi d’une électroflottation en utilisant une électrode mixte insoluble, constituée de trois cathodes en acier inoxydable, et de deux anodes fabriquées avec du Ti/IrOx‑Sb2O5‑SnO2, testée avec succès par GAO et al. (2005).
1.1 Bref aperçu sur l’electroflottation
L’EF est une technique de séparation solide-liquide, basée sur la production de bulles de gaz générées par l’électrolyse de l’eau. Pendant leur mouvement ascensionnel, les bulles formées au niveau de la cathode (bulles de H2) et de l’anode (bulles d’O2), entraînent aussi bien les flocs que les fines particules de pollution, en suspension dans l’eau, vers le haut du réacteur. Cette montée des flocs à la surface de l’eau forme une écume contenant de 9 à 12 % de solides, faciles à séparer de l’eau (BECK et al., 1974, GARDAIS, 1990).
En général, l’EF possède deux principaux avantages la différenciant des autres techniques de séparation par flottation avec l’air comprimé : les bulles de gaz très fines, uniformes et bien dispersées, d’un diamètre moyen de 20 µm, permettent l’augmentation de la surface de contact avec les particules en suspension (ARAYA-FARIAS, 1999); le contrôle de la densité de courant dans la cellule permet de varier la concentration des bulles afin d’augmenter la probabilité de collisions (KHOSLA et al., 1991; HOSNY, 1992). En plus de ces deux avantages, elle est de coût de démarrage modéré, simple à installer, à commander et assure un taux élevé d’élimination de la DBO par oxydation des molécules organiques à l’anode (ARAYA-FARIAS, 1999).
Les réactions chimiques, produites à la surface des électrodes, pour générer les bulles de gaz, sont les suivantes :
Réaction à l’anode :
Réaction à la cathode :
Réaction totale :
L’électrode utilisée dans cette étude est stable, insoluble et inerte, son rôle se limite à la formation de bulles d’hydrogène et d’oxygène par électrolyse de l’eau. D’après ses concepteurs, elle ne participe à aucune autre réaction d’ordre électrochimique.
L’efficacité du processus physique d’évolution des gaz peut être divisée en trois étapes : la nucléation, la croissance et le détachement. À la surface des électrodes, les bulles se forment à partir des solutions hautement sursaturées en gaz. Par diffusion des gaz dissous vers la surface des bulles ou par coalescence à l’électrode, elles croissent avec d’autres bulles. Lorsque les forces de flottation dépassent celles les liants à l’électrode, elles se détachent de l’électrode (KHOSLA et al., 1991). BRANDON et al. (1985) ont proposé que l’interaction électrostatique entre les bulles et les doubles couches de l’électrode contrôle le diamètre de détachement des bulles. Selon KETKAR et al (1991), la dimension des bulles formées à la surface des électrodes varie entre 22 et 50 µm de diamètre selon les conditions expérimentales.
2. Matériel et méthodes
2.1 Matériel
La bentonite utilisée provient des gisements de maghnia, en Algérie, produite par la compagnie nationale ENOF. Elle a été utilisée telle qu’elle a été fournie à l’état de poudre fine brute (Tableau 1). Les quantités d’argile ajoutées aux différents échantillons, ont été prises à partir d’une suspension mère de 1 g•L‑1, fraîchement préparée et maintenue dispersée dans l’eau distillée, sous agitation continue, dans une fiole en verre à 20 °C.
Tableau 1
Propriétés physiques de la bentonite (B).
Physical properties of Bentonite (B).
|
SBET (m2•g‑1) |
Vm (m2•g‑1) |
Smicropore (m2•g‑1) |
Smesopore (m2•g‑1) |
Stotale (m2•g‑1) |
|---|---|---|---|---|
69,35 |
15,87 |
27,74 |
47,54 |
75,28 |
pHB= 10,11; 1 g•L‑1 à 20 °C
pHB= 10,11; 1 g•L‑1 at 20°C
Les échantillons d’effluent coloré utilisés dans cette étude ont été rassemblés au niveau du bassin collecteur de l’unité industrielle de teinture du coton, Denitex, Tlemcen (Algérie). Cette unité utilise des colorants réactifs pour teindre ses différents tissus. Les caractéristiques particulières de ces eaux sont représentées sur le tableau 2.
Tableau 2
Caractéristiques de l’eau résiduaire textile.
Characteristics of the textile wastewater.
Paramètres |
Valeurs ¶ |
|---|---|
Turbidité (NTU) |
130 |
pH |
13,31 |
Conductivité (mS•m‑1) |
27,6 |
DCO (mg•L‑1) |
327 |
λmax (nm) |
274 |
Température = 40 °C.
Temperature = 40 °C
La solution du polycation d’aluminium Al13 a été préparée à partir d’une solution de chlorure d’aluminium héxahydraté AlCl3.6H2O (Aldrich, Allemagne) pré-neutralisée par la soude NaOH (Prolabo, France) jusqu’à un rapport molaire d’hydrolyse OH/Al = 0,25 (KAZPARD et al., 2006). D’après BOTTERO et al. (1980), ce rapport assure la concentration maximale en polymère Al13. La solution obtenue, de concentration finale en aluminium égale à 0,1 M, a été conservée dans une fiole en verre à 20 °C.
2.2 Coagulation-floculation
Les essais de coagulation-floculation des solutions colorées ont été menés dans un floculateur à six postes, appelé aussi appareillage de Jar-tests, sur des volumes utiles de 500 cm3 d’un effluent textile réel. La température du réacteur a été ajustée, au préalable, à 20 °C, avant chaque essai, à l’aide d’un bain thermostaté. Le pH initial de la solution colorée est ajusté soit au pH 6, soit au pH 8 à l’aide d’acide chlorhydrique ou de soude 1 M ou 0,1 M préparée à partir des solutions « normadose » d’HCl ou NaOH (Prolabo, France). Afin de normaliser les essais, le coagulant (Al13) est ajouté aux mélanges échantillons d’eau textile-bentonite sous agitation d’abord rapide de 250 rpm pendant 2 min, puis lente de 60 rpm pendant 20 min. Après ce temps de coagulation, le mélange est transféré dans un cône d’Imhoff. Le volume de sédiment est déterminé après 30 minutes de décantation. Un volume de 30 mL du surnageant est également prélevé à l’aide d’une seringue à bout recourbé à 3 cm en-dessous de la surface libre pour effectuer les différentes mesures.
2.3 Électroflottation
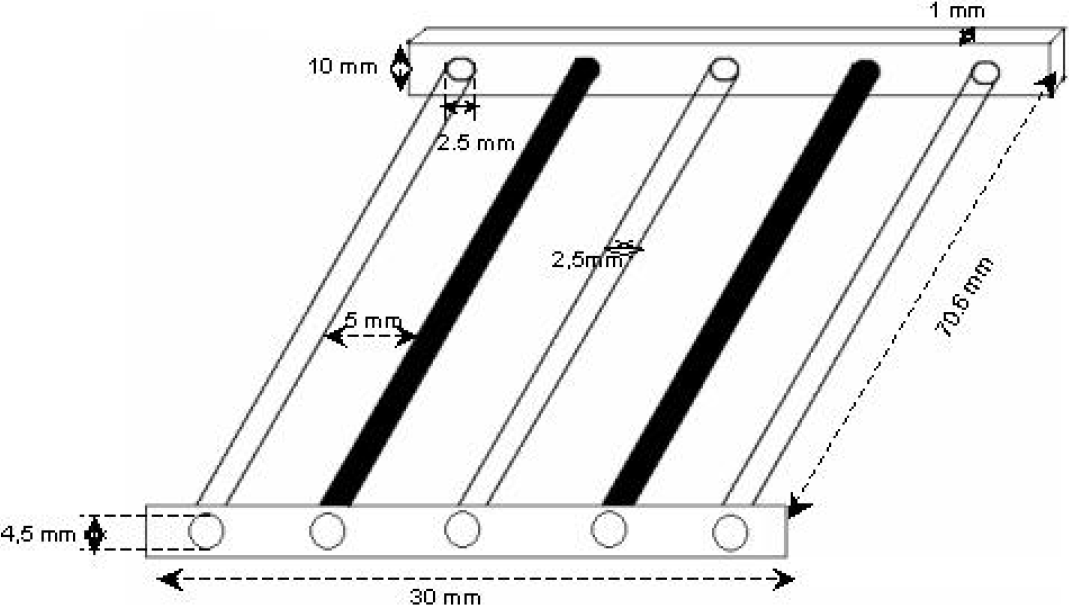
Les essais d’EF ont été réalisés dans une cellule, à base rectangulaire de 7 cm × 9 cm et de 30 cm de hauteur, fabriquée en Plexiglas (Figure 1). Les tests sont effectués soit sur des échantillons d’eau résiduaire textile, soit sur des échantillons qui ont subi au préalable un traitement, dans les conditions optimales, par coagulation-floculation. L’électrode utilisée est celle fournie par Dr CHEN G., University of Science and Technology, Clear Water Bay, Hong Kong, China. Elle est arrangée de manière alternative de trois cathodes en acier inoxydable, et deux anodes fabriquées avec du Ti/IrOx‑Sb2O5‑SnO2, de surface totale de contact égale à 34,24 cm2 (Figure 2). Elle est durable, rentable et constitue un bloc indépendant qui peut être retiré de la cellule, à tout moment, pour effectuer son nettoyage. D’après ses concepteurs, elle présente une stabilité électrochimique extrêmement élevée et une bonne activité électrocatalytique pour l’évolution de l’oxygène (CHEN et al., 2001; CHEN et al., 2002; CHEN, 2004). Le circuit électrique est composé d’un générateur de puissance Leybold Didactic CMBH, 2 (30 V et 2,5 A), un ampèremètre relié en série et un voltmètre relié en parallèle. La température dans la cellule a été maintenue constante à 20 ± 1 °C avec un pH égal à 6 ± 0,05. Pour rentabiliser la technique d’électroflottation, le suivi de l’évolution de l’élimination de la couleur, de la turbidité et de la DCO, d’une part, et le calcul de la consommation d’énergie, d’autre part, a été réalisé pour chaque essai, sur un volume siphonné à l’aide d’une seringue, à partir de l’eau séparée.
Figure 1
Installation expérimentale du procédé combiné. (1) Agitateur, (2) DC Générateur de puissance, (3) Voltmètre , (4) Ampèremètre, (5) Électrodes, (6) Réacteur, (7) Eau résiduaire textile, (8) Bulles de gaz, (9) Pompe péristaltique, (10 Eau à analyser, (11) Boue flottante.
Experimental set-up for the combined process. (1) reactor, (2) DC power supply, (3) voltmeter, (4) ammeter, (5) electrodes, (6) reactor, (7) textile wastewater, (8) gas bubbles, (9) peristaltic pump, (10) water to be analyzed, (11) floating sludge.
Figure 2
Arrangement enchevêtré d’électrodes pour électroflottation.
Interlocking electrode arrangement for electroflotation.
La mesure des concentrations de la couleur dans l’eau a été réalisée à l’aide d’un spectrophotomètre UV Visible SHIMADZU UV-2401PC, Japon. Le pourcentage de réduction de la couleur a été calculé à partir de la différence des valeurs d’absorbance de l’effluent, avant et après traitement, en utilisant la longueur d’onde d’absorption λmax = 274 nm. L’eau distillée a été utilisée comme référence.
La turbidité de l’eau a été mesurée à l’aide d’un turbidimètre HANNA Instruments, LP 2000, à lecture digitale, muni d’une cellule de 10 mL.
La demande chimique en oxygène (DCO) a été mesurée suivant « l’Analyse de l’eau » (RODIER, 1996).
Les essais, aussi bien de coagulation-floculation que ceux d’électroflottation, ont été réalisés, à l’échelle de laboratoire, sur des volumes d’eau de 500 mL. Dans ces conditions, le plus important était d’arriver à trouver des rapports reproductibles entre la teneur en pollution (couleur, DCO, MES, etc.) les réactifs mis en jeu et l’énergie électrique consommée. Par la commande de ce trio de paramètres, il est possible de faire varier les volumes d’effluent à traiter et de noter à chaque fois l’effet d’augmentation du volume sur l’efficacité du procédé. Avant de passer de cette échelle à celle industrielle, il est souvent nécessaire d’effectuer des essais à une échelle intermédiaire appelée échelle pilote. Le passage au traitement de volumes d’eau plus importants conduit à chaque fois à estimer les coefficients qu’il faut introduire lors des calculs des réacteurs, ainsi que des quantités de réactifs à mettre en oeuvre.
3. Résultats et discussion
3.1 Coagulation-floculation
3.1.1 Effet du pH sur l’agrégation
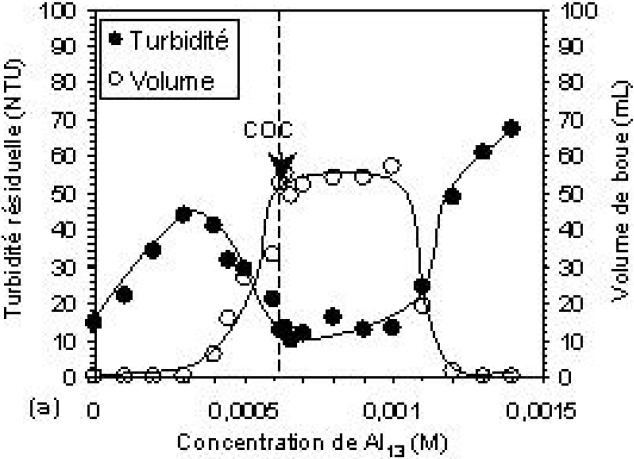
Dans de précédents travaux (KACHA et al., 2003 et KAZPARD et al., 2006), il a été constaté que l’efficacité du polymère Al13 dans la coagulation des colloïdes atteint son maximum lorsque le pH du milieu se trouve dans les environs de pH 6. Cette même efficacité commence à diminuer lorsque le pH du milieu passe au-dessus de pH 8. Pour vérifier le comportement des solutions de Al13 avec l’eau résiduaire textile, il a été choisi de régler le pH de l’eau sur ces deux valeurs. La figure 3 présente l’effet de la variation de la concentration du coagulant Al13 sur l’agrégation de la solution colorée à pH 6 et 8. Les courbes montrent la variation de la turbidité résiduelle et du volume du sédiment formé après 30 min de décantation, en fonction de la concentration croissante de Al13. Dans les deux cas, on observe une augmentation de la turbidité résiduelle dès les plus faibles concentrations en coagulant pour atteindre une turbidité maximale à une concentration donnée, qui ensuite diminue en pente rapide avec l’augmentation de la concentration en aluminium. Cette valeur correspond à la concentration optimale en coagulant (COC), elle est indiquée avec une flèche sur les courbes de la figure 2. Pour le cas étudié (eau résiduaire textile), les valeurs de la COC d’environ 6,2 10‑4 M et 9,7 10‑4 M ont été trouvées à pH 6 et 8, respectivement. À des concentrations plus élevées en aluminium situées entre 10‑3 M et 1,5 10‑3 M, la turbidité résiduelle demeure constante à pH 8, tandis qu’à pH 6 elle augmente fortement pour atteindre 70 NTU aux environs de 1,5 10‑3 M. Cette valeur de concentration provoque la restabilisation des colloïdes en suspension.
Figure 3
Évolution en fonction de la concentration de Al13 de la turbidité résiduelle et du volume de boue (a) à pH 6 et (b) à pH 8.
Evolution of the residual turbidity and settled volume as a function of the Al13 concentration at (a) pH 6 and (b) pH 8.
(a)
(b)
La diminution de la turbidité du surnageant, observée juste avant la COC aux pH 6 et 8, correspond à la formation des agrégats précipitables, ce qui s’exprime par une augmentation rapide du volume du sédiment formé dans cet intervalle de concentration, pour atteindre sa valeur maximale avec la COC. Au-dessus de la COC, le volume du sédiment se stabilise autour de 90 mL à pH 8, alors qu’il diminue brusquement à pH 6 pour atteindre des valeurs très faibles pendant la restabilisation de la suspension.
Les espèces positivement chargées de l’aluminium en solution aqueuse s’appellent les oxy-hydroxydes d’aluminium; elles présentent un mélange d’espèces monomériques et polynucléaires qui s’hydrolysent et tendent à précipiter sous forme de Al(OH)3 pendant le processus de coagulation en réagissant comme adsorbant (Pommerenk et Schafran, 2005). La surface des oxy-hydroxydes d’aluminium ainsi formée est capable de fixer ou de libérer des ions d’hydrogène, suivant que le milieu réactionnel soit acide ou basique. La charge portée par la surface est donc fortement affectée par la quantité d’ions d’hydrogène en solution et ainsi du pH. Quand le pH du milieu est basique, la charge positive du polycation Al13 diminue sous l’effet des ions OH‑ du milieu pour atteindre sa valeur la plus basse (1+) à pH 8. Au-delà de cette valeur, l’espèce prédominante de l’aluminium est le AlOH)4- (soluble dans l’eau) et à ce moment, le polycation Al13 se retrouve dépourvu de tout son pouvoir coagulant.
La différence dans la COC observée en passant de pH 6 à pH 8 est le résultat d’une forte déprotonation des groupements fonctionnels des colorants existants dans l’eau textile, provoquant la diminution de la charge de l’espèce coagulante à pH 8. Les titrages potentiométriques du polycation Al13 ont montré que sa charge est de 6+ à pH 6, et de seulement 1+ à pH 8 (KAZPARD et al., 2006). Cette différence de charge fait que les propriétés coagulantes sont très accentuées à pH 6. Il a été observé que des concentrations excessives en Al13 situées entre 10‑3 M et 1,5 10‑3 M créent la restabilisation de la suspension colloïdale, ce qui peut être expliqué par la répulsion entre les espèces très chargées positivement du polycation Al13 (6+). Ce phénomène n’a pas été observé, dans cet intervalle de concentration, à pH 8 à cause de la faible charge portée par le polycation (1+) à cette valeur de pH.
3.1.2 Effet de la bentonite sur l’agrégation
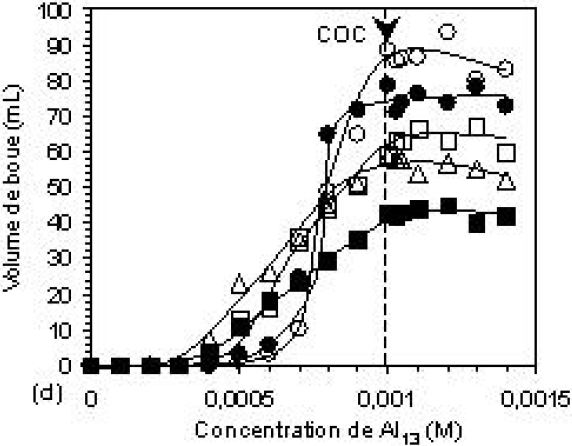
L’influence de la concentration en bentonite sur la coagulation de l’eau textile réelle a été étudiée en ajoutant des quantités croissantes de 25 à 125 mg (Figure 4). L’objectif visé est celui de déterminer la concentration minimale en bentonite naturelle permettant un meilleur effet sur la coagulation des effluents textiles, ainsi que sur le volume du sédiment formé.
Figure 4
Évolution en fonction de la concentration de Al13 de la turbidité résiduelle et du volume de boue avec et sans B, à (a, b pH 6 et (c,d) pH 8.
Evolution of the residual turbidity and settled volume as a function of Al13 concentration, with and without B, at (a, b) pH 6 and (c, d) pH 8.
(a)
(b)
(c)
(d)
Les courbes des figures 4a et 4c montrent l’influence de la concentration en bentonite sur la turbidité résiduelle à pH 6 et 8. Avant d’ajouter le coagulant, les quantités de bentonite ont été mélangées avec l’eau résiduaire. Les turbidités notées à pH 6 et à pH 8 étaient ~120 NTU et ~160 NTU, respectivement. Elles augmentent avec les masses ajoutées en bentonite pour atteindre 160 et 180 NTU avec la masse de bentonite naturelle de 125 mg. Dès l’ajout de faibles doses de coagulant, la turbidité commence d’abord par augmenter, puis en se rapprochant de la COC, elle chute rapidement pour atteindre des valeurs très basses.
Les courbes des figures 4b et 4d montrent l’influence de la concentration en bentonite sur le volume de boue formé. Il a été observé que ces courbes présentent en général les mêmes allures que celles des courbes en absence de bentonite. Ces allures se traduisent par trois stades : le premier correspond aux faibles doses en coagulant où l’on observe des volumes de boue nuls, le second illustre la formation d’agrégats sédimentables, et le troisième correspond à la zone de restabilisation de la suspension à pH 6, caractérisée par le retour des agrégats formés dans la suspension. Il a été noté que l’ajout de quantités de bentonite entre 25 et 100 mg provoque un abaissement significatif des volumes de boue obtenus, mais au-delà de cette concentration, tout autre ajout semble inefficace et n’influe pas sur le volume de boue formé. Il est connu que la présence des phases minérales solides, telles que les argiles en milieu aqueux, provoque une accélération du phénomène d’hydrolyse des sels d’aluminium qui tendent, en fin de compte, à former l’hydroxyde d’aluminium. Par ailleurs, les substances organiques tendent à former des complexes peu solubles avec les espèces aluminiques dans l’eau (ESPIAU et PEDRO, 1984). La combinaison de ces deux phénomènes, qui donne naissance à la formation de sels complexes qui précipitent, est peut être responsable de cet effet de l’ajout de la bentonite sur le volume des agrégats formés.
Un mécanisme d’élimination des colorants et des matières organiques, sous forme de complexes, par adsorption sur la surface de l’hydroxyde d’aluminium et de la bentonite, en formant ainsi des flocs denses et bien structurés, est très probable.
La présence de la bentonite semble conférer aux agrégats formés une certaine stabilité leur permettant de résister aux forces de cisaillement. Elle permet ainsi d’accélérer le processus de clarification sans augmenter la demande en coagulant. Ce constat se rapproche de celui avancé par DESJARDINS et al. (2002) qui montre l’importance de l’utilisation d’un micro-sable pour faire augmenter la densité du floc et accroître sa vitesse de sédimentation. Il est à noter que la présence de la bentonite influence non seulement les paramètres hydrodynamiques et cinétiques du système, mais aussi la structuration des agrégats. Enfin, la valeur du pH = 8, faisant passer l’aluminium sous forme de mélange d’espèces : Al13, Al(OH)3 et Al(OH)4‑, ne favorise pas la formation de complexes matière organique-bentonite-Al13. Cela est dû probablement aux forces de répulsion entre les différentes espèces chargées négativement ((Al(OH)4‑, bentonite et colorants), d’une part, et à la charge positive insuffisante portée par le polycation, d’autre part. Les agrégats formés sont alors moins denses et mal structurés, donnant des volumes de boue élevés, malgré la présence de la bentonite.
3.1.3 Effet de la concentration en coagulant
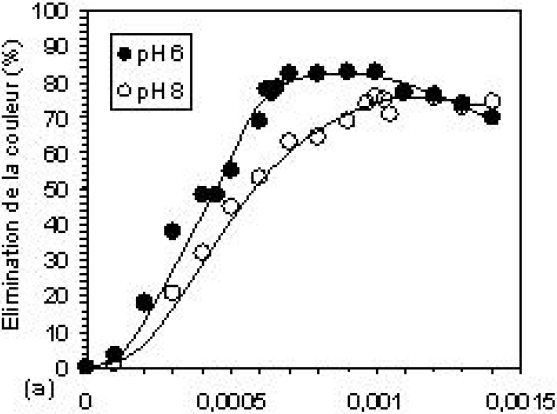
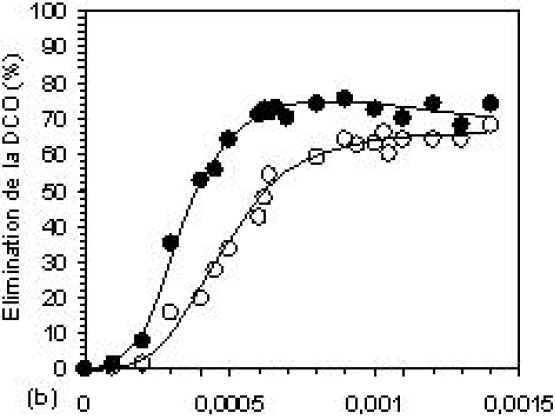
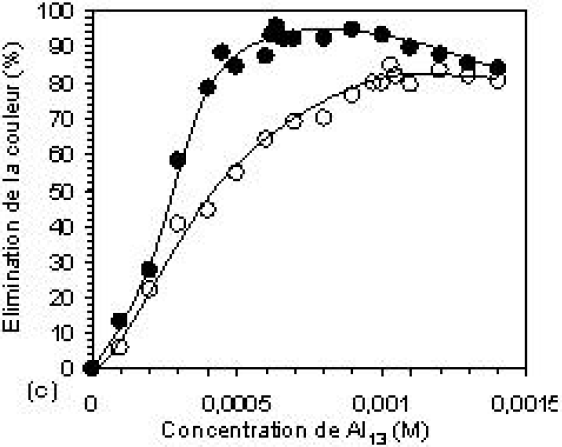
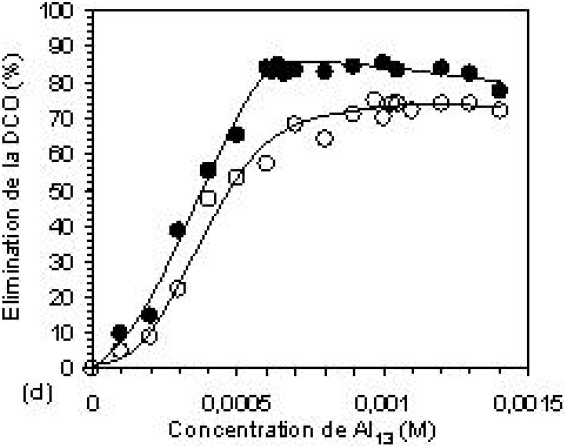
L’élimination de la couleur et de la DCO en fonction de la concentration du coagulant est montrée sur la figure 5. L’efficacité d’élimination augmente avec l’augmentation de la dose du coagulant. Les courbes 5a et 5b montrent que l’élimination de la couleur et de la DCO commence à augmenter dès les faibles doses de coagulant, pour atteindre le maximum à la COC. Les résultats obtenus sont : environ 80 et 70 % d’élimination de la couleur et 70 et 60 % d’élimination de la DCO, aux pH 6 et 8 respectivement. L’accroissement de la concentration de l’aluminium dans l’eau, en particulier sous la forme polynucléaire, fait augmenter les chances de rencontre avec les anions des colorants et des autres types de pollution pendant le processus de coagulation. Pendant le processus de floculation, les différentes interactions pollution-polymères d’aluminium conduisent à l’hydrolyse de ces derniers qui tendent ainsi vers la forme solide de l’hydroxyde d’aluminium. La phase solide ainsi formée offre une surface de contact sur laquelle les différents types de pollution viennent s’adsorber dans le sédiment. Aux concentrations plus élevées de Al13, on observe, à pH 6, une diminution de l’abattement qui correspond à la restabilisation de la suspension, faisant relarguer certaines quantités de colorants retenues par le sédiment, en solution (AHMAD et PUASA, 2007). Ces taux d’abattement obtenus en absence de tout autre adjuvant de floculation peuvent être modifiés par la présence de l’argile (bentonite) associée avec le coagulant. En effet, les figures 5c et 5d montrent de manière claire que la présence de celle-ci améliore la qualité du traitement en augmentant les taux d’abattement et produit une bonne décantation du sédiment formé (Kacha et al., 1997). L’efficacité du traitement est alors revue à la hausse pour atteindre 93 et 80 % d’élimination de la couleur et 83,8 et 74,7 % d’élimination de la DCO, aux pH 6 et 8, respectivement.
Figure 5
Efficacité d’élimination de la couleur et de la DCO à pH 6 et 8, (a, b) : sans Bentonite et (c,d) : avec Bentonite.
Removal efficiencies of colour and COD at pH 6 and 8, (a, b): without Bentonite and (c, d) with Bentonite.
(a)
(b)
(c)
(d)
3.2 Électroflottation
Pour mettre en évidence le rôle du procédé d’électroflottation, celui-ci a été étudié d’abord comme seule technique de traitement de l’effluent textile, ensuite comme technique complémentaire de séparation solide-liquide pour améliorer le traitement physico-chimique par coagulation-floculation.
3.2.1 Effet de la densité du courant électrique
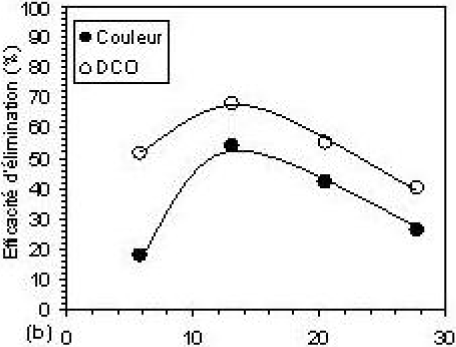
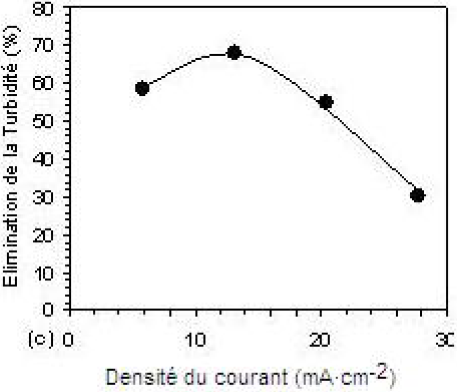
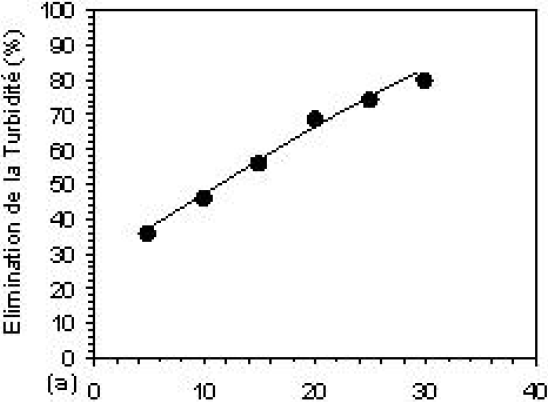
Les essais d’électroflottation ont été réalisés, aussi bien sur des échantillons d’eau résiduaire que sur ceux traités, dans les conditions optimales, par coagulation-floculation. La figure 6 montre l’efficacité d’élimination de la turbidité, de la couleur et de la DCO en fonction de la valeur imposée de la densité du courant électrique. Afin de montrer son effet sur la performance du procédé d’EF, l’influence de cette dernière a été étudiée dans l’intervalle des densités de 5,84 à 27,74 mA•cm‑2. Il a été constaté que l’efficacité du procédé augmente avec l’augmentation de la densité du courant électrique jusqu’à une valeur optimale de 13,14 mA•cm‑2 correspondant à des taux d’élimination maximaux. Les figures 6a et 6b montrent que l’EF seule possède un rendement épuratoire modéré, en comparaison avec celui de la CF seule. Les efficacités d’élimination obtenues sont de l’ordre de 46 %, 54 % et 68 %, respectivement. La relativement bonne efficacité obtenue pour la DCO est expliquée par le fait que le procédé d’EF assure un taux élevé d’élimination de la DBO et, par conséquent, de la DCO, par oxydation des molécules organiques à l’anode (ARAYA-FARIAS, 1999). Par contre, son application après la CF améliore de manière sensible les taux d’abattement, qui atteignent 68,2 %, 96,3 %, et 98,1 % respectivement (Figures 6c et 6d). La présence du courant électrique provoque une charge responsable de l’élimination massive des polluants. En outre, de meilleures efficacités de collection des particules floculées pourraient être atteintes au cours de l’électroflottation en obtenant des bulles de petite taille, ceci va avec l’augmentation de la densité de courant (JIANTUAN et al., 2004). Au-delà de la valeur optimale, on constate une réduction de l’efficacité d’élimination de la pollution (30,3 %; 94,8 %; et 95,4 %).
Figure 6
Efficacité d’élimination de la couleur, de la DCO et de la turbidité résiduelles à pH 6, par (a, b) : électroflottation seule et (c, d) : méthode combinée. [Al13] = 6,2 10‑4 M; B = 100 mg et 10 min de flottation.
Removal efficiencies of colour, COD and residual turbidity at pH 6, by (a, b): electroflotation alone (c, d): combined method. [Al13] = 6.2 x 10‑4 M, B = 100 mg and 10 min of flotation.
(a)
(b)
(c)
(d)
Ce phénomène trouve son explication par l’effet de turbulence causé par l’accroissement excessif du nombre de bulles de gaz, provocant ainsi une défloculation des agrégats. Le nombre de rencontres entre les particules floculées et les bulles de gaz est alors complètement affecté. La chute du taux d’élimination de la turbidité confirme cette hypothèse. HOSNY (1996) a remarqué que l’augmentation du nombre de bulles conduit à l’augmentation du nombre de collisions bulles-bulles faisant diminuer le nombre de collisions bulles-pollution.
3.2.2 Effet du temps de d’électroflottation
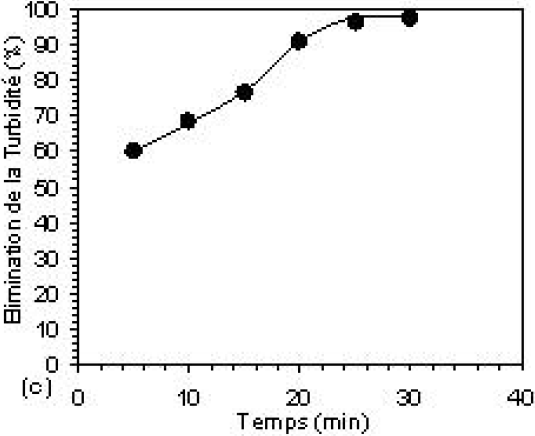
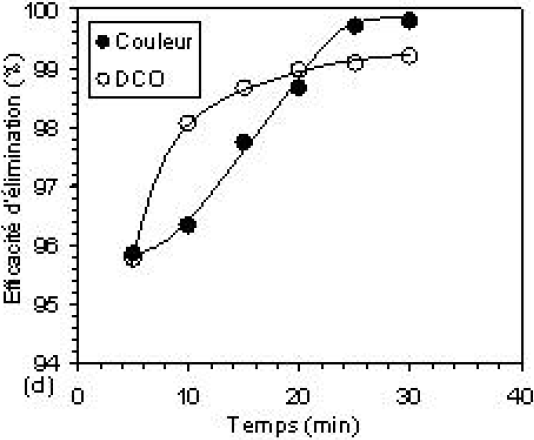
Les résultats du traitement de l’effluent textile par électroflottation prouvent que le temps de flottation joue un rôle important. En effet, à une valeur de densité du courant fixe égale à 13,14 mA•cm‑2, il a été observé une amélioration de l’efficacité du traitement avec l’augmentation de la durée de l’électrolyse, comme le montre la figure 7.
Figure 7
Efficacité d’élimination de la couleur, de la DCO et de la turbidité résiduelles à pH 6, par (a, b) : électroflottation seule et (c, d) : la méthode combinée. [Al13] = 6,2 10‑4 M; B = 100 mg et densité de courant = 13,14 mA•cm‑2.
Removal efficiencies of colour, COD and residual turbidity at pH 6, by (a, b): electroflotation process and (c, d): combined method. [Al13] = 6.2 x 10‑4 M, B = 100 mg and current density = 13,14 mA•cm‑2.
(a)
(b)
(c)
(d)
Figure 8
Spectrogramme de l’eau résiduaire textile avant et après traitement à pH 6.
Spectrogram of textile wastewater before and after treatment at pH 6.
Eau résiduaire textile diluée 10 fois.
Eau résiduaire textile diluée 5 fois traitée par électroflottation à 13.14 mA/cm2 et 25mn.
Eau résiduaire textile traitée par coagulation-floculation dans les conditions optimales.
Eau résiduaire textile traitée par la méthode combinée coagulation-floculation-électroflottation.
Le taux d’abattement augmente avec le temps de contact appliqué jusqu’à une valeur égale à 25 min où le processus semble atteindre son meilleur rendement; l’efficacité d’abattement atteint alors les valeurs suivantes : 96,2 %; 99,1 % et 99,7 % pour la turbidité, la DCO et la couleur respectivement. Si les taux d’élimination de la pollution sont élevés, ceci est dû à la production d’une quantité optimale de bulles, laquelle offre une grande probabilité de rencontre entre les bulles et les agrégats formés pendant la floculation. Les particules floculées seront ensuite emportées avec les bulles dans leur mouvement ascensionnel. Au-delà du temps optimal, le processus de séparation solide-liquide se retrouve ralenti et stabilisé. Cela peut être expliqué par le fait que les particules en suspension susceptibles d’être attachées aux bulles sont de différentes tailles; les plus grosses sont facilement éliminées, tandis que les particules de faible dimension restent en suspension, puisqu’elles adhèrent difficilement aux bulles. Le procédé atteint, dans ces conditions, ses limites (HOSNY, 1996).
3.2.3 Consommation de l’énergie électrique
Le tableau 3 indique que la consommation d’énergie électrique augmente avec l’augmentation du courant électrique appliqué. Comme l’intensité du courant électrique est un paramètre facile à contrôler, il représente une variable capitale dans l’exécution du processus d’électroflottation. Hosny (1996) a indiqué que pour réduire au minimum la consommation d’énergie électrique, il est plus désirable de diminuer la tension de la cellule d’électroflottation plutôt que l’intensité du courant (Loi d’Ohm). À la valeur de la densité du courant de 13,14 mA•cm‑2, la consommation électrique était de 39,74 10‑2 KWh•m‑3, ce qui représente une charge faradique de 5,59 F•m‑3.
Tableau 3
Consommation d’énergie en fonction de la densité du courant à pH 6. [Al13] = 6,2 10‑4 M; B = 100 mg.
Energy consumption as a function of current density variation at pH 6. [Al13] = 6.2 x 10‑4 M; B = 100 mg.
Densité du courant (mA•cm‑2) |
5,84 |
13,14 |
20,44 |
27,74 |
|---|---|---|---|---|
Consommation d’énergie × 10+2 (KWh•m‑3) |
13,28 |
39,74 |
81,34 |
157,7 |
Charge électrique (F•m‑3) |
2,48 |
5,59 |
8,70 |
11,81 |
Temps de flottation = 10 min
Flotation time = 10 min
Le temps d’électrolyse est aussi un paramètre important puisqu’il intervient dans la détermination de la charge appliquée et, par conséquent, l’énergie consommée aussi. En passant du temps de flottation de 10 à 25 minutes, les taux d’abattement de couleur varient de 96,33 % à 99,71 % respectivement. La consommation de l’énergie électrique correspondante augmente de 39,74 10‑2 jusqu’à 93,75 10‑2 KWh•m‑3; ce qui représente une variation de la charge faradique de 5,59 jusqu’à 13,98 F•m‑3 (Tableau 4). Du point de vue efficacité du traitement, 25 minutes peuvent être considérées comme temps optimal qui assure un meilleur rendement épuratoire.
Tableau 4
Consommation d’énergie en fonction de la variation du temps de flottation à pH 6 [Al13] = 6,2 10‑4 M; B = 100 mg.
Energy consumption as a function of flotation time at pH 6. [Al13] = 6.2 x 10‑4 M, B = 100 mg.
Temps de flottation (min) |
5 |
10 |
15 |
20 |
25 |
30 |
|---|---|---|---|---|---|---|
Consommation d’énergie × 10+2 (KWh•m‑3) |
18,77 |
39,74 |
56,25 |
75 |
93,75 |
112,5 |
Charge électrique (F•m‑3) |
2,79 |
5,59 |
8,39 |
11,19 |
13,98 |
14,92 |
Densité du courant = 13,14 mA•cm‑2
Current density = 13.14 mA•cm‑2
3.2.4 Efficacité et avantages de la méthode combinée
En comparant les efficacités de traitement obtenues pour les trois méthodes : EC seule, EF seule et méthode scombinées, il ressort que le premier procédé (CF) intervient dans l’élimination de la majeure partie de la pollution (~90 %), tandis que le deuxième (EF) complète et améliore la qualité du traitement. Par la combinaison de ces deux méthodes, l’effluent traité ne contient pratiquement plus de couleur ni de DCO. Les pourcentages d’abattement de la pollution se rapprochent de 100 %.
Les spectrogrammes de L’effluent textile brut (1), de l’eau textile traitée par électroflottation seule (2), par Al13 et la bentonite (3), et celle traitée par la méthode combinée (4), obtenus par spectrophotométrie, sont donnés sur la figue 8.
Parmi les avantages de cette méthode, en plus de sa commande facile, c’est le prix de revient de traitement du mètre cube d’eau résiduaire. La consommation de matériaux utilisés est comme suit : 300 g•m‑3 de AlCl3.(H2O)6; 235 g•m‑3 de NaOH et 200 g•m‑3 de bentonite. Par ailleurs, l’électrode combinée d’électroflottation possède l’avantage de rester intacte pendant une durée d’utilisation de 20 années, d’après ses concepteurs. Sachant que la consommation d’énergie électrique exprimée par la charge faradique est de 13,98 F•m‑3, et connaissant les prix des matériaux et de l’électrode d’EF, il sera facile d’estimer le coût global de traitement du mètre cube d’eau usée textile. Une étude plus détaillée est nécessaire pour avancer le coût réel du procédé.
4. Conclusion
L’amélioration de l’efficacité du traitement des effluents de l’industrie textile est possible par la combinaison de deux ou plusieurs techniques opératoires. La combinaison de l’électroflottation avec la coagulation-floculation pour traiter un effluent textile contenant des colorants réactifs a donné de très bons résultats. L’efficacité de la coagulation dépend essentiellement du pH et de la concentration des réactifs. Les valeurs qui donnent le meilleur rendement sont : 6,2 10‑4 mol•L‑1 de Al13 et 200 mg•L‑1 de bentonite, à pH 6. L’électroflottation permet une bonne et intensive séparation solide-liquide et améliore la qualité du traitement. Son efficacité dépend de la valeur du courant électrique et du temps d’électrolyse. Les meilleurs rendements sont obtenus avec une densité du courant de 13,14 mA•cm‑2, pour un temps d’électrolyse égal à 25 minutes, générant une consommation d’énergie électrique relativement modérée de 13,98 F•m‑3. Par la combinaison des deux procédés, les taux d’abattement de la turbidité, de la couleur et de la DCO sont : 96,2 %; 99,7 % et 99,1 % respectivement.
Parties annexes
Remerciements
Les auteurs remercient MM. A. Mezouar, Responsable du Service Audio-visuel de la Faculté des Sciences, Université Djillali Liabes de Sidi Bel Abbes pour son aide dans la préparation du montage d’Électroflottation. Aussi, M. O. Ouhib, Directeur de l’Unité industrielle Denitex, Sebdou, Algérie, pour son assistance et les facilités d’accès aux eaux résiduaires utilisées dans ce travail.
Références biliographiques
- AHMAD A.L. et S.W. PUASA (2007). Reactive dyes decolourization from an aqueous solution by combined coagulation/micellar-enhanced ultrafiltration process. Chem. Eng. J., 132, 257-265.
- ALEXANDROVA L., T. NEDIALKOVA et I. NISHKOV (1994). Electroflotation of metal ions in waste water. Int. J. Min. Proc., 41, 285-294.
- ALINSAFI A., M. KHEMIS, M.N. PONS, J.P. LECLERC, A. YAACOUBI, A. BENHAMMOU et A. NEJMEDDINE (2005). Electro-coagulation of reactive textile dyes and textile wastewater. Chem. Eng. Proc., 44, 461–470.
- ALLEGRE C., M. MAISSEU, F. CHARBIT et P. MOULIN (2004). Coagulation- flocculation- decantation of dye house effluents: concentrated effluents. J. Hazard. Mater., 116, 57-64.
- ALLEGRE C., P. MOULIN, M. MAISSEU et F. CHARBIT (2006). Treatment and reuse of reactive dyeing effluents. J. Membr. Sci., 269, 15-34.
- ANNADURAI G., L.Y. LING et J.F. LEE (2008). Adsorption of reactive dye from an aqueous solution by chitosan: Isotherm, kinetic and thermodynamic analysis, J. Haz. Mater., 152, 337-346.
- ARAYA-FARIAS M. (1999). La clarification du jus de pomme par électroflottation. Mémoire maître ès sciences (M.Sc.), Univ. Laval, Canada, 145 p.
- ARAYA-FARIAS M., M. MONDOR, F. LAMARCHE, S.TAJCHAKAVIT et J. MAKHLOUF (2008). Clarification of apple juice by electroflotation. Innov. Food Sci. Emerg. Technol., 9, 320-327.
- ARSLAN I. et I.A. BALCIOGLU (1999). Degradation of commercial reactive dyestuffs by heterogenous and homogenous advanced oxidation processes: a comparative study. Dyes Pigments, 43, 95–108.
- BECK E. C., A.P. GIANNINI et E.R. RAMIREZ (1974).Electrocoagulation clarifies food wastewater. Food Technol., 28, 18-19.
- BEN MANSOUR L., I. KESENTINI et B. ELLEUCH (2007). Treatment of wastewaters of paper industry by coagulation–electroflotation. Desalination, 208, 34-41.
- BEN MANSOUR L. et I. KESENTINI (2008). Treatment of effluents from cardboard industry by coagulation–electroflotation. J. Hazard. Mater., 153, 1067-1070.
- BOON HAI TAN, TJOON TOW TENG et A.K. MOHD OMAR (2000). Removal of dyes and industrial dye wastes by magnesium chloride. Water Res., 34, 597-601.
- BOTTERO J.Y., J.M. CASES, F. FIESSINGER et J.E. POIRIER (1980). Studies of hydrolyzed aluminum chloride solutions. 1. Nature of aluminium species and composition of aqueous solutions. J. Phys. Chem., 84, 2933–2939.
- BRANDON N. P., G.H. KELSAII, S. LEVINE et A.L. SMITH (1985). Interfacial electrical properties of electrogenerated bubbles. J. Appl. Electrochem.,18, 485-493.
- CALVIN P.C. POON (1997). Electroflotation for groundwater decontamination. J. Hazard. Mater., 55, 159-170.
- CARLIELL C. M., S.J BARCLAY., N. NAIDOO, C.A. BUCKLEY, D.A. MULHOLLAND et E. SENIOR (1995). Microbial decolorisation of reactive azo dye under anaerobic conditions. Water, SA,21, 61-69
- CASQUEIRA R.G., M.L. TOREM et H.M. KOHLER (2006). The removal of zinc from liquid streams by electroflotation. Min. Eng., 19, 1388-1392.
- CHEN-LU Y. et J. Mc«GARRAHAN (2005). Electrochemical coagulation for textile effluent decolorization. J. Hazard. Mater., B127, 40–47
- CHEN G., X. CHEN, P.L. YUE (2002). Electrochemical behavior of stable Ti/IrOx–Sb2O5–SnO2 anodes for oxygen evolution. J. Phys. Chem., B 106, 4364–4369.
- CHEN G. (2004). Electrochemical technologies in wastewater treatment. Sep. Purif. Technol., 38, 11–41
- CHEN X., G.H. CHEN et P.L. YUE, (2001). Stable Ti/IrOx–Sb2O5–SnO2 anode for O2 evolution with low Ir content. J. Phys. Chem., B105, 4623–4628.
- DESJARDINS C., B. KOUDJONOU, R. DESJARDINS (2002). Laboratory study of ballasted flocculation. Water Res., 36, 744-754.
- DUK JONG JOO, WON SIK SHIN A JEONG-HAK CHOI, SANG JUNE CHOI A, MYUNG-CHUL KIM, MYUNG HO HAN, TAE WOOK HA et YOUNG-HUN KIM (2007). Decolorization of reactive dyes using inorganic coagulants and synthetic polymer. Dyes Pigments., 73, 59-64.
- ESPIAU P. et G. PEDRO (1984). Comportement des ions aluminiques et de la silice en solution : étude de la formation de la kaolinite. Clay Miner., 19, 615-627.
- GAO P., X. CHEN, F. SHEN et G. CHEN (2005). Removal of chromium (VI) from wastewater by combined electrocoagulation–electroflotation without a filter. Sep. Purif. Technol. , 43, 117–123.
- GARDAIS D. (1990). Les procédés électriques de traitement des rejets industriels. Dans : Environnement et Électricité. Electra, Doppee Difiùsion, Avoa. France, pp. 300-320.
- GATUT S., B. KELLER-LEHMANN et J. KELLER (2006). Optimization of integrated chemical–biological degradation of a reactive azo dye using response surface methodology. J. Hazard. Mater., 138, 160–168.
- HOSNY A.Y. (1992). Separation oil from oil-water emulsions using an electroflotation cell wirb insoluble electrodes. Filtr. Sep., 29, 19-423.
- HOSNY A.Y. (1996). Separating oil from oil-water emulsions by electroflotation technique. Sep. Technol., 6, 9-17.
- JIANTUAN GE, JIUHUI QU, PENGJU LEI et HUIJUAN LIU (2004). New bipolar electrocoagulation–electroflotation process for the treatment of laundry wastewater. Sep. Purif. Technol., 36, 33–39.
- KACHA S., M.S. OUALI et S. ELMALEH (1997). Élimination des colorants des eaux résiduaires de l’industrie textile par la bentonite et des sels d’aluminium. Rev. Sci. Eau, 2, 233‑247.
- KACHA S., Z. DERRICHE et S. ELMALEH (2003). Equilibrium and kinetics of color removal from dye solutions with bentonite and polyaluminum hydroxide. Water Environ. Res., 75, 1-6.
- KARCHER S., A .KORNMULLER et M. JEKEL (2001). Screening of commercial sorbents for removal of reactive dyes. Dyes Pigments, 51,111-125.
- KAZPARD. V., B.S. LARTIGES, C. FROCHOT, J.B. D’ESPINOSE DE LA CAILLERIE, M.L. VIRIOT, J.M. PORTALD, T. GÖRNER ET J.L. BERSILLON (2006). Fate of coagulant species and conformational effects during the aggregation of a model of a humic substance with Al13 polycations. Water Res., 40 , 1965‑1974.
- KETKAR D.R., R. MALLIKWUNAN et S. VENKATACHALAM (1991). Electroflotation of quartz fines. Int. J. Miner. Proc.., 31, 127-138.
- KHELIFA. A., S. MOULAY et A.W. NACEUR (2005). Treatment of metal finishing effluents by the electroflotation technique. Desalination, 181, 27-33.
- KHOSLA N.K., S. VENKATACHALAM et P. SOMASUNDARAQ (1991). Pulsed electrogeneration of bubbles for electroflotation. J. Appl. Electrochem., 21, 986‑990.
- KOCH M., A . YEDILER, D. LIENERT, G. INSEL et A. KETTRUP (2002). Ozonation of hydrolyzed azo dye reactive yellow 84 (Cl). Chemosphere, 46, 109-113
- KÖRBAHTI. B.K. et A. TANYOLAC (2008). Electrochemical treatment of simulated textile wastewater with industrial components and Levafix Blue CA reactive dye: Optimization through response surface methodology. J. Hazard. Mater., 151, 422-431.
- MARCO S. L., A. DIAS ALBINO, A. SAMPAIOB, C. AMARALB et J.A. PERESA. (2007). Degradation of a textile reactive azo dye by a combined chemical–biological process: Fenton’s reagent-yeast. Water Res., 41, 1103-1109.
- MERZOUK. B., K. MADANI et A. SEKKI (2008). Treatment characteristics of textile wastewater and removal of heavy metals using the electroflotation technique. Desalination, 228, 245-254.
- MURUGANANDHAM M. et M. SWAMINATHAN (2004). Photochemical oxidation of reactive azo dye with UV–H2O2 process. Dyes Pigments, 62, 269–275.
- MURUGANANTHAN M., G. BHASKAR RAJU et S. PRABHAKAR (2004). Separation of pollutants from tannery effluents by electro flotation. Sep. Purif. Technol., 40, 69–75.
- ONG S.T., C.K. LEE et Z. ZAINAL (2007). Removal of basic and reactive dyes using ethylenediaminemodified rice hull. Bioresour. Technol., 98, 2792–2799.
- OUSSEDIK. S.M. et A. KHELIFA, (2001). Reduction of copper ions concentration in wastewaters of galvanoplastic industry by electroflotation. Desalination, 139, 383.
- PAPIC S., N. KOPRIVANAC et A. LONCARIC BOZIC (2000). Removal of reactive dyes from wastewater using Fe(III) coagulant. J. Soc. Dyers Color. , 116, 352–358.
- PAPIC S., N. KOPRIVANAC, A.L. BOZIC et A. METES (2004). Removal of some reactive dyes from synthetic wastewater by combined Al(III) coagulation/carbon adsorption process. Dyes Pigments, 62, 293-300.
- PETRINIC I., N.P. RAJ ANDERSEN, S. SOSTAR-TURK et A.M. LE MARECHAL (2007). The removal of reactive dye printing compounds using nanofiltration. Dyes Pigments, 74, 512-518.
- POMMERENK P. et G. SCHAFRAN (2005). Adsorption of inorganic and organic ligands onto hydrous aluminum oxide: Evaluation of surface charge and the impacts on particle and NOM removal during water treatment. Environ. Sci. Technol., 30, 6429-6434.
- RAJKUMAR D., B. JOO SONG et J.G. KIM (2007). Electrochemical degradation of Reactive Blue 19 in chloride medium for the treatment of textile dyeing wastewater with identification of intermediate compounds. Dyes Pigments, 72, 1-7.
- RODIER J. (1996). L’analyse de l’eau. Édition Dunod, Paris, France, 166-168.
- RUJIRA D., N. SAKKAYAWONG, P. THIRAVETYAN et W. NAKBANPOTE (2007). Adsorption of reactive red 141 from wastewater onto modified chitin. J. Hazard. Mater., 145, 250-255.
- SHUANG S.Z.H., J. QIU, L. XU et J. CHEN (2007). Ozone assisted electrocoagulation for decolorization of C.I. Reactive Black 5 in aqueous solution: An investigation of the effect of operational parameters. Sep. Purif. Technol., 55, 238–245.
- VERA G., A. VINDER et M. SIMONIČ (2005). Efficiency of the coagulation/flocculation method for the treatment of dyebath effluents. Dyes Pigments, 67, 93-97.
Liste des figures
Figure 1
Installation expérimentale du procédé combiné. (1) Agitateur, (2) DC Générateur de puissance, (3) Voltmètre , (4) Ampèremètre, (5) Électrodes, (6) Réacteur, (7) Eau résiduaire textile, (8) Bulles de gaz, (9) Pompe péristaltique, (10 Eau à analyser, (11) Boue flottante.
Experimental set-up for the combined process. (1) reactor, (2) DC power supply, (3) voltmeter, (4) ammeter, (5) electrodes, (6) reactor, (7) textile wastewater, (8) gas bubbles, (9) peristaltic pump, (10) water to be analyzed, (11) floating sludge.
Figure 2
Arrangement enchevêtré d’électrodes pour électroflottation.
Interlocking electrode arrangement for electroflotation.
Figure 3
Évolution en fonction de la concentration de Al13 de la turbidité résiduelle et du volume de boue (a) à pH 6 et (b) à pH 8.
Evolution of the residual turbidity and settled volume as a function of the Al13 concentration at (a) pH 6 and (b) pH 8.
(a)
(b)
Figure 4
Évolution en fonction de la concentration de Al13 de la turbidité résiduelle et du volume de boue avec et sans B, à (a, b pH 6 et (c,d) pH 8.
Evolution of the residual turbidity and settled volume as a function of Al13 concentration, with and without B, at (a, b) pH 6 and (c, d) pH 8.
(a)
(b)
(c)
(d)
Figure 5
Efficacité d’élimination de la couleur et de la DCO à pH 6 et 8, (a, b) : sans Bentonite et (c,d) : avec Bentonite.
Removal efficiencies of colour and COD at pH 6 and 8, (a, b): without Bentonite and (c, d) with Bentonite.
(a)
(b)
(c)
(d)
Figure 6
Efficacité d’élimination de la couleur, de la DCO et de la turbidité résiduelles à pH 6, par (a, b) : électroflottation seule et (c, d) : méthode combinée. [Al13] = 6,2 10‑4 M; B = 100 mg et 10 min de flottation.
Removal efficiencies of colour, COD and residual turbidity at pH 6, by (a, b): electroflotation alone (c, d): combined method. [Al13] = 6.2 x 10‑4 M, B = 100 mg and 10 min of flotation.
(a)
(b)
(c)
(d)
Figure 7
Efficacité d’élimination de la couleur, de la DCO et de la turbidité résiduelles à pH 6, par (a, b) : électroflottation seule et (c, d) : la méthode combinée. [Al13] = 6,2 10‑4 M; B = 100 mg et densité de courant = 13,14 mA•cm‑2.
Removal efficiencies of colour, COD and residual turbidity at pH 6, by (a, b): electroflotation process and (c, d): combined method. [Al13] = 6.2 x 10‑4 M, B = 100 mg and current density = 13,14 mA•cm‑2.
(a)
(b)
(c)
(d)
Figure 8
Spectrogramme de l’eau résiduaire textile avant et après traitement à pH 6.
Spectrogram of textile wastewater before and after treatment at pH 6.
Eau résiduaire textile diluée 10 fois.
Eau résiduaire textile diluée 5 fois traitée par électroflottation à 13.14 mA/cm2 et 25mn.
Eau résiduaire textile traitée par coagulation-floculation dans les conditions optimales.
Eau résiduaire textile traitée par la méthode combinée coagulation-floculation-électroflottation.
Liste des tableaux
Tableau 1
Propriétés physiques de la bentonite (B).
Physical properties of Bentonite (B).
|
SBET (m2•g‑1) |
Vm (m2•g‑1) |
Smicropore (m2•g‑1) |
Smesopore (m2•g‑1) |
Stotale (m2•g‑1) |
|---|---|---|---|---|
69,35 |
15,87 |
27,74 |
47,54 |
75,28 |
pHB= 10,11; 1 g•L‑1 à 20 °C
pHB= 10,11; 1 g•L‑1 at 20°C
Tableau 2
Caractéristiques de l’eau résiduaire textile.
Characteristics of the textile wastewater.
Paramètres |
Valeurs ¶ |
|---|---|
Turbidité (NTU) |
130 |
pH |
13,31 |
Conductivité (mS•m‑1) |
27,6 |
DCO (mg•L‑1) |
327 |
λmax (nm) |
274 |
Température = 40 °C.
Temperature = 40 °C
Tableau 3
Consommation d’énergie en fonction de la densité du courant à pH 6. [Al13] = 6,2 10‑4 M; B = 100 mg.
Energy consumption as a function of current density variation at pH 6. [Al13] = 6.2 x 10‑4 M; B = 100 mg.
Densité du courant (mA•cm‑2) |
5,84 |
13,14 |
20,44 |
27,74 |
|---|---|---|---|---|
Consommation d’énergie × 10+2 (KWh•m‑3) |
13,28 |
39,74 |
81,34 |
157,7 |
Charge électrique (F•m‑3) |
2,48 |
5,59 |
8,70 |
11,81 |
Temps de flottation = 10 min
Flotation time = 10 min
Tableau 4
Consommation d’énergie en fonction de la variation du temps de flottation à pH 6 [Al13] = 6,2 10‑4 M; B = 100 mg.
Energy consumption as a function of flotation time at pH 6. [Al13] = 6.2 x 10‑4 M, B = 100 mg.
Temps de flottation (min) |
5 |
10 |
15 |
20 |
25 |
30 |
|---|---|---|---|---|---|---|
Consommation d’énergie × 10+2 (KWh•m‑3) |
18,77 |
39,74 |
56,25 |
75 |
93,75 |
112,5 |
Charge électrique (F•m‑3) |
2,79 |
5,59 |
8,39 |
11,19 |
13,98 |
14,92 |
Densité du courant = 13,14 mA•cm‑2
Current density = 13.14 mA•cm‑2