Résumés
Résumé
Dans le débat sur la décriminalisation du cannabis, ce sont les conséquences de la consommation de cette substance psychoactive qui interpellent les experts. Rarement s’interroge-t-on, toutefois, sur la nature de l’intoxication au cannabis. Or, un survol attentif de la littérature laisse entrevoir de multiples rapports entre les effets du cannabis et la phénoménologie de la schizophrénie.
Communément classé parmi les perturbateurs du système nerveux central, le cannabis possède des propriétés psychotomimétiques. Selon les circonstances, il peut produire des manifestations qui rappellent diverses dimensions de la schizophrénie. Alors que ses effets aigus évoquent les atteintes cognitives des schizophrènes, ses effets chroniques (le controversé syndrome d’amotivation) peuvent ressembler aux symptômes négatifs, et certains de ses effets adverses (la « psychose cannabique ») imitent les symptômes positifs de cette psychopathologie.
Incidemment, les schizophrènes seraient particulièrement sensibles au cannabis. En effet, la probabilité de développer un trouble de consommation de cannabis est environ six fois plus élevée chez le schizophrène que dans la population générale. Divers modèles tentent de rendre compte de cette comorbidité singulière, le principal étant celui de l’automédication. À l’encontre de ce modèle toutefois, la littérature rapporte que la consommation de cannabis accroît régulièrement l’incidence des rechutes psychotiques et des hospitalisations chez les schizophrènes.
Sur le plan biologique, des données préliminaires suggèrent l’existence de perturbations du système des cannabinoïdes endogènes chez le schizophrène. Dans cette foulée, la communauté scientifique espérait que le blocage du récepteur CB1, le principal récepteur des cannabinoïdes, agisse comme antipsychotique. Après l’échec clinique du rimonabant, un antagoniste CB1, la recherche se tourne maintenant vers les inhibiteurs de la recapture de l’anandamide, le cannabinoïde endogène le mieux connu.
Abstract
In the ongoing debate regarding the legal status of cannabis, much emphasis has been put on the consequences of this psychoactive substance. Much less attention has been paid, however, to the very nature of cannabis intoxication. Interestingly, following a close review of the literature, it appears that cannabis pharmacology shares much in common with schizophrenia.
Being a dysleptic, cannabis has psychotomimetic properties. According to the circumstances, it produces effects that remind diverse schizophrenic dimensions. Acutely, cannabis disrupts cognition similarly to what is observed in schizophrenia. Chronically, its effects (the controversial amotivational syndrome) show resemblance with the negative symptoms of this psychopathology. Among its adverse effects, cannabis can induce, in rare occasions, a transient psychosis that mimics the positive symptoms of schizophrenia.
Incidentally, schizophrenic patients seem to be particularly sensitive to cannabis. In fact, they are six times more likely to develop a cannabis disorder, compared to the general population. Different models try to explain this particular comorbidity, the principal one being the self-medication model. Against this hypothesis however, the data currently available demonstrates that cannabis consumption increases the rates of relapses and hospitalisations of schizophrenic patients.
On the biological level, some disturbances of the endogenous cannabinoid system in schizophrenic patients have been shown recently. Along these observations, the scientific community was hoping that the blockade of the CB1 receptor, the principal cannabinoid receptor, would act as an antipsychotic. However, rimonabant, a CB1 antagonist, has failed in a phase II clinical study. Researchers now shift their attention to uptake inhibitors of anandamide, the best known endocannabinoid.
Corps de l’article
Les études épidémiologiques menées depuis le début des années 1990 signalent que la prévalence à vie d’un trouble de consommation (abus ou dépendance) est de près de 50 % chez les schizophrènes (Regier et collaborateurs, 1990). Cette co-occurence fait aujourd’hui l’objet d’un large consensus. En revanche, les raisons qui motivent les schizophrènes à consommer des substances psychoactives (SPA) continuent de nous échapper. Subjectivement, les schizophrènes rapportent consommer ces substances en vue de soulager leur anhédonie, de socialiser et d’apaiser leur anxiété. Ces réponses subjectives militent volontiers en faveur de l’hypothèse de l’automédication, à l’aide de laquelle on explique généralement la co-occurrence schizophrénie – toxicomanie (Khantzian, 1985). Mais objectivement, si on les compare aux schizophrènes abstinents, les schizophrènes toxicomanes ont un profil sociosanitaire plus lourd (Mueser et collaborateurs, 1998).
Rien dans la littérature n’indique que les schizophrènes, comme groupe diagnostique, auraient une préférence marquée pour l’une ou l’autre des SPA, ce qui complexifie notre compréhension de cette comorbidité singulière. On soupçonne seulement que la disponibilité des SPA influe significativement sur leurs choix (Kavanagh et collaborateurs, 2002). Par exemple, les schizophrènes abusent davantage de l’héroïne en Europe qu’en Amérique du Nord, davantage de la cocaïne en milieu urbain qu’en milieu rural, et davantage des amphétamines en Australie qu’aux États-Unis. En dehors de ces fluctuations, on estime que les schizophrènes abusent, dans l’ordre décroissant, de l’alcool, du cannabis et des autres SPA (Dixon, 1999), si l’on exclut ici le tabac.
Parmi ces SPA, le cannabis semble constituer une substance à laquelle les schizophrènes seraient sensibles. D’abord, parmi les psychopathologies de l’axe I du DSM-IV-TR (Diagnostic and Statistical Manual of Mental Disorders, 4e édition révisée), c’est chez le schizophrène que la consommation de cannabis est le plus fréquemment problématique. Par contraste, l’alcool est davantage problématique en présence de troubles affectifs (uni et bipolaires) et de troubles anxieux que chez les schizophrènes. De plus, le risque de développer un trouble de consommation de cannabis est environ six fois plus élevé chez le schizophrène que dans la population générale (Karam et collaborateurs, 2001 et 2002; Regier et collaborateurs, 1990).
C’est à ce lien entre la schizophrénie et le cannabis que nous nous intéressons dans le présent article, en portant une attention particulière au système des cannabinoïdes endogènes, lequel relaie dans le cerveau les effets du cannabis.
Les propriétés psychotomimétiques du cannabis
La consommation de cannabis par les schizophrènes est en quelque sorte paradoxale, car le cannabis peut produire, chez les consommateurs sains, des effets qui s’apparentent à ceux du monde de la psychose en général, et de la schizophrénie en particulier. Ces propriétés psychotomimétiques du cannabis se manifestent tant dans ses effets aigus et chroniques que dans les effets adverses qui accompagnent sa consommation.
Bien qu’il soit généralement classé parmi les perturbateurs du système nerveux central, en raison des altérations de la conscience qu’il induit, le cannabis produit d’autres effets, stimulants et dépresseurs, qui compliquent sa classification comme substance psychoactive. Ces effets aigus du cannabis sont modulés par la personnalité du consommateur ainsi que par les circonstances de consommation, mais ils se manifestent généralement en deux phases successives (Ben Amar et Léonard, 2002). Au cours de la première phase, celle de la stimulation, le consommateur ressent une euphorie modérée, sa pensée se fragmente, il se sent sociable, pouvant être enclin à des éclats de rire. Il a aussi l’impression d’une plus grande acuité sensorielle. Les sons et les couleurs, aussi ordinaires soient-ils, deviennent attrayants à ses yeux. Sa libido et ses sensations sexuelles peuvent, quant à elles, être amplifiées.
Pendant la seconde phase, la phase de torpeur, on observe chez le consommateur un ralentissement psychomoteur significatif. C’est à cette seconde phase que sont habituellement associées les atteintes cognitives produites par le cannabis, comme les problèmes de concentration. Selon notre expérience clinique, le caractère agréable de cette seconde phase pourrait provenir de l’état de détachement induit chez le consommateur, un état de dissociation par rapport aux tracas quotidiens et aux souvenirs aversifs.
Outre ses effets stimulants et dépresseurs, la consommation de cannabis s’accompagne d’altérations de la perception du temps et de l’espace. De plus, le cannabis stimule l’appétit (« munchies ») et possède des propriétés anxiolytiques, analgésiques et antiémétiques (Martin et collaborateurs, 2002). De tous ces effets, la fragmentation de la pensée, les atteintes cognitives de même que les altérations perceptuelles sont les manifestations du cannabis qui rappellent le plus étroitement la complexe symptomatologie schizophrénique (tableau 1).
Tableau 1
Principaux symptômes associés à la schizophrénie
* Les symptômes dissociatifs ne sont pas généralement inclus dans la liste des symptômes caractéristiques de la schizophrénie.
** Les symptômes extrapyramidaux (parkinsonisme, dystonie, etc.) sont essentiellement secondaires à l’action des antipsychotiques.
Les études expérimentales
Certaines études menées expérimentalement auprès de volontaires sains accréditent l’hypothèse d’une parenté entre les phénoménologies respectives de l’intoxication au cannabis et de la schizophrénie. D’abord, ces études démontrent que le cannabis détériore la mémoire à court terme et porte atteinte à la vigilance attentionnelle (Iversen, 2000), deux fonctions cognitives qui se révèlent altérées chez le schizophrène. En plus de ces impacts cognitifs, le cannabis produit des perturbations perceptuelles qui ne sont pas étrangères au monde de la psychose. Le groupe de Leweke, en Allemagne, est effectivement parvenu à démontrer, à l’aide d’un paradigme de perception de la profondeur (« binocular depth inversion »), que le principal constituant psychoactif du cannabis, le delta-9-tétrahydrocannabinol (Δ9-THC), induisait chez le volontaire sain des illusions visuelles similaires à celles observées chez le schizophrène (Schneider et collaborateurs, 1998 ; Emrich et collaborateurs, 1997). Le groupe de Mathew est quant à lui parvenu à faire la preuve que le Δ9-THC, administré oralement ou par voie intraveineuse, induisait des états de dépersonnalisation. À l’aide de la tomographie à positrons (« PET scan »), ce groupe a démontré, de surcroît, que l’intensité de ces symptômes corrélait avec l’augmentation du débit sanguin cérébral dans le cortex cingulaire et le cortex frontal (Mathew et collaborateurs, 1999 et 1993). Même si les symptômes dissociatifs ne sont pas caractéristiques de la schizophrénie, on dénote régulièrement de tels symptômes chez les schizophrènes, surtout en association avec les symptômes positifs de cette psychopathologie.
Toujours dans un contexte expérimental, l’équipe de D’Souza a évalué l’impact psychologique de l’administration de Δ9-THC (par voie intraveineuse) à des volontaires sains, à l’aide de la PANSS (« Positive and Negative Symptoms Scale »), une évaluation psychiatrique standardisée des symptômes de la schizophrénie (Kay et collaborateurs, 1987). Les résultats préliminaires de leur recherche démontrent que le cannabis peut induire, surtout à de fortes doses, des états psychologiques similaires aux divers symptômes de la schizophrénie chez les sujets sains, reproduisant avec une fidélité particulière les délires paranoïdes et la désorganisation conceptuelle de cette psychopathologie (D’Souza et collaborateurs, 1998).
Cannabis et schizotypie
Outre ces expériences menées en laboratoire, des études naturalistes réalisées auprès de consommateurs réguliers de cannabis corroborrent l’idée d’une parenté entre les effets du cannabis et les symptômes de la schizophrénie. Ces études, très récentes, démontrent qu’il existe une corrélation positive entre la consommation de cannabis et la schizotypie (tableau 2). De façon générale, plus un sujet consomme régulièrement du cannabis, plus il présente un ensemble de traits associés à la schizophrénie, que ce soit des aberrations perceptives, de l’anhédonie, des pensées magiques ou du retrait social. Se basant sur des statistiques corrélationnelles, ces études ne permettent pas toutefois de déterminer si les traits schizotypiques observés sont primaires ou secondaires à la consommation de cannabis. Il demeure possible, en effet, que ces sujets, ayant des traits schizotypiques, soient prédisposés à consommer davantage de cannabis.
Tableau 2
Cannabis et schizotypie
La « psychose cannabique »
Les propriétés psychotomimétiques du cannabis se manifestent aussi dans les effets adverses qui accompagnent sa consommation. Même si le cannabis possède des propriétés anxiolytiques, les effets adverses le plus fréquemment observés auprès des consommateurs sont les états de panique. La consommation de cette SPA peut s’accompagner, par ailleurs, d’états de dépersonnalisation, de délires paranoïdes et d’hallucinations. Bien que le phénomène soit rare, il arrive même que le cannabis induise d’authentiques psychoses (Johns, 2001 ; Thomas, 1996).
Le statut de ces troubles psychotiques induits par le cannabis fait présentement l’objet de deux débats centraux. D’abord, on ignore si le cannabis provoque des psychoses seulement chez des sujets qui présentent préalablement des traits schizotypiques ou s’il peut aussi provoquer de tels épisodes chez des consommateurs sans vulnérabilité. Afin d’éviter toute confusion, il y a lieu de distinguer deux types de troubles psychotiques induits par le cannabis : la psychose toxique et la psychose fonctionnelle (McGuire et collaborateurs, 1994 ; Mathers et Ghodse, 1992 ; Chaudry et collaborateurs, 1991 ; Rottanburg et al., 1982 ; Thacore et Shukla, 1976). D’une durée maximale de deux semaines, la psychose fonctionnelle induite par le cannabis se caractérise par des délires francs (paranoïa, grandiosité, etc.), de la dépersonnalisation, des éléments d’hypomanie, une légère désorganisation de la pensée, un léger émoussement de l’affect et des symptômes de la lignée de Schneider (intrusion et diffusion de la pensée). Cette psychose fonctionnelle s’accompagne parfois d’hallucinations, tout autant visuelles qu’auditives. À la différence de la psychose fonctionnelle, la psychose toxique au cannabis, d’une durée de quelques jours en général, se présente avec des éléments d’organicité, c’est-à-dire de la confusion et de la désorientation. Or, selon les meilleures données dont nous disposons, il semble que le cannabis puisse induire des psychoses toxiques, à de très fortes doses, chez des consommateurs inexpérimentés sans vulnérabilité psychotique, alors que la psychose fonctionnelle semble se manifester essentiellement chez des consommateurs présentant préalablement des traits schizotypiques (Johns, 2001). Il importe toutefois de mentionner qu’en ce domaine, la plupart des études publiées comportent des failles méthodologiques, de nature anecdotique ou rétrospective, et ne documentent que rarement les antécédents psychiatriques des cas rapportés (Imade et Ebie, 1991 ; Bernhardson et Gunne, 1972).
Le second débat porte sur le statut diagnostique du trouble psychotique induit par le cannabis. Il fut lancé par Ghodse (1986), qui, le premier, proposa que ce trouble pourrait constituer une entité diagnostique distincte des psychoses endogènes, y compris la schizophrénie. Encore aujourd’hui, ce débat demeure ouvert. Il aura toutefois eu l’avantage d’entraîner des recherches cliniques rigoureuses, où l’on a comparé les phénoménologies respectives du trouble psychotique induit par le cannabis et de la schizophrénie à l’aide d’instruments d’évaluation des symptômes de la schizophrénie (ex. : PANSS) (Nuñez et Gurpegui, 2002 ; Basu et collaborateurs, 1999). Depuis, ces études comparatives ont mis en lumière d’importantes similitudes, mais aussi des différences non négligeables entre la « psychose cannabique » et la symptomatologie schizophrénique (tableau 3).
Tableau 3
Profil comparatif de la schizophrénie et de la psychose cannabique
Le syndrome d’amotivation
En plus des manifestations psychotomimétiques qui accompagnent sa consommation et marquent ses effets adverses, le cannabis produit à long terme des effets qui ne paraissent pas étrangers, eux non plus, à la schizophrénie. D’abord, l’électrophysiologie révèle que l’amplitude des potentiels évoqués P300 est réduite chez les consommateurs chroniques de cannabis, de façon analogue à ce qui est observé chez les schizophrènes (Solowij et collaborateurs, 1991). Mais surtout, le cannabis semble pouvoir induire, à long terme, un syndrome d’amotivation. Tel que décrit cliniquement, ce syndrome s’accompagne d’apathie, de passivité, d’indifférence, d’un manque d’ambition ainsi que d’une perte d’intérêt (Johns, 2001). En lien avec la schizophrénie, la particularité de ce syndrome réside dans le fait qu’il s’apparente aux symptômes négatifs de la schizophrénie (tableau 1). Or, la communauté scientifique ne dispose toujours pas d’un modèle pharmacologique valide de ces symptômes chroniques, qui résistent davantage à la thérapie antipsychotique que les symptômes positifs. Alors que la psychose amphétaminique (observée après une période de sensibilisation) reproduit fidèlement la symptomatologie positive de la schizophrénie, et que la kétamine (un anesthésique dissociatif dérivé de la phencyclidine) reproduit nombre de déficits cognitifs frontaux associés à cette psychopathologie (Potvin et collaborateurs, 2003a), la modélisation des symptômes négatifs affiche un net retard. Le syndrome amotivationnel associé à la consommation chronique de cannabis pourrait constituer un intéressant modèle de ces symptômes. Il importe toutefois de mentionner que ce syndrome demeure controversé, car on ignore toujours si le tableau clinique observé serait attribuable aux neuroadaptations induites à long terme par le cannabis ou s’il ne serait pas plutôt le reflet d’une certaine contre-culture de l’oisiveté.
Les effets du cannabis chez le schizophrène
En vertu des propriétés psychotomimétiques que possède le cannabis, les raisons qui incitent les schizophrènes à consommer ce psychotrope sont des plus intrigantes, tant sur le plan scientifique que clinique. Afin de circonscrire ces raisons, des recherches cliniques ont été entreprises, dans la perspective de l’automédication. Celles-ci ont mis en lumière certaines observations robustes, valables pour l’ensemble des SPA. Comparativement aux schizophrènes abstinents, les schizophrènes toxicomanes semblent, en effet, posséder les caractéristiques suivantes (Mueser et collaborateurs, 1998 ; Potvin et collaborateurs, 2003b) :
ils sont en moyenne moins âgés ;
ils sont plus fréquemment de sexe masculin ;
ils prennent moins régulièrement leur médication ;
ils font davantage de rechutes psychotiques et sont plus fréquemment hospitalisés ;
ils ont plus de problèmes de logement et d’emploi ;
ils sont plus impulsifs et violents ;
ils sont plus dépressifs et suicidaires ;
ils ont plus de problèmes de santé.
Quant au lien entre la schizophrénie et la consommation de cannabis, la littérature est moins robuste. La seule évidence clairement établie, à l’aide d’études prospectives, est la plus haute fréquence de rechutes psychotiques et d’hospitalisations observées chez les schizophrènes qui consomment du cannabis que chez les abstinents (Linszen et collaborateurs, 1994 ; Martinez-Arvelo et collaborateurs, 1994). Par ailleurs, certaines données suggèrent que les schizophrènes consommateurs de cannabis souffriraient plus fréquemment de dyskinésie tardive (Zaretzky et collaborateurs, 1993), laquelle se caractérise par des mouvements involontaires et répétitifs, surtout de la bouche. Ils seraient, de plus, légèrement moins performants au test de Stroop, lequel évalue certaines fonctions cognitives frontales (Liraud et Verdoux, 2002).
En ce qui concerne l’impact de la consommation de cannabis sur les symptômes positifs et négatifs de la schizophrénie, la littérature actuelle n’est pas concluante. Si certaines études comparatives suggèrent que le schizophrène consommateur de cannabis aurait des symptômes négatifs moins sévères (Bersani et collaborateurs, 2002a ; Peralta et Cuesta, 1992), elles ne corroborent pas toutes une telle observation (Dervaux et collaborateurs, 2003). De plus, la direction du lien observé demeure inconnue. Il se pourrait, en effet, que des symptômes négatifs moins sévères puissent aider les schizophrènes à s’immiscer dans les réseaux sociaux où circulent les SPA. Dans le cas des symptômes positifs, certaines études suggèrent que la consommation de cannabis pourrait les accentuer (Caspari, 1999 ; Negrete et collaborateurs, 1986), mais ce ne sont pas toutes les recherches qui rapportent de tels résultats (Bersani et collaborateurs, 2002b).
L’ambiguïté des données publiées à ce jour renvoie à une question générique, à savoir qu’on ignore toujours si c’est la vulnérabilité à la psychose qui prédispose à la consommation de cannabis, ou, au contraire, si c’est la consommation de cannabis qui accroît la vulnérabilité à la psychose.
Les études longitudinales
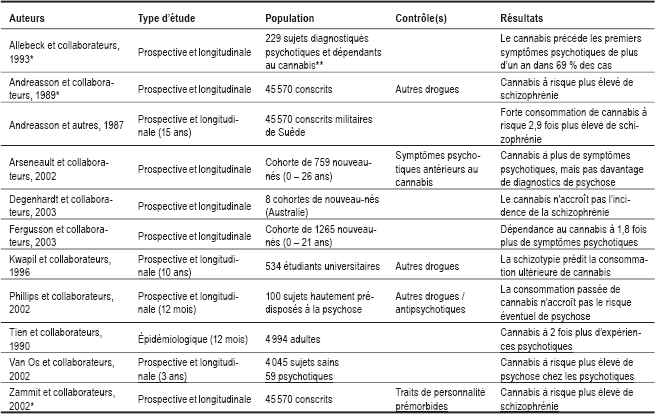
Seules des études longitudinales peuvent éclairer le sens du lien observé entre la consommation de cannabis et la psychose. Depuis les années 1980, quelques études répondant à cette exigence méthodologique ont été entreprises (tableau 4). De celles-ci, la plus citée est celle du groupe d’Andreasson (1987), une vaste étude prospective menée auprès de 45 570 conscrits de l’armée suédoise de 1969 et 1970. Au sein de cette cohorte, 9,4 % des conscrits avaient déjà consommé du cannabis, dont 1,7 % plus de 50 fois. En consultant les dossiers médicaux de ces conscrits 15 ans plus tard, on a observé que le risque de développer la schizophrénie se révélait 2,9 fois plus élevé chez les plus grands consommateurs de cannabis de la cohorte évaluée. Depuis, des critiques sévères ont été adressées envers cette étude charnière (Hall et Degenhardt, 2000) :
l’étude documente la consommation de cannabis au moment de la conscription, mais pas au cours des 15 années suivantes ;
l’étude ne contrôle pas l’influence d’autres SPA, comme les amphétamines, lesquelles peuvent induire des psychoses similaires à la schizophrénie paranoïde ;
établis en consultant des dossiers médicaux, les diagnostics de schizophrénie peuvent avoir été confondus avec des psychoses induites ;
l’étude ne documente pas les traits de personnalité antérieurs à la conscription. Elle n’exclut donc pas la possibilité que des traits prémorbides schizotypiques puissent avoir incité certains sujets à consommer du cannabis en guise d’automédication.
Les collaborateurs d’Andreasson ont tenté, depuis, de répondre à ces critiques, reprenant leurs analyses statistiques premières (Zammit et collaborateurs, 2002 ; Allebeck et collaborateurs, 1993 ; Andreasson et collaborateurs, 1989). Tout récemment, d’autres études longitudinales mieux contrôlées ont été entreprises par d’autres groupes, auprès notamment de cohortes de nouveau-nés (tableau 4). Parmi ces études, seule celle réalisée par Van Os et son groupe (2002) est clairement compatible avec les observations premières d’Andreasson. En effet, cette étude prospective et longitudinale est parvenue à démontrer que la consommation de cannabis augmentait légèrement l’incidence de psychose chez les sujets sans histoire psychotique antérieure, alors qu’elle augmentait significativement cette même incidence chez les sujets présentant une vulnérabilité psychotique pré-existante. Trois autres études, celles de Fergusson (2003), d’Arsenault (2002) et de Tien (1990), sont parvenues, quant à elles, à des résultats plus nuancés. Ces dernières recherches ont permis d’illustrer que la consommation de cannabis augmentait, à terme, le nombre de symptômes psychotiques des consommateurs, sans toutefois accroître le nombre de diagnostics de psychose. Enfin, deux études, celles des équipes de Degenhardt (2003) et de Phillips (2002), sont parvenues à des résultats négatifs. À cet égard, la recherche de l’équipe de Phillips est particulièrement significative, car elle fut réalisée auprès de sujets prédisposés génétiquement à la psychose, en raison d’une histoire familiale de cette maladie.
Les études citées ici se butent toutes à un problème général, celui de la prévalence de la schizophrénie, qui est d’environ 1 % à l’échelle mondiale, et qui ne varie pas, de pays en pays, en fonction de la popularité nationale de la consommation de cannabis (Jablensky, 1995). Les données recueillies dans le cadre de ces études longitudinales, tout aussi robustes soient-elles, ne permettent donc pas de conclure que le cannabis accroît, comme tel, le risque de développer la schizophrénie. Elles suggèrent, en revanche, qu’à long terme, le cannabis pourrait agir comme un puissant déclencheur (« trigger ») de psychoses latentes chez les consommateurs présentant une vulnérabilité psychotique (Hambrecht et Hafner, 2000). Incidemment, chez le rongeur, l’administration chronique de cannabis favorise le développement de la sensibilisation aux amphétamines (Gorritti et collaborateurs, 1999), qui constitue, encore aujourd’hui, le meilleur modèle animal de la psychose.
Tableau 4
Cannabis comme facteur de risque de la schizophrénie
* Suite d’Andreasson et collaborateurs, 1987.
** Indépendamment de l’occurrence temporelle des diagnostics.
Quelques éléments de biologie
La robustesse de l’association schizophrénie-cannabis suggère que des facteurs biologiques pourraient rendre compte, partiellement du moins, de la sensibilité des schizophrènes aux effets du cannabis. La récente découverte du système des cannabinoïdes endogènes (CBE), sur lequel agit le cannabis, rend aujourd’hui possible un tel ordre d’explication.
Les CBE
Composé d’au moins trois neuromédiateurs lipidiques, soit l’anandamide (arachidonlyléthanolamide), le 2-arachidonylglycérol (2-AG) et le palmityléthanolamide, ainsi que d’un minimum de deux récepteurs, soit CB1 et CB2, le système des CBE est l’un des plus abondants dans le système nerveux central (SNC). On détecte, notamment, de fortes concentrations des récepteurs CB1 dans des régions aussi diverses que les aires associatives du cortex (prédominance hémisphérique gauche), l’hippocampe et ses structures associées, l’amygdale ainsi que les noyaux gris centraux (incluant le noyau accumbens). Par ailleurs, on les retrouve, bien qu’en moindres concentrations, dans le thalamus, l’hypothalamus, le cervelet et, surtout, dans les aires de la perception de la douleur (nociception). Quant aux récepteurs CB2, ils sont localisés surtout en périphérie, dans le système immunitaire, mais on les retrouve également dans les cellules gliales du SNC (tableau 5) (Ameri, 1999).
Ainsi distribué, ce système serait impliqué à la fois dans les fonctions cognitives supérieures, la mémoire à court terme, le contrôle inhibiteur du mouvement, le soulagement de l’anxiété, les états d’hédonie, ainsi que dans la protection neuronale, la nociception, la thermorégulation et la stimulation de l’appétit. En périphérie, ce système interviendrait dans le soulagement des inflammations et dans les phénomènes d’immunosuppression (Martin et collaborateurs, 2002) (tableau 5).
Tableau 5
Neuroanatomie fonctionnelle des récepteurs CB1 et CB2
Schizophrénie et CBE
En plus de relayer les effets pharmacologiques du cannabis, le système des CBE pourrait être impliqué dans la physiopathologie de la schizophrénie. Quoique préliminaires, certaines observations militent en faveur de cette hypothèse :
le système des CBE est fortement concentré dans des régions cérébrales qu’on estime perturbées chez le schizophrène, comme le cortex préfrontal, l’hippocampe ainsi que les noyaux gris centraux ;
les taux d’anandamide et de palmityléthanolamide, tels que mesurés dans le liquide céphalo-rachidien, sont environ deux fois plus élevés chez les schizophrènes que chez les volontaires sains (Leweke et collaborateurs, 1999) ;
une étude post-mortem indique que la densité des récepteurs CB1, mesurée à l’aide de la tomographie à positrons, est altérée dans le cortex préfrontal dorsolatéral des schizophrènes (Dean et collaborateurs, 2001) ;
une association existerait entre la schizophrénie et le polymorphisme du gène encodant CB1 (Leroy et collaborateurs, 2001) ;
chez le rongeur, le rimonabant (SR141716A), un antagoniste CB1, se comporte comme les antipsychotiques de seconde génération (clozapine, olanzapine, quétiapine et rispéridone), lorsqu’il est administré de façon chronique (Alonso et collaborateurs, 1999).
Schizophrénie et dopamine
Parmi les hypothèses neurochimiques de la schizophrénie, l’hypothèse dopaminergique est la mieux appuyée par les faits empiriques. Historiquement, cette hypothèse a été formulée à la suite des deux observations cliniques suivantes :
en facilitant la libération de dopamine dans le SNC, les amphétamines peuvent induire, après une période de sensibilisation, une psychose qui s’apparente à la schizophrénie paranoïde, et ce, chez des sujets sans vulnérabilité préalable (Bell, 1973) ;
tous les antipsychotiques connus à ce jour sont des antagonistes des récepteurs D2 de la dopamine (Seeman et collaborateurs, 1976).
À la suite de l’observation de cette psychose amphétaminique, des études spécialisées menées chez le rongeur ont révélé que la sensibilisation aux amphétamines se traduisait par une hyperdopaminergie dans le système mésolimbique de récompense, qui se projette de l’aire tegmentaire ventrale (ATV) au noyau accumbens (NAc). De plus, ces travaux ont démontré que la sensibilité accrue du système de renforcement serait elle-même secondaire à une hypodopaminergie dans le système mésocortical, lequel se projette de l’ATV au cortex préfrontal. Suivant ce modèle animal, l’hypodopaminergie mésocorticale pourrait rendre compte des symptômes négatifs et des déficits cognitifs frontaux de la schizophrénie, alors que l’hyperdopaminergie mésolimbique serait associée aux symptômes positifs (Grace, 1993). Depuis, des données recueillies chez l’être humain sont venues corroborer le second volet de l’hypothèse dopaminergique. En effet, il est maintenant démontré, par la tomographie à positrons (PET) et la tomoscintigraphie (SPECT), que la libération striatale de dopamine, en réponse à l’administration expérimentale d’amphétamines, est plus élevée chez le schizophrène que chez le volontaire sain, en particulier au cours de la phase aiguë de la psychose (Laruelle et Abi-Dargham, 1999 ; Breier et collaborateurs, 1997).
Cannabis et dopamine
Perturbés chez le schizophrène, les systèmes dopaminergiques sont modulés de façon significative par les agonistes CB1, y compris le Δ9-THC. En effet, il est établi, chez le rongeur, que l’administration aiguë de Δ9-THC facilite la libération de dopamine dans le cortex préfrontal, en plus de dépolariser les neurones dopaminergiques de l’ATV et de faciliter ainsi la libération de dopamine dans le NAc (Gardner, 1998). En cela, le Δ9-THC se révèle identique aux autres SPA. La recherche moléculaire démontre pourtant que les récepteurs CB1 ne sont pas directement localisés sur les neurones à dopamine dans le SNC. À l’évidence, le Δ9-THC module indirectement le système mésocorticolimbique. Des données animales suggèrent que le Δ9-THC exercerait son effet modulateur par la voie de l’acide gamma-amino-butyrique (GABA).
Les modèles étiologiques
Automédication ou vulnérabilité biologique
Dans leur ensemble, les données biologiques présentées ici semblent cohérentes avec l’hypothèse de l’automédication formulée par Khantzian (1985). Construite sur la notion de renforcement négatif, cette hypothèse postule que les toxicomanes cherchent non pas à éprouver du plaisir, mais à soulager certains de leurs malaises (tableau 6). Dans le cas qui nous concerne, cette hypothèse incite à penser qu’en facilitant la libération de dopamine dans le système mésocortical, le cannabis risque de soulager les symptômes négatifs et les déficits cognitifs associés à la schizophrénie.
De façon générale, l’hypothèse de l’automédication ne va pas de soi. D’abord, les schizophrènes toxicomanes ne prennent pas régulièrement leurs médicaments. De plus, les rechutes psychotiques induites par les SPA ne les découragent pas de consommer ce produit. Enfin, cette hypothèse suggère qu’une fois la psychose contrôlée, la consommation devrait s’endiguer. Dans les faits, seuls les programmes thérapeutiques ciblant à la fois la psychose et l’addiction se révèlent efficaces (Drake et collaborateurs, 1998). Dans le cas particulier du cannabis, il importe d’ajouter que ce psychotrope détériore en fait les fonctions cognitives frontales chez l’être humain. Certes, les agonistes CB1 exercent un effet facilitateur sur la dopamine dans le cortex préfrontal. Mais ils inhibent, par ailleurs, la libération d’acétylcholine et de glutamate (Stella et Piomelli, 2001), deux neurotransmetteurs jouant un rôle critique dans les fonctions cognitives frontales.
Construite sur la notion de renforcement positif, une hypothèse de rechange, celle de la vulnérabilité biologique (tableau 6), postule que la sensibilité des schizophrènes aux SPA serait, en fait, endogène à cette psychopathologie. En facilitant la libération de dopamine dans le système de récompense, lequel est déjà hyperactif chez les schizophrènes, les SPA seraient particulièrement renforçantes auprès de cette population (Chambers et collaborateurs, 2001). Le cannabis n’échapperait pas à cette règle. Incidemment, une étude de cas réalisée par des chercheurs en imagerie cérébrale suggère que le cannabis, en facilitant la libération subcorticale de dopamine, procure d’abord une sensation hédonique au schizophrène, avant d’exacerber ses symptômes psychotiques (Voruganti et collaborateurs, 2002).
Tableau 6
Schizophrénie et toxicomanie : modèles étiologiques.
* SEP = symptômes extrapyramidaux : akathisie, dyskinésies tardives, dystonie, tremblement périoral et parkinsonisme.
Le modèle dissociatif
En mettant l’accent sur les interactions dopamine-CBE, la littérature suggère que les schizophrènes abuseraient du cannabis en raison de ses propriétés stimulantes. Or, si tel était le cas, le schizophrène devrait afficher une préférence marquée pour les psychostimulants, et non pas pour le cannabis.
La phénoménologie offre une alternative à ce mode de pensée. Suivant cette perspective, on peut émettre l’hypothèse que le schizophrène ne cherche pas à proprement parler à soigner ses symptômes en consommant du cannabis, mais plutôt à prendre une distance par rapport à ceux-ci (Potvin et collaborateurs, 2003b) (tableau 6). Soumis au bombardement quotidien de la psychose, le schizophrène pourrait être attiré par les propriétés dysleptiques du cannabis. Dans l’altération des états de conscience induite par ce psychotrope, il trouverait un répit que sa condition psychologique ne peut lui procurer, un répit face à l’angoisse de morcellement. À l’encontre de l’hypothèse de l’automédication, qui mise sur la phase de stimulation de l’intoxication au cannabis, la présente hypothèse mise plutôt sur la phase de torpeur. La seule preuve, indirecte, de cette hypothèse provient de l’observation de symptômes dissociatifs plus prononcés chez les schizophrènes toxicomanes que chez les abstinents (Soyka et collaborateurs, 2001).
Perspectives thérapeutiques
Sachant que le cannabis possède des propriétés psychotomimétiques et que le système des CBE semble perturbé chez le schizophrène, la communauté scientifique espérait que le rimonabant (SR161716A), un antagoniste CB1, agisse comme antipsychotique, en dépit de son absence d’affinité pour les récepteurs D2 de la dopamine. Pourtant, en étude clinique de phase II, le rimonabant ne s’est pas révélé supérieur au placebo, en double aveugle, dans le traitement des symptômes positifs et négatifs de la schizophrénie (Arvanitis, 2001).
Pour l’instant, l’échec clinique du rimonabant auprès des schizophrènes demeure inexpliqué. Mais en raison de cet échec, il devient plus prudent de concevoir les dysfonctions du système des CBE observées chez le schizophrène comme une réponse adaptative secondaire à la psychose.
L’échec clinique du rimonabant ne met pas fin à l’espoir du développement d’une médication antipsychotique agissant sur le système des CBE, car il existe des moyens d’intervenir sur ce système autres que le blocage des récepteurs CB1. Étant des substances lipophiles, les CBE ne se trouvent pas à l’intérieur des neurones, mais dans les membranes neuronales, lesquelles sont riches en phospholipides. Sur demande, les neurones peuvent libérer des CBE dans la fente synaptique. Par exemple, lorsqu’il y a libération de dopamine dans le SNC, à rebours, il y a libération d’anandamide. Or, cette libération produit généralement des effets inhibiteurs, contraires aux effets stimulants induits par les agonistes dopaminergiques (Giuffrida et collaborateurs, 1999). De façon intrigante, ces données laissent entrevoir que l’évolution des espèces aurait prévu un cycle naturel d’hypervigilance, relayé par la dopamine, et d’hypovigilance, lequel serait au contraire relayé par les CBE.
Après libération dans la fente synaptique, l’excès d’anandamide peut être recapté par son propre transporteur (Beltramo et collaborateurs, 2000), au même titre que la dopamine, la sérotonine et la noradrénaline. Récemment, des inhibiteurs de la recapture de l’anandamide ont été synthétisés par l’équipe de Piomelli, suscitant l’espoir que de tels agents puissent traiter diverses neuropathologies associées à une hyperdopaminergie, y compris la psychose. Incidemment, des rapports anecdotiques suggèrent que le cannabidiol aurait des effets antipsychotiques. Constituant naturel du Cannabis sativa, le cannabidiol renverse les effets du Δ9-THC chez le rongeur. Or, des données récentes indiquent que le cannabidiol agit précisément comme inhibiteur de la recapture de l’anandamide (Mechoulam et collaborateurs, 2002).
Considérant les propriétés psychotomimétiques du cannabis, il pourrait sembler étonnant que des inhibiteurs de la recapture de l’anandamide puissent exercer, théoriquement du moins, des effets antipsychotiques. Il importe toutefois ici de rappeler une notion fondamentale de neuropharmacologie, à savoir que les agonistes des récepteurs d’un neuromédiateur donné n’ont pas forcément les mêmes effets que les inhibiteurs de la recapture de ce même transmetteur. C’est le cas, notamment, des inhibiteurs de la recapture de la sérotonine, lesquels produisent des effets antidépresseurs, alors que les agonistes des récepteurs 5-HT2A de la sérotonine produisent, quant à eux, des effets hallucinogènes (Nestler et collaborateurs, 2001).
Conclusion
Appartenant à la classe des perturbateurs du système nerveux central, le cannabis possède d’importantes propriétés psychotomimétiques. Selon les circonstances, il produit des manifestations qui rappellent diverses dimensions de la phénoménologie schizophrénique. Alors que ses effets aigus évoquent les atteintes cognitives des schizophrènes, ses effets chroniques (le controversé syndrome d’amotivation) peuvent ressembler aux symptômes négatifs, et ses effets adverses (la « psychose cannabique ») peuvent imiter les symptômes positifs de cette psychopathologie.
Incidemment, les schizophrènes semblent particulièrement sensibles aux effets du cannabis. En effet, la probabilité de développer un trouble de consommation de cannabis est environ six fois plus élevée chez le schizophrène que dans la population générale. Divers modèles tentent de rendre compte de cette comorbidité singulière, le principal étant celui de l’automédication. À l’encontre de ce modèle, toutefois, la littérature rapporte que la consommation de cannabis accroît régulièrement l’incidence des rechutes psychotiques et des hospitalisations des schizophrènes. Elle indique, de plus, que le cannabis pourrait agir comme déclencheur de psychoses latentes chez les consommateurs vulnérables, qui présentent des traits schizotypiques.
Sur le plan biologique, la découverte récente du système des cannabinoïdes endogènes, par la voie duquel le cannabis manifeste ses effets, laisse entrevoir un recoupement étroit entre la pathophysiologie de la schizophrénie et les mécanismes d’action du cannabis. Des données préliminaires suggèrent, en effet, l’existence de perturbations du système des CBE chez le schizophrène. Dans cette foulée, la communauté scientifique espérait que le blocage du récepteur CB1, le principal récepteur des cannabinoïdes, agisse comme antipsychotique. Après l’échec clinique du rimonabant, un antagoniste CB1, la recherche se tourne maintenant vers les inhibiteurs de la recapture de l’anandamide, le cannabinoïde endogène le mieux connu.
Parties annexes
Notes
Références
- Allebeck, P., Adamson, C., Engström, A., & Rydberg, U. (1993). Cannabis and schizophrenia: A longitudinal study of cases treated in Stockholm County. Acta Psychiatr Scand, 88, 21-24.
- Alonso, R., Voutsinos, B., Fournier, M., Labie, C., Steinberg, R., Souilhac, J., et al. (1999). Blockade of cannabinoid receptors by SR141716 selectively increases for expression in rat mesocortical areas via reduced D2 function. Neuroscience, 91(2), 607-620.
- Ameri, A. (1999). The effects of cannabinoids on the brain. Progr Neurobiol, 58, 315-338.
- Andreasson, S., Allebeck, P., & Rydberg, U. (1989). Schizophrenia in users and nonusers of cannabis: A longitudinal study in Stockholm County. Acta Psychiar Scand, 79, 505-510.
- Andreasson, S., Allebeck, P., Engström, A., & Rydberg, U. (1987). Cannabis and schizophrenia: A longitudinal study of Swedish conscripts. Lancet, 2(8574), 1483-1486.
- Arseneault, S., Cannon, M. R., Murray, R., Caspi, A., & Moffitt, T. E. (2002). Cannabis use in adolescence and risk for adult psychosis: Longitudinal prospective study. British Medical Journal, 325, 1212-1213.
- Arvanitis, L., Bauer, D., & Rein, W. (2001). Efficacy and tolerability of four novel compounds in schizophrenia: Results of the material project [abstract book] (p. 178). 40th Annual meeting of American College of Neuropsychopharmacology.
- Basu, D., Malhotra, A., Bhagat, A., & Varma, V. K. (1999). Cannabis psychosis and acute schizophrenia. Eur Addict Res, 71-73.
- Bell, D. S. (1973). The experimental reproduction of amphetamine psychosis. Arch Gen Psychiatry, 29, 35-40.
- Beltramo, M., Rodriguez de Fonseca, R., Navarro, M., Calignano, A., Gorritti, M. A., Grammatikopoulos, G., et al. (2000). Reversal of D2 receptors responses by an anandamide transport inhibitor. J Neurosci, 20(9), 3401-3407.
- Ben Amar, M., & Léonard, L. (2002). Chapitre 16 : Cannabis. In L. Léonard & M. Ben Amar (Éds.), Les psychotropes : Pharmacologie et toxicomanie (pp. 571-627). Montréal : Les Presses de l'Université de Montréal.
- Bernhardson, G., & Gunne, L. M. (1972). Forty-six cases of psychosis in cannabis users. International Journal of Addictions, 7(1), 9-16.
- Bersani, G., Orlandi, V., Gherardelli, S., & Pancheri, P. (2002b). Cannabis and neurological soft signs in schizophrenia: Absence of relationship and influence on psychopathology. Psychopathology, 35, 289-295.
- Bersani, G., Orlandi, V., Kotzalidis, G. D., & Pancheri, P. (2002a). Cannabis and schizophrenia: Impact on onset, course, psychopathology and outcomes. Eur Arch Psychiatry Clin Neurosci, 252, 86-92.
- Breier, A., Su, T. P., Saunders, R., Carson, R. E., Kolachana, B. S., & coll. (1997). Schizophrenia is associated with elevated amphetamine-induced synaptic dopamine concentrations: evidence from a novel positron emission tomography. Proc Natl Acad Sci, 94, 2569-2574.
- Caspari, D. (1999). Cannabis and schizophrenia: Results of a follow-up study. Eur Arch Psychiatry Clin Neurosci, 249, 45-49.
- Chambers, A. R., Krystal, J. H., & Self, D. W. (2001). A neurobiological basis for substance abuse comorbidity in schizophrenia. Biol Psychiatry, 50, 71-83.
- Chaudry, H. R., Moss, H. B., Bashir, A., & Suliman, T. (1991). Cannabis psychosis following bhang ingestion. Brit J Addiction, 86, 1065-1081.
- D'Souza, C. D., Belger, A., Ali-Saab, W., Adams, S., Gil, R., Larvey, K., et al. (1998). Dose-response of THC effects in schizophrenics and healthy controls. Biol Psychiatry, 43, S130-131.
- Dean, B., Sundram, S., Bradbury, R., Scarr, E., & Copolov, D. (2001). Studies on (3H)CP-55940 binding in the human central nervous system: Regional specific changes in density of cannabinoid-1 receptors associated with schizophrenia and cannabis abuse. Neuroscience, 103(1), 9-15.
- Degenhardt, L., Hall, W., & Lynskey, M. (2003). Testing hypotheses about the relationship between cannabis use and psychosis. Drug Alcohol Depend, 71, 37-48.
- Dervaux, A., Laqueille, X., Bourdel, M. C., Le Borgne, M. H., Olié, J. P., Lôo, H., et al. (2003). Cannabis et schizophrénie : données cliniques et sociodémographiques. L'Encéphale, XXIX, 11-17.
- Dixon, L. (1999). Dual diagnosis of substance abuse in schizophrenia: prevalence and impact on outcomes. Schizophr Res, 35(suppl.), S93-100.
- Drake, R. E., Mercer-McFadden, C., Mueser, K. T., & coll. (1998). Review of integrated mental health and substance abuse treatment for patients with dual disorders. Schizophr Bull, 24, 589-608.
- Dumas, P., Saoud, M., Bouafia, S., Gutknecht, C., Ecochard, R., Daléry, J., et al. (2002). Cannabis use correlates with schizotypal personality traits in healthy students. Psychiatry Res, 109, 27-35.
- Emrich, H. M., Leweke, M. F., & Schneider, U. (1997). Towards a cannabinoid hypothesis of schizophrenia: Cognitive impairments due to dysregulation of the endogenous cannabinoid system. Pharm Bioch Behav, 56(4), 803-807.
- Fergusson, D. M., Horwood, L. J., & Swain-Campbell, N. R. (2003). Cannabis dependence and psychotic symptoms in young people. Psychol Med, 33, 15-21.
- Gardner, E. L., & Vorel, R. S. (1998). Cannabinoid transmission and reward-related events. Neurobiol Dis, 502-533.
- Ghodse, H. A. (1986). Cannabis psychosis. Brit J Addiction, 81, 473-478.
- Giuffrida, A., Parsons, L. H., Kerr, T. M., Rodriguez de Fonseca, F., Navarro, M., & Piomelli, D. (1999). Dopamine activation of endogenous cannabinoid signaling in dorsal striatum. Nat Neuwosci, 2(4), 358-363.
- Gorritti, M. A., Rodriguez de Fonseca, F., Navarro, M., & Palomo, T. (1999). (-)-(9-tetrahydrocannabinol treatment induces sensitization to the psychomotro effects of amphetamine in rats. Eur J Pharmacol, 365, 133-142.
- Grace, A. A. (1993). Cortical regulation of subcortical dopamine systems and its possible relevance to schizophrenia. J Neural Transm, 91, 111-134.
- Hall, W., & Degenhardt, L. (2000). Cannabis use and psychosis: A review of clinical and epidemiological evidence. Austr NZ J Psychiatr, 34, 26-34.
- Hambrecht, M., & Häfner, M. (2000). Cannabis, vulnerability, and the onset of schizophrenia: An epidemiological perspective. Austr NZ J Psychiatry, 34, 468-475.
- Imade, A., & Ebie, J. C. (1991). A retrospective study of symptom patterns of cannabis-induced psychosis. Acta Psychiatr Scand, 134-136.
- Iversen, L. L. (2000). The Science of Marijuana. Oxford: Oxford University Press.
- Jablensky, A. (1995). Schizophrenia: Recent epidemiologic issues. Epidemiol Rev, 17, 10-20.
- Johns, A. (2001). Psychiatric effects of cannabis. Brit J Psychiatry, 178, 116-122.
- Karam, E. G., Yabroudi, P. F., & Melhem, N. M. (2002). Comorbidity of substance abuse and other psychiatric disorders in acute general psychiatric admissions: A study from Lebanon. Compr Psychiatry, 43(6), 463-468.
- Kavanagh, D. J., McGrath, J., & Saunders, J. B. (2002). Substance misuse in patients with schizophrenia: epidemiology and management. Drugs, 62(5), 743-755.
- Kay, S. R., Fisbein, A., & Opler, L. A. (1987). The positive and negative symptoms scale (PANSS) for schizophrenia. Schizophr Bull, 13, 261-276.
- Khantzian, E. J. (1985). The self-medication hypothesis of addictive disorders: Focus on heroin and cocaine dependence. Am J Psychiatry, 142, 1259-1264.
- Kwapil, T. R. (1996). A longitudinal study of drug and alcohol use by psychosis-prone and impulsive-nonconforming individuals. J Abnormal Psychol, 105(1), 114-123.
- Laruelle, M., & Abi-Dargham, A. (1999). Dopamine as the wind of psychotic fire: new evidence from a novel positron emission tomography. J Psychopharmacol, 13(4), 358-371.
- Leroy, S., Griffon, N., Bourdel, M. C., Olié, J. P., Poirier, M. F., & Krebs, M. O. (2001). Schizophrenia and the cannabinoid receptor type 1 (CB1): association study using a single-base polymorphism in coding exon 1. Am J Med Genetics, 105, 749-752.
- Leweke, F. M., Giuffrida, A., Wursted, U., Emrich, H. M., & Piomelli, D. (1999). Elevated endogenous cannabinoids in schizophrenia. Neuro Report, 1665-1669.
- Linszen, D. H., Dingemans, P. M., & Lenior, M. E. (1994). Cannabis abuse and the course of recent-onset schizophrenic disorders. Arch Gen Psychiatry, 51, 273-279.
- Liraud, F., & Verdoux, H. (2002). Impact neuropsychologique de l'abus de substances psychoactives dans les troubles psychotiques et de l'humeur. L'Encéphale, XXVIII, 160-168.
- Martin, B. R., Devey, W. L., & Di Marzo, V. (2002). Marijuana. In K. L. Davis & coll. (Eds.), Neuropsychopharmacology: The fifth generation of progress (pp. 1519-1531). Philadelphia: Lippincott, Williams & Wilkins.
- Martinez-Aravalo, M. J., Calcedo-Ordonez, A., & Varo-Prieto, J. R. (1994). Cannabis consumption as a prognostic factor in schizophrenia. Brit J Psychiatry, 164, 679-681.
- Mass, R., Bardong, C., Kindl, K., & Dahme, B. (2001). Relationship between cannabis use, schizotypal traits, and cognitive functions in healthy subjects. Psychopathology, 34, 209-214.
- Mathers, D. C., & Ghodse, A. H. (1992). Cannabis and psychotic illness. Brit J Psychiatry, 161, 648-653.
- Mathew, R. J., Wilson, W. H., Chiu, N. Y., Turkington, T. G., Degrado, T. R., & Coleman, R. E. (1999). Regional cerebral blood flow and depersonalization after tetrahydrocannabinol administration. Acta Psychiatr Scand, 100, 67-75.
- Mathew, R. J., Wilson, W. H., Humpfreys, D., Lowe, J. V., & Weithe, K. E. (1993). Depersonalization after marijuana smoking. Biol Psychiatry, 33(6), 431-441.
- McGuire, P. K., Jones, P., Harvey, I., Bebbington, P., Toone, B., Lewis, S., et al. (1994). Cannabis and acute psychosis. Schizophr Res, 13, 161-168.
- Mechoulam, R., Parker, L. A., & Gallily, R. (2002). Cannabidiol: An overview of some pharmacological aspects. J Clin Pharma, 42(suppl 11), S11-19.
- Mueser, K. T., Drake, R. E., & Wallach, M. A. (1998). Dual diagnosis: A review of etiological theories. Addictive Behav, 23, 717-734.
- Negrete, J. C., Knapp, W. P., Douglas, D. E., & Smith, B. W. (1986). Cannabis affects the severity of schizophrenic symptoms: Results of a clinical survey. Psychol Med, 16, 515-520.
- Nestler, E. J., Hyman, S. H., & Malenka, R. C. (2001). Molecular neuropharmacology: A foundation for clinical neuroscience. New York: McGraw-Hill.
- Nuñez, L., & Gurpegui, M. (2002). Cannabis-induced psychosis: A cross-sectional comparison with acute schizophrenia. Acta Psychiatr Scand, 105, 173-178.
- Nunn, J. A., Rizza, F., & Peters, E. R. (2001). The incidence of schizotypy among cannabis and alcohol users. J Nerv Ment Dis, 189, 741-748.
- Peralta, V., & Cuesta, M. J. (1992). Influence of cannabis abuse on schizophrenic psychopathology. Acta Psychiatr Scand, 85, 127-130.
- Phillips, L. J., Curry, C., Yung, A. R., Adlard, S., & McGorry, P. D. (2002). Cannabis use is not associated with the development of psychosis in an "ultra" high risk group. Austr NZ J Psychiatry, 36, 800-806.
- Potvin, S., Stip, E., & Roy, J. Y. (2003b). Schizophrénie et toxicomanie : une relecture du concept d'automédication. Encéphale, XXIX, 193-203.
- Potvin, S., Stip, E., & Roy, J. Y. (2003a). Les modèles pharmacologiques de la schizophrénie : perspective historique. Synapse, 195, 1-5.
- Regier, D. A., Farmer, M. E., Rae, D. S., Locke, B. Z., Keith, S. J., Judd, L. L., et al. (1990). Comorbidity of mental disorders with alcohol and other drug abuse: Results from the Epidemiologic Catchment Area (ECA) Study. JAMA, 264, 2511-2518.
- Rottanburg, D., Robins, A. H., Ben-Arie, O., Teggin, A., & Elk, R. (1982). Cannabis-associated psychosis with hypomanic features. Lancet, 2(8312), 1364-1366.
- Schneider, U., Leweke, F. M., Mueller-Vahl, K. R., & Emrich, H. M. (1998). Cannabinoid / anandamide system and schizophrenia: Is there evidence for association? Pharmacopsychiatry, 31(suppl), 110-113.
- Seeman, P., Lee, T., Chau-Wong, M., & Wong, K. (1976). Antipsychotic drug doses and neuroleptic / dopamine receptors. Nature, 261, 717-719.
- Skosnik, P. D., Spatz-Glenn, L., & Park, S. (2001). Cannabis use is associated with schizotypy and attentional disinhibition. Schizophr Res, 48, 83-92.
- Solowij, N., Michie, P. T., & Fox, A. M. (1991). Effects of long-term cannabis use on selective attention: an event-related potential study. Pharma Biochem Behav, 40, 683-688.
- Soyka M, Albus M, Immler B, Kathmann N & Hippius H. (2001). Psychopathology in dual diagnosis and non-addicted schizophrenics -are there differences? Eur Arch Psychiatry Clin Neurosci;251(5), 232-238.
- Stella, N., & Piomelli, D. (2001). Receptor-dependant formation of endogenous cannabinoids in cortical neurons. Eur J Pharmacol, 425, 189-196.
- Thacore, V. R., & Shukla, S. (1976). Cannabis psychosis and paranoid schizophrenia. Arch Gen Psychiatry, 33, 383-386.
- Thomas, H. (1993). Psychiatric symptoms in cannabis users. Brit J Psychiatry, 163, 141-149.
- Tien, A. Y., & Anthony, J. C. (1990). Epidemiological analysis of alcohol and drug use as risk factors for psychotic experiences. J Nerv Ment Dis, 178(8), 473-480.
- Van Os, J., Bak, M., Hanssen, M., Bijl, R. V., de Graaf, R., & Verdoux, H. (2002). Cannabis use and psychosis: A longitudinal population-based study. Am J Epidemiology, 156(4), 319-327.
- Verdoux, H., Sorbara, F., Gindre, C., Swendsen, J. D., & Van Os, J. (2002). Cannabis use and dimensions of psychosis in a nonclinical population of female subjects. Schizophr Res, 59, 77-84.
- Voruganti, L., Slomka, P., Zabel, P., Mattar, A., & Awad, G. A. (2002). Cannabis induced dopamine release: an in-vivo SPECT study. Psychiatry Res, 107, 173-177.
- Williams, J. H., Wellman, N. A., & Rawlins, J. N. (1996). Cannabis use correlates with schizotypy in healthy people. Addiction, 91(6), 869-877.
- Zammit, S., Allebeck, P., Andreasson, S., Lundberg, I., & Lewis, G. (2002). Self reported cannabis use as a risk factor for schizophrenia in Swedish conscripts of 1969: Historical cohort study. Brit Med J, 325, 1199-1203.
- Zaretsky, A., Rector, N. A., Seeman, N. V., & Fornazzari, X. (1993). Current cannabis use and tardive dyskinesia. Schizophr Res, 11, 3-8.
Liste des tableaux
Tableau 1
Principaux symptômes associés à la schizophrénie
Tableau 2
Cannabis et schizotypie
Tableau 3
Profil comparatif de la schizophrénie et de la psychose cannabique
Tableau 4
Cannabis comme facteur de risque de la schizophrénie
Tableau 5
Neuroanatomie fonctionnelle des récepteurs CB1 et CB2
Tableau 6
Schizophrénie et toxicomanie : modèles étiologiques.