Résumés
Résumé
Dans la cellule eucaryote, le transport intracytoplasmique entre les différents compartiments s’effectue généralement par l’intermédiaire d’organites individualisés, le plus souvent sous forme de vésicules. La formation de ces vésicules, leur transport et la fusion avec un compartiment cible nécessitent l’action de protéines cytosoliques dont l’identité varie en fonction de leurs constituants moléculaires ainsi que des compartiments d’origine et de destination. Certaines de ces protéines participent plus spécifiquement aux différentes étapes de la formation d’une vésicule, le recrutement des protéines transmembranaires, l’assemblage d’un manteau contribuant aux contraintes physiques nécessaires au bourgeonnement et la fission. L’interaction de ces protéines avec la face cytosolique de la bicouche lipidique nécessite un contrôle à la fois spatial et temporel. Ce contrôle est principalement assuré par la modification de certains lipides membranaires qui contrôlent toutes les étapes de la formation d’une vésicule ainsi que sa fusion avec la membrane cible.
Summary
Vesicular traffic is essential for the maintenance of cellular functions as well as inter-cellular communication. Sequential steps of vesicular traffic require the action of cytosolic proteins that are involved in spatial and temporal control of budding, fission, vectorial transport, and fusion with the target compartment. Some of these proteins have been identified as lipid-modifying enzymes that regulate vesicular traffic from, and between the different compartments in the cell. Phosphorylated derivatives of phosphatidylinositol are the most widely used membrane lipids that are acting as specific recruitors and activators of cytosolic proteins among which the members of vesicular coats, proteins that are involved in the regulation of actin dynamics as well as other enzymes involved in lipid metabolism. Here are described, in particular, the roles of phosphatidylinositol-4,5-bisphosphate and phosphatidylinositol-3,4,5-trisphosphate, two of the most relevant phospho-inositides involved in sequential steps of vesicular budding and fission, from both the Golgi apparatus and the plasma membrane. In addition, this review presents new concepts on the mechanism of action of cytosolic proteins that are binding to, and catalyzing the formation of, acidic membrane lipids. By doing so, these proteins may contribute, through biophysical principles that still remain to be determined and are discussed here, to deform the target membrane, hence promoting membrane budding and fission.
Corps de l’article
Les interactions dynamiques entre les différents compartiments de la cellule, entretenues par le transport vectoriel d’organites de forme souvent vésiculaire, sont contrôlées par des interactions entre protéines d’une part, et entre lipides et protéines dpart. Les interactions protéines-protéines engagées dans ces fonctions sont illustrées par l’interaction entre un récepteur transmembranaire et un complexe de protéines cytosoliques chargées de recruter les constituants d’un manteau vésiculaire. Les interactions lipides-protéines mettent en jeu des espèces souvent minoritaires de phospholipides membranaires. Ces phospholipides sont les produits de l’action de protéines cytosoliques contrôlant les enzymes spécifiques de leur métabolisme. L’identification de ces enzymes et l’étude du contrôle spatial et temporel de leur action constituent un domaine de la biologie cellulaire qui s’est largement ouvert à l’investigation au cours de cette dernière décennie, investigation catalysée par l’obtention de mutants affectant le métabolisme des lipides membranaires et interférant avec les voies de sécrétion chez la levure. L’objectif de cette revue sera de présenter les modifications lipidiques les plus impliquées dans la dynamique des compartiments intracellulaires, en particulier celles conduisant au bourgeonnement et à la fission de vésicules.
Quels types de modifications lipidiques et quelles enzymes?
Les modifications lipidiques qui affectent la dynamique des membranes et plus particulièrement la formation de vésicules intracytoplasmiques, concernent une famille de phospholipides membranaires dérivés du phosphatidylinositol, les phospho-inositides. Outre les phospholipases C qui agissent sur les phospho-inositides et contrôlent la production des seconds messagers, diacylglycérol (DAG) et inositol polyphosphates, une cohorte d’enzymes contrôlent le degré de phosphorylation sur le groupement inositol des phospho-inositides [1], [2] (Figure 1A). Outre des régulations spatiales (nature du compartiment membranaire et point local d’action au sein de la membrane délimitant ce compartiment), des régulations temporelles s’exercent puisque ces phosphoinositides sont soumis à l’action séquentielle de kinases et de phosphatases. Ces principes sont également applicables à l’action d’autres enzymes cytosoliques impliquées dans la formation de vésicules comme la phospholipase D. Celle-ci peut agir non seulement sur les phospho-inositides mais aussi sur un lipide membranaire plus largement représenté comme la phosphatidylcholine (Figure 1B).
Figure 1
Voies de synthèse et modifications des phospholipides impliqués dans les étapes de la formation de vésicules cytoplasmiques.
A. Cycle des phospho-inositides (PtdIns) montrant différentes phospho-inositides-kinases (en rouge) et phosphatases (en bleu). SHIP (SH2 domain-containing inositol polyphosphate 5-phosphatase) est une 5-phosphatase recrutée, par exemple, à la membrane du phagosome. Les voies représentées en noir (non discutées dans cet article) ont été mises en évidence principalement dans la dynamique des compartiments de l’endocytose impliquant la reconnaissance et la fusion de vésicules de transport et de compartiments endocytiques. B. Autres phospholipides dont le métabolisme conduit également à la formation de lipides impliqués dans le trafic vésiculaire. L’action de la phospholipase D (PLD), le plus souvent sur la phosphatidylcholine, libère l’acide phosphatidique qui intervient dans le recrutement et l’activation de protéines cytosoliques incluant des lipide-kinases, et le contrôle de la courbure membranaire. L’action de la phospholipase C (PLC) sur les phospho-inositides assure la formation des seconds messagers inositol-polyphosphates et diacylglycérol. Ce lipide est également susceptible de contrôler la dynamique des membranes intracellulaires, en interagissant avec la protéine kinase C par exemple.
Parmi les phospho-inositides, le phosphatidylinositol-4,5-bisphosphate (PtdIns-4,5-P2) et le phosphatidylinositol-3,4,5-trisphosphate (PtdIns-3,4,5-P3) sont impliqués plus particulièrement, mais non exclusivement, dans la formation des vésicules mantelées émanant de la membrane plasmique et du réseau trans-golgien et dans celles des vésicules intra-golgiennes et du phagosome ou vacuole macropinocytique du macrophage (Figure 1A). Ces deux phospho-inositides sont formés, dans la majeure partie des cas, par l’ajout successif de phosphates en position 4, puis 5, de l’inositol, par une PtdIns 4-kinase (assurant la production du PtdIns-4-P), une PtdIns 4-P 5-kinase (assurant la production du PtdIns-4,5-P) et, enfin, éventuellement, une PtdIns 3-kinase (assurant la production du PtdIns-3,4,5-P3) (Figure 1A). Il existe plusieurs formes de PtdIns 3-kinases [3], [4]. L’implication de PtdIns 3-kinases dans certaines étapes du trafic vésiculaire peut être testée par des drogues inhibant leur activité, la wortmannine et le LY294002. Cependant, certains sous-types de PtdIns 3-kinases ne sont pas sensibles à ces drogues alors que certaines PtdIns 4-kinases le sont.
Un autre phospholipide régulateur de la dynamique membranaire contribuant à la formation de vésicules est l’acide phosphatidique. L’acide phosphatidique peut être formé par plusieurs voies métaboliques dont deux au moins sont impliquées dans la dynamique des membranes cellulaires. La première met en jeu la phospholipase D utilisant principalement la phosphatidylcholine comme substrat. Cette voie a été initialement mise en évidence pour le transport de vésicules golgiennes [5]. La seconde met en jeu les endophilines, protéines qui exercent une activité de type acyltransférase utilisant comme substrats l’acide lysophosphatidique ainsi que des acides gras activés à longue chaîne carbonée (Acyl-CoA) [6]. L’acide phosphatidique, produit de cette activité, serait impliqué dans la formation de vésicules à manteau de clathrine à partir de la membrane plasmique.
Les principes de recrutement de ces différentes enzymes du métabolisme des phospholipides, impliquées dans la dynamique des compartiments intracellulaires, ne sont pas tous élucidés. Outre leur interaction avec des protéines chargées de les recruter à la membrane, ces enzymes peuvent interagir directement avec des phospho-inositides. Cela est également vrai pour des protéines cytosoliques qui, en majeure partie, sont des protéines structurales comme les constituants d’un manteau, les manteaux de clathrine et les COP (coat-proteins), par exemple, ou d’autres protéines accessoires participant aux étapes de la formation d’une vésicule. L’interaction directe avec la membrane implique que ces protéines possèdent un ou plusieurs domaines permettant la reconnaissance plus ou moins spécifique de sous-types de phospho-inositides.
Modifications lipidiques et recrutement de facteurs cytosoliques
Un rôle essentiel joué par les phospholipides localisés au sein de la partie cytosolique de la bicouche lipidique est de recruter des protéines cytosoliques. Celles-ci contrôlent des étapes successives de la formation d’une vésicule, le tri (ou sorting) de protéines transmembranaires transportées par ces vésicules, le bourgeonnement de la membrane et la fission. L’étude structurale des protéines cytosoliques impliquées dans la dynamique des membranes a révélé une série de séquences consensus, souvent individualisées en domaines, assurant une spécificité plus ou moins restreinte à un ou plusieurs phospholipides, en particulier des phospho-inositides. Ces domaines contrôlent des interactions protéines-lipides engagées dans différentes étapes de la dynamique des membranes, incluant également la locomotion cellulaire [7]. à ce jour, deux domaines impliqués dans la liaison des PtdIns-4,5-P2 et PtdIns-3,4,5-P3 ont été identifiés: les domaines PH (pleckstrin-homology), domaines dont la séquence a été initialement identifiée dans la pleckstrine, un substrat plaquettaire de la protéine kinase C, et les domaines PX (Phox domain), domaines initialement identifiés dans deux sous-unités du complexe oxydase du phagocyte destiné à détruire des micro-organismes phagocytés [8]-[9]-[10]. Ces domaines comportent de manière consensuelle un ensemble de résidus basiques ainsi qu’une hélice hydrophobe potentiellement impliquée dans l’interaction avec la bicouche lipidique. La très grande majorité des domaines PH ne présente pas de spécificité pour la liaison aux 3-phospho-inositides, à l’exception d’un petit nombre parmi lesquels ceux identifiés au sein de facteurs d’échange du GTP sur ARF (ADP-ribosylation factor), nom générique d’une famille de petites protéines se liant au GTP et contrôlant de nombreuses étapes du trafic membranaire ainsi que la structure des compartiments [11]. Les domaines PX, comme les domaines PH, peuvent se lier à plusieurs types de phospho-inositides, incluant PtdIns-4,5-P2.
Modifications lipidiques et tri des récepteurs
Le tri des récepteurs est l’étape qui contrôle l’efficacité d’incorporation de récepteurs et autres molécules transmembranaires au sein d’une structure membranaire, en général destinée à être véhiculée entre différents compartiments de la cellule, par exemple une vésicule de transport. L’implication d’une PtdIns 3-kinase dans le tri au niveau du réseau trans-Golgien a initialement été décrite chez une souche de levure mutante pour le gène VPS34, codant pour une PtdIns 3-kinase insensible à la wortmannine [12]. Dans les cellules de mammifères, l’efficacité de l’incorporation du récepteur assurant le transport d’enzymes lysosomiales appelé récepteur de mannose-6-phosphate (cis-M6PR), au sein de vésicules mantelées à clathrine émergeant du trans-Golgi, est une étape décrite comme sensible à la wortmannine [13]. Les mécanismes moléculaires permettant d’établir un lien entre cette activité PtdIns 3-kinase et le tri des cis-M6PR restent indéterminés. Un autre exemple est celui des β-arrestines. Celles-ci interviennent comme régulateurs de l’internalisation des récepteurs couplés aux protéines G hétérotrimériques (voie dépendante de la clathrine), et possèdent un domaine d’interaction avec le PtdIns-4,5-P2 et le PtdIns-3,4,5-P3. Ce domaine est critique pour la concentration des complexes récepteur-arrestine dans les formations membranaires précurseurs des vésicules à manteau de clathrine [14]. Enfin, un certain nombre de protéines appelées nexines et contenant un domaine PX susceptible de se lier au PtdIns 3-P, contrôlent l’efficacité du tri de récepteurs à la surface cellulaire (le récepteur de la transferrine par exemple) et leur parcours entre les différents compartiments intracellulaires [10].
Modifications lipidiques et bourgeonnement vésiculaire
Le PtdIns-4,5-P2 et le PtdIns-3,4,5-P3 sont également impliqués dans le bourgeonnement de vésicules contrôlé par le manteau de clathrine.
Il existe deux types de vésicules à manteau de clathrine qui se distinguent avant tout par la membrane à partir de laquelle elles se forment, et par le type d’adaptateur à clathrine mis en jeu [15]. Dans le cas de vésicules formées à partir de la membrane plasmique, il a été montré que nombre de protéines cytosoliques impliquées dans l’assemblage du manteau de clathrine interagissent avec des phospho-inositides et plus spécifiquement le PtdIns-4,5-P2. Tel est notamment le cas pour le complexe AP2, recruté par l’intermédiaire d’un domaine amino-terminal riche en résidus de lysine, pour les protéines CALM (clathrin assembly lymphoid myeloid leukemia protein) et AP180 (homologue de CALM exprimé dans le système nerveux central), qui semblent jouer un rôle dans les étapes précoces de l’assemblage de la clathrine et pour l’epsine, ces trois dernières étant recrutées par le PtdIns-4,5-P2 via un domaine récemment caractérisé: le domaine ENTH (epsin NH2-terminal homology). La délétion de ces domaines ENTH inhibe la fonction de ces protéines dans l’endocytose montrant que la liaison au PtdIns-4,5-P2 est essentielle au processus [16], [17].
Des données récentes viennent de montrer également l’implication d’une phosphatidylinositol 3-kinase de classe II (C2α, insensible à la wortmannine), dans la formation des vésicules à manteau de clathrine à partir de la membrane plasmique et du réseau trans de l’appareil de Golgi [18]. Cette kinase, outre le fait qu’elle soit recrutée à la membrane par l’intermédiaire d’une interaction avec le PtdIns-4,5-P2, via un domaine PX, est capable d’interagir spécifiquement avec la clathrine, très probablement avec un - voire plusieurs - motifs localisés à son extrémité amino-terminale. Cette interaction semble, au moins in vitro, favoriser plus spécifiquement la formation du PtdIns-3,4,5-P3. La production du PtdIns-3,4,5-P3, dans le feuillet cytosolique de la vésicule mantelée en formation, pourrait intervenir dans le recrutement du complexe AP2 qui, au moins in vitro, semble avoir une meilleure affinité pour le PtdIns-3,4,5-P3 que pour le PtdIns-4,5-P2 [19]. Elle pourrait également augmenter l’affinité des adaptateurs pour leurs récepteurs et recruter des protéines impliquées dans les étapes sucessives conduisant à la fission. Le recrutement du manteau de clathrine passe donc par un effet coopératif des deux types d’événements que sont l’interaction protéine-protéine et l’interaction protéines cytosoliques-phospholipides membranaires.
Les vésicules mantelées ne sont pas les seules vésicules d’endocytose dont la formation dépend de la production locale des 3-phospho-inositides. Tel est également le cas pour l’organite endocytique des cellules phagocytaires, le phagosome [20]. Une formation rapide et transitoire du PtdIns-3,4,5-P3 à la membrane du phagosome contrôle le recrutement de protéines cytosoliques réglant la dynamique du cytosquelette d’actine. Cette étape est indispensable pour l’encapsulation de la particule à ingérer par la membrane plasmique [21]. Deux protéines se présentent comme des candidats potentiels, recrutés par PtdIns-3,4,5-P3 et impliqués dans le réarrangement de l’actine: Vav et ARNO (ARF nucleotide-binding site opener), deux facteurs activateurs de l’échange du GTP, respectivement sur Rac1 et ARF6, et capables de se lier spécifiquement au PtdIns-3,4,5-P3 par l’intermédiaire de leur domaine PH. Par ailleurs, l’utilisation d’une protéine de fusion entre la GFP et le domaine PH de la PLCδ (domaine qui reconnaît spécifiquement le PtdIns-4,5-P2), a non seulement permis de visualiser la formation de ce phospho-inositide lors de la phagocytose, mais également la disparition, contemporaine de la fission [22].
Il apparaît donc que PtdIns-4,5-P2 et PtdIns-3,4,5-P3 contrôlent le bourgeonnement de divers types de vésicules endocytiques. L’implication des deux phospholipides, dans des événements concomitants ou séquentiels, reste à démontrer.
Modifications lipidiques et fission
L’étape finale conduisant à l’individualisation d’une vésicule dans le cytoplasme est l’étape où les deux bicouches adjacentes fusionnent; c’est la fission. Le PtdIns-4,5-P2 est potentiellement impliqué dans cette étape, en particulier pour les vésicules dont la fission est dépendante de l’activité GTPasique d’une protéine cytosolique appelée dynamine: les vésicules à manteau de clathrine et les vésicules endocytiques à micro-domaines lipidiques telles que les cavéoles. Bien que le mode de fonctionnement de la dynamine dans la fission soit encore débattu, cette protéine pourrait être ancrée au point de fission membranaire par interaction avec le PtdIns-4,5-P2, par l’intermédiaire d’un domaine PH [23]. Ce domaine ayant peu de sélectivité pour PtdIns-4,5-P2 par rapport à PtdIns-3,4,5-P3, l’identité du (ou des) phospholipides impliqués dans le mode d’action de la dynamine dans la fission reste à déterminer.
Modifications lipidiques et régulation de la dynamique du cytosquelette d’actine
Un des mécanismes moléculaires récurrents dans la formation de vésicules est la participation et/ou la modification du cytosquelette d’actine [24], [25]. Comme nous l’avons vu dans le cas de la formation du phagosome, l’actine est impliquée dans l’élaboration des protrusions membranaires encapsulant la particule mais sa polymérisation pourrait également exercer une contrainte mécanique dans la fission. Ces aspects nécessitent le réarrangement du réseau d’actine mettant en jeu de très nombreuses protéines contrôlant l’élongation des filaments, leur organisation et leur stabilité. Nombre de ces protéines possèdent des sites d’interaction avec les phospholipides membranaires [26]. Par exemple, la gelsoline (protéine cytosolique séquestrant l’actine monomérique) jouerait un rôle dans la formation de vésicules provenant du trans-Golgi, en contrôlant l’état polymérisé du cytosquelette d’actine entourant la membrane golgienne [27]. La gelsoline serait, dans ce cas, recrutée par interaction avec le PtdIns-4,5-P2 à la membrane golgienne, après stimulation de la phospholipase D par ARF (Figure 2). Cette voie, dépendante de la phospholipase D, s’intègre dans une boucle rétroactive d’amplification dans laquelle l’action de la phospholipase D libère l’acide phosphatidique. Ce dernier stimule alors la formation de PtdIns-4,5-P2 par activation d’une PtdIns-4 5-kinase. Le PtdIns-4,5-P2 ainsi formé stimule à nouveau la phospholipase D [28]. Il existe néanmoins une seconde voie conduisant à la formation de PtdIns-4,5-P2, mise également en évidence au niveau de la membrane golgienne. Cette voie, indépendante de la phospholipase D, est activée par ARF1 qui recrute et contrôle directement une PtdIns-4-OH kinase β ainsi qu’une PtdIns 4-P 5-OH kinase contribuant finalement à la formation de PtdIns-4,5-P2 [29] (Figure 2). L’interconnexion entre ces deux voies dans les étapes du transport golgien reste encore à déterminer mais la formation de PtdIns-4,5-P2 est proposée comme contrôlant la dynamique de l’actine. Plus spécifiquement, la voie indépendante de la phospholipase D pourrait conduire au recrutement de la spectrine, une protéine structurale susceptible de contrôler le va-et-vient des vésicules intra-golgiennes en transit [27]. Cette voie semble trouver un équivalent dans le contrôle de la formation de vésicules golgiennes chez la levure [30].
Figure 2
Rôles des phospho-inositides dans le recrutement de protéines cytosoliques et les étapes successives de la formation d’une vésicule.
Le PtdIns-4,5-P2 recrute et stimule l’activité de la phospholipase D (PLD). L’acide phosphatidique formé par action de la phospholipase D, stimule la PtdIns 4-P 5-kinase. Une boucle de rétrocontrôle positif conduit à amplifier la production de PtdIns-4,5-P2. Cette réaction est également stimulée par le recrutement de facteurs d’échange nucléotidique sur ARF (ARF-GEF, guanine nucleotide exchange factors). PtdIns-4,5-P2 peut être également produit indépendamment de la phospholipase D, par stimulation directe par ARF (sous forme liée au GTP), de deux phospho-inositides kinases. PtdIns-4,5-P2 et PtdIns-3,4,5-P3 sont deux phospho-inositides clés pour le recrutement de protéines cytosoliques impliquées dans les étapes successives de la formation d’une vésicule. A. le bourgeonnement, B. l’étape précédant directement la fission, C. l’individualisation, après fission, de la vésicule dans le cytosplasme et la perte du manteau. Cette dernière étape est contrôlée par l’action d’une 5’-phosphatase déphosphorylant PtdIns-4,5-P2. Dans ce schéma, la formation des vésicules synaptiques par voie d’endocytose est prise en exemple; la 5’-phosphatase impliquée est la synaptojanine. Les différentes étapes de la formation d’une vésicule mettent en jeu des variations dans la coubure membranaire. Une courbure membranaire « positive » (indiquée en violet) est favorisée par l’assemblage des constituants du manteau et des protéines telles que l’amphiphysine et l’endophiline qui, en se liant à des phospholipides acides, induisent des déformations de la membrane. Une courbure membranaire « négative » (indiquée en rouge), pourrait être contrôlée par l’activité acyltransférase de l’endophiline utilisant l’acide lysophosphatidique comme substrat.
Modifications lipidiques et influence de la géométrie des lipides formés dans les déformations de la membrane Contrôle de la courbure
Lorsqu’une vésicule se forme, des modifications dans la courbure membranaire ont lieu. Lors de l’étape initiale, le bourgeonnement à partir d’une surface plane et allant jusqu’à l’hémisphère se traduit par une augmentation de la surface membranaire de courbure positive (Figure 2A). Dans les étapes précédant la fission, la géométrie de la bicouche peut aussi comporter une composante de courbure négative, au moins dans l’une des trois dimensions de l’espace délimité par le « cou » de la vésicule en formation (Figure 2B). La courbure positive peut être induite par translocation (à partir du feuillet interne de la bicouche) ou addition nette d’un lipide (en provenance de lipides complexés à des protéines cytosoliques). Elle peut également résulter de l’insertion d’un domaine protéique dans le feuillet cytosolique. Ces différents processus sont générateurs d’une asymétrie membranaire [31]. La courbure négative pourrait, par exemple, résulter du transfert de chaînes acylées poly-insaturées sur des lipides de la partie cytosolique de la bicouche [6] (Figure 3).
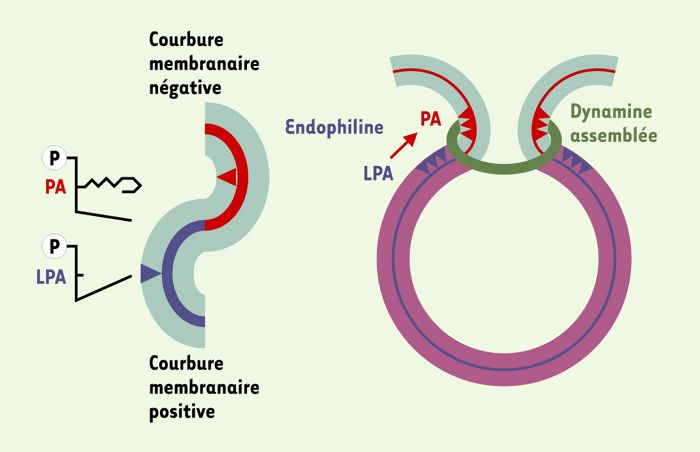
Figure 3
Modèle possible de l’action de l’endophiline dans la fission membranaire.
Ce mode d’action met en jeu l’interaction de l’endophiline, par l’intermédiaire d’un domaine SH3 (Src-homology 3 domain) localisé dans sa partie carboxy-terminale, avec le domaine riche en résidus de proline de la dynamine. La dynamine est assemblée, sous forme d’un anneau, autour du cou de la vésicule en formation. La conversion de l’acide lysophosphatidique (LPA) en acide phosphatidique (PA), catalysée par l’endophiline, permettrait de transformer un lyso-lipide en forme de cône inversé (LPA, cône bleu), en un lipide en forme de cône (PA, cône rouge) dont la géométrie pourrait favoriser une augmentation de la courbure négative de la membrane, au cou de la vésicule en formation (surtout lorsque la chaîne lipidique transférée sur le LPA est l’acide arachidonique, lipide poly-insaturé; voir aussi [6]). Cela pourrait, soit de façon concomitante avec l’action mécanique de la dynamine, soit indépendamment, entraîner la fission membranaire.
Deux mécanismes sont actuellement proposés pour un rôle direct des lipides et de leurs modifications dans les variations de courbures membranaires. Le premier propose la participation de lipides chargés négativement (phospho-inositides, acide phosphatidique, phosphatidylsérine) et assurant le recrutement de protéines exerçant une contrainte mécanique sur la membrane [32]. Le second met en jeu des protéines dont l’action enzymatique sur certains phospholipides modifie leur géométrie [6] (Figure 2).
La formation des vésicules à manteau de clathrine est de ce point de vue le processus le mieux étudié. Deux protéines cytosoliques, l’amphiphysine et l’endophiline, jouent un rôle dans le bourgeonnement de la membrane, en contrôlant vraisemblablement l’expansion de la membrane de courbure positive en phase d’invagination [33]-[34]-[35]. Cette propriété est conférée aux deux protéines par une hélice amphipatique localisée en leur extrémité amino-terminale qui permet leur liaison à la membrane [34]. Les mécanismes physico-chimiques par lesquels ces deux protéines induisent des déformations membranaires restent à définir. Une hypothèse serait l’insertion des deux protéines dans la bicouche, laquelle augmenterait l’asymétrie du feuillet cytosolique par rapport au feuillet interne.
Outre ces propriétés, l’endophiline possède une activité acyltransférase utilisant l’acide lysophosphatidique et des acides gras activés sous forme complexée au coenzyme A comme substrats (activité LPAAT) [6] et formant de l’acide phosphatidique. Ce dernier, chargé négativement, pourrait servir de point d’ancrage pour l’endophiline et l’amphiphysine afin que ces protéines exercent leur action directe sur la membrane (Figure 2A, B). De plus, l’endophiline pourrait recruter l’acide lysophosphatidique à partir d’un pool cytosolique, soit soluble, soit complexé à une autre protéine, et l’insertion de l’acide lysophosphatidique au sein du feuillet cytosolique pourrait ainsi contribuer à l’asymétrie membranaire [33]. Enfin, l’activité LPAAT de l’endophiline pourrait contribuer à augmenter le nombre de phospholipides dont la géométrie favoriserait une courbure négative de la membrane (Figure 3). Cette possibilité a été retenue car l’endophiline favorise la formation des vésicules mantelées à clathrine d’autant plus lorsqu’elle est mise en présence d’acides gras activés poly-insaturés comme l’arachidonylCoA [6]. Cela suggère donc que la géométrie de l’acide phosphatidique formé, en particulier lorsque celui-ci est porteur d’un acide gras insaturé en position sn-2, contrôle l’efficacité de formation de la vésicule en favorisant des courbures négatives de la membrane. Cette action pourrait se localiser à l’interface du bourgeon et de la surface plane de la membrane et/ou au niveau du cou de la vésicule (Figure 2A, B). Ainsi, l’endophiline contrôlerait la géométrie de la membrane dans une étape qui, soit précède, soit est directement impliquée dans la fission. Cette dernière hypothèse est renforcée par le fait que l’endophiline interagit avec la dynamine qui, elle-même, est recrutée à la membrane par interaction avec des phospho-inositides et joue un rôle dans la fission (Figure 3).
Réversibilité des modifications lipidiques : un exemple de son rôle dans le recyclage des vésicules synaptiques
Dans la dynamique des compartiments intracellulaires, toute modification des lipides en un point donné d’une membrane est contrôlée dans le temps et de fait est réversible. Tel est le cas pour les dérivés phosphorylés du phosphatidylinositol, soumis à l’action de phosphatases [31]. Un des systèmes les plus exploités dans ce domaine est celui de la dynamique des organites de neurosécrétion (granules et vésicules synaptiques), qui libèrent leur contenu dans l’espace extracellulaire et en particulier dans la fente synaptique. La fusion et le recyclage des vésicules de neurosécrétion comportent une étape préliminaire d’acquisition de la compétence pour la fusion, la fusion avec la membrane plasmique et le recyclage par endocytose. Au moins deux de ces trois étapes (la première et la dernière) sont dépendantes du métabolisme des phospho-inositides et en particulier du PtdIns-4,5-P2 [36]. L’acquisition de la compétence pour la fusion est une étape nécessitant l’ATP qui servira aux phosphorylations successives du phosphatidylinositol pour former du PtdIns-4,5-P2. Celui-ci servira de point d’ancrage à une protéine contrôlant une des étapes conduisant à la fission et sensible à l’élévation de la concentration en calcium cytosolique. L’augmentation du PtdIns-4,5-P2, localisé également au niveau de la partie cytosolique de la membrane plasmique, est un des événements assurant un « couplage » entre l’exocytose et l’endocytose des constituants moléculaires de la vésicule ayant fusionné avec la membrane pré-synaptique. Une étude récente sur le recyclage des vésicules synaptiques suggère que c’est la formation du PtdIns-4,5-P2 qui contrôlerait le recrutement de protéines accessoires du manteau, interagissant avec les parties cytosoliques de protéines transmembranaires des vésicules réinternalisées « en bloc », par endocytose. Dans ce cas, PtdIns-4,5-P2 serait formé par l’action d’une PtdIns 4-P 5-kinase γ de type I, une phosphatidylinositol kinase majoritairement exprimée à la synapse [37]. Une fois la vésicule formée, nombre de protéines recrutées, en particulier celles constituant le manteau, se dissocient de la membrane. Ce désarrimage rapide du manteau assure une constance dans l’efficacité de l’endocytose de nouvelles vésicules et nécessite l’action de la synaptojanine, une phosphatase de type II hydrolysant le groupement phosphate en position 5 du PtdIns-4,5-P2 (Figure 2C). L’invalidation du gène codant pour la synaptojanine 1, enzyme enrichie dans la synapse, a révélé une augmentation du nombre de vésicules mantelées à la synapse et de la densité du cytosquelette d’actine, témoignant de l’implication de la phosphatase dans le contrôle du relargage du manteau et dans le contrôle de la polymérisation de l’actine [38].
Conclusions
Les modifications des caractéristiques biochimiques des phospholipides membranaires, si elles jouent un rôle dans la formation de vésicules de transport, sont également essentielles à d’autres étapes de la dynamique des membranes cellulaires. L’une de ces étapes est la reconnaissance et la fusion de vésicules de transport avec des compartiments cibles. Par ailleurs, les modifications des lipides ne sont pas les seules voies exploitées pour exercer un contrôle sur la membrane. Ainsi, outre les changements dans la composition lipidique de la membrane d’un compartiment par transfert cytosolique de certains lipides, l’échange de lipides d’un feuillet à l’autre de la bicouche paraît également jouer un rôle. Ce dernier processus, effectué par translocation, a été décrit comme force génératrice d’asymétrie membranaire pouvant avoir lieu au cours de l’endocytose.
Le trafic membranaire est un processus dynamique essentiel au fonctionnement de la cellule eucaryote, qui préserve et entretient l’identité des compartiments intracellulaires. Outre le rôle des interactions entre protéines, la cellule a puisé dans les ressources qu’offre la diversité des lipides membranaires pour assurer la fidélité, à la fois dans l’espace et dans le temps, de ces fonctions. Des progrès significatifs dans la compréhension de la dynamique des membranes nécessiteront des outils, par exemple des sondes fluorescentes, permettant de visualiser, in situ, la chronologie des événements moléculaires qui la contrôlent. L’identification de nouveaux domaines assurant le recrutement spécifique des protéines cytosoliques par interaction avec des sous-types de lipides membranaires devrait pouvoir fournir de tels outils moléculaires.
Parties annexes
Références
- 1. Martin TFJ. Phospho-inositide lipids as signal molecules: common themes for signal transduction, cytoskeletal regulation, and membrane trafficking. Annu Rev Cell Dev Biol 1998; 14: 231-64.
- 2. Simonsen A, Wurmser AE, Emr SD, Stenmark H. The role of phospho-inositides in membrane transport. Curr Opin Cell Biol 2001; 13: 485-92.
- 3. Vanhaesebroeck B, Leevers SJ, Panayotou G, Waterfield MD. Phospho-inositide 3-kinases: a conserved family of signal transducers. Trends Biochem Sci 1997; 22: 267-72.
- 4. Katso R, Okkenhaug K, Ahmadi K, White S, Timms J, Waterfield MD. Cellular function of phospho-inositide 3-kinases: implications for development, homeostatsis, and cancer. Annu Rev Cell Dev Biol 2001; 17: 615-75.
- 5. Brown HA, Gutowski S, Moomaw CR, Slaughter C, Sternweis PC. ADP-ribosylation factor, a small GTP-dependent regulatory protein, stimulates phospholipase D activity. Cell 1993; 75: 1137-44.
- 6. Schmidt A, Wolde M, Thiele C, et al. Endophilin I mediates synaptic vesicle formation by transfer of arachidonate to lysophosphatidic acid. Nature 1999; 401: 133-41.
- 7. Hurley JH, Meyer T. Subcellular targeting by membrane lipids. Curr Opin Cell Biol 2001; 13: 146-52.
- 8. Maffucci T, Falasca M. Specificity in pleckstrin homology (PH) domain membrane targeting: a role for a phospho-inositide-protein co-operative mechanism. FEBS Lett 2001; 506: 173-9.
- 9. Sato TK, Overduin M, Emr SD. Location, location, location: membrane targeting directed by PX domains. Science 2001; 294: 1881-5.
- 10. Simonsen A, Stenmark H. PX domains: attracted by phospho-inositides. Nat Cell Biol 2001; 3: E179-82.
- 11. Donaldson JG, Jackson CL. Regulators and effectors of the ARF GTPases. Curr Opin Cell Biol 2000; 12: 475-82.
- 12. Stack JH, Emr SD. Vps34p required for yeast vacuolar protein sorting is a multiple specificity kinase that exhibits both protein kinase and phosphatidylinositol-specific PI 3-kinase activities. J Biol Chem 1994; 269: 31552-62.
- 13. Gaffet P, Jones AT, Clague MJ. Inhibition of calcium-independent mannose 6-phosphate receptor incorporation into trans-Golgi network-derived clathrin-coated vesicles by wortmannin. J BiolChem 1997; 272: 24170-5.
- 14. Gaidarov I, Krupnick JG, Falck JR, Benovic JL, Keen JH. Arrestin function in G protein-coupled receptor endocytosis requires phospho-inositide binding. EMBO J 1999; 18: 871-81.
- 15. Hirst J, Robinson MS. Clathrin and adaptors. Biochem Biophys Acta 1998; 1404: 173-93.
- 16. Ford MG, Pearse BM, Higgins MK, et al. Simultaneous binding of PtdIns (4,5) P 2 and clathrin by AP180 in the nucleation of clathrin lattices on membranes. Science 2001; 291: 1051-5.
- 17. Itoh T, Koshiba S, Kigawa T, Kikuchi A, Yokoyama S, Takenawa T. Role of the ENTH domain in phosphatidylinositol-4,5-bisphosphate binding and endocytosis. Science 2001; 291: 1047-51.
- 18. Gaidarov I, Smith MEK, Domin J, Keen JH. The class II phospho-inositide 3-kinase C2α is activated by clathrin and regulates clathrin-mediated membrane trafficking. Mol Cell 2001; 7: 443-9.
- 19. Gaidarov I, Chen Q, Falck JR, Reddy KK, Keen JH. A functional phosphatidylinositol 3,4,5-trisphosphate/phospho-inositide binding domain in the clathrin adaptor AP-2 subunit. Implications for the endocytic pathway. J Biol Chem 1996; 271: 20922-9.
- 20. Gillooly DJ, Simonsen A, Stenmark H. Phospho-inositides and phagocytosis. J Cell Biol 2001; 155: 15-7.
- 21. Marshall JG, Booth JW, Stambolic V, et al. Restricted accumulation of phosphatidylinositol 3-kinase products in a plasmalemmal subdomain during Fc gamma receptor-mediated phagocytosis. J Cell Biol 2001; 153: 1369-80.
- 22. Botelho RJ, Teruel M, Dierckman R, et al. Localized biphasic changes in phosphatidylinositol-4,5-bisphosphate at sites of phagocytosis. J Cell Biol 2000; 151: 1353-68.
- 23. Schmid SL, McNiven MA, De Camilli P. Dynamin and its partners: a progress report. Curr Opin Cell Biol 1998; 10: 504-12.
- 24. De Camilli P, Emr SD, McPherson PS, Novick P. Phospho-inositides as regulators in membrane traffic. Science 1996; 271: 1533-9.
- 25. Martin TFJ. Phospho-inositides as spatial regulators of membrane traffic. Curr Opin Neurobiol 1997; 7: 331-8.
- 26. Niggli V. Structural properties of lipid-binding sites in cytoskeletal proteins. Trends Biochem Sci 2001; 26: 604-11.
- 27. Lorra C, Huttner WB. The mesh hypothesis of Golgi dynamics. Nat Cell Biol 1999; 1: E113-5.
- 28. Tüscher O, Lorra C, Bouma B, et al. Cooperativity of phosphatidylinositol transfer protein and phospholipase D in secretory vesicle formation from the TGN - phospho-inositides as a common denominator? FEBS Lett 1997; 419: 271-5.
- 29. Godi A, Pertile P, Meyers R, et al. ARF mediates recruitment of PtdIns-4-OH kinase-β and stimulates synthesis of PtdIns (4,5) P2 on the Golgi complex. Nat Cell Biol 1999; 1: 280-7.
- 30. Walch-Solimena C, Novick P. The yeast phosphatidylinositol-4-OH kinase Pik1 regulates secretion at the Golgi. Nat Cell Biol 1999; 1: 523-5.
- 31. Huijbregts RPH, Topalof L, Bankaitis VA. Lipid metabolism and regulation of membrane trafficking. Traffic 2000; 1: 195-202.
- 32. Burger KJ. Greasing membrane fusion and fission machineries. Traffic 2000; 1: 605-13.
- 33. Huttner WB, Schmidt A. lipids, lipid modification and lipid-protein interaction in membrane budding and fission- insights from the roles of endophilin A1 and synaptophysin in synaptic vesicle endocytosis. Curr Opin Neurobiol 2000; 10: 543-51.
- 34. Farsad K, Ringstad N, Takei K, Floyd SR, Rose K, De Camilli P. Generation of high curvature membranes mediated by direct endophilin bilayer interactions. J Cell Biol 2001; 155: 193-200.
- 35. Huttner WB, Schmidt A. Membrane curvature: a case of endofeelin’em leader. Trends Cell Biol 2002; 12: 155-8.
- 36. Cremona O, De Camilli P. Phospho-inositides in membrane traffic at the synapse. J Cell Sci 2001; 114: 1041-52.
- 37. Wenk MR, Pellegrini L, Klenchin VA, et al. PIP kinase Ig is the major PI (4,5) P2 synthesizing enzyme at the synapse. Neuron 2001; 32: 79-88.
- 38. Cremona O, Di Paolo G, Wenk MR, et al. Essential role of phospho-inositide metabolism in synaptic vesicle recycling. Cell 1999; 99: 179-88.
Liste des figures
Figure 1
Voies de synthèse et modifications des phospholipides impliqués dans les étapes de la formation de vésicules cytoplasmiques.
A. Cycle des phospho-inositides (PtdIns) montrant différentes phospho-inositides-kinases (en rouge) et phosphatases (en bleu). SHIP (SH2 domain-containing inositol polyphosphate 5-phosphatase) est une 5-phosphatase recrutée, par exemple, à la membrane du phagosome. Les voies représentées en noir (non discutées dans cet article) ont été mises en évidence principalement dans la dynamique des compartiments de l’endocytose impliquant la reconnaissance et la fusion de vésicules de transport et de compartiments endocytiques. B. Autres phospholipides dont le métabolisme conduit également à la formation de lipides impliqués dans le trafic vésiculaire. L’action de la phospholipase D (PLD), le plus souvent sur la phosphatidylcholine, libère l’acide phosphatidique qui intervient dans le recrutement et l’activation de protéines cytosoliques incluant des lipide-kinases, et le contrôle de la courbure membranaire. L’action de la phospholipase C (PLC) sur les phospho-inositides assure la formation des seconds messagers inositol-polyphosphates et diacylglycérol. Ce lipide est également susceptible de contrôler la dynamique des membranes intracellulaires, en interagissant avec la protéine kinase C par exemple.
Figure 2
Rôles des phospho-inositides dans le recrutement de protéines cytosoliques et les étapes successives de la formation d’une vésicule.
Le PtdIns-4,5-P2 recrute et stimule l’activité de la phospholipase D (PLD). L’acide phosphatidique formé par action de la phospholipase D, stimule la PtdIns 4-P 5-kinase. Une boucle de rétrocontrôle positif conduit à amplifier la production de PtdIns-4,5-P2. Cette réaction est également stimulée par le recrutement de facteurs d’échange nucléotidique sur ARF (ARF-GEF, guanine nucleotide exchange factors). PtdIns-4,5-P2 peut être également produit indépendamment de la phospholipase D, par stimulation directe par ARF (sous forme liée au GTP), de deux phospho-inositides kinases. PtdIns-4,5-P2 et PtdIns-3,4,5-P3 sont deux phospho-inositides clés pour le recrutement de protéines cytosoliques impliquées dans les étapes successives de la formation d’une vésicule. A. le bourgeonnement, B. l’étape précédant directement la fission, C. l’individualisation, après fission, de la vésicule dans le cytosplasme et la perte du manteau. Cette dernière étape est contrôlée par l’action d’une 5’-phosphatase déphosphorylant PtdIns-4,5-P2. Dans ce schéma, la formation des vésicules synaptiques par voie d’endocytose est prise en exemple; la 5’-phosphatase impliquée est la synaptojanine. Les différentes étapes de la formation d’une vésicule mettent en jeu des variations dans la coubure membranaire. Une courbure membranaire « positive » (indiquée en violet) est favorisée par l’assemblage des constituants du manteau et des protéines telles que l’amphiphysine et l’endophiline qui, en se liant à des phospholipides acides, induisent des déformations de la membrane. Une courbure membranaire « négative » (indiquée en rouge), pourrait être contrôlée par l’activité acyltransférase de l’endophiline utilisant l’acide lysophosphatidique comme substrat.
Figure 3
Modèle possible de l’action de l’endophiline dans la fission membranaire.
Ce mode d’action met en jeu l’interaction de l’endophiline, par l’intermédiaire d’un domaine SH3 (Src-homology 3 domain) localisé dans sa partie carboxy-terminale, avec le domaine riche en résidus de proline de la dynamine. La dynamine est assemblée, sous forme d’un anneau, autour du cou de la vésicule en formation. La conversion de l’acide lysophosphatidique (LPA) en acide phosphatidique (PA), catalysée par l’endophiline, permettrait de transformer un lyso-lipide en forme de cône inversé (LPA, cône bleu), en un lipide en forme de cône (PA, cône rouge) dont la géométrie pourrait favoriser une augmentation de la courbure négative de la membrane, au cou de la vésicule en formation (surtout lorsque la chaîne lipidique transférée sur le LPA est l’acide arachidonique, lipide poly-insaturé; voir aussi [6]). Cela pourrait, soit de façon concomitante avec l’action mécanique de la dynamine, soit indépendamment, entraîner la fission membranaire.