Corps de l’article
La notion de cellules souches cancéreuses date des années 1950 mais pendant longtemps les scientifiques n’ont pas été en mesure de prouver leur existence. Récemment, différents travaux ont permis d’apporter des rapports de causalité entre cellules souches et cellules cancéreuses [1]. En effet les cellules cancéreuses partagent un grand nombre de similarités avec les cellules cancéreuses. Il devient donc urgent de mieux comprendre ces cellules souches qui ne nous veulent pas que du bien… Mieux comprendre une cellule souche, c’est une étape probablement clé pour l’étude des mécanismes impliqués dans l’initiation du processus tumoral. L’épithélium intestinal est un exemple frappant de cette corrélation entre cellules souches et cellules cancéreuses [2].
Les cellules de l’épithélium intestinal sont régénérées tout au long de la vie. Dès la naissance se constitue le compartiment cryptique dans lequel résident les cellules prolifératives, cellules souches et progéniteurs (Figure 1). Suite à une division asymétrique, une cellule souche donne naissance à une nouvelle cellule souche et à un progéniteur destiné à se différencier. Il est bien établi que les cellules souches intestinales donnent naissance aux quatre types de cellules épithéliales différenciées : cellules neuroendocrines, cellules à mucus, entérocytes, et cellules de Paneth. L’homéostasie de l’épithélium intestinal est donc assurée grâce à un équilibre entre la production des cellules différenciées, leur migration dans la villosité vers la lumière intestinale, et leur élimination par apoptose [3]. Le renouvellement permanent de cet épithélium s’effectue en 3 à 5 jours chez la souris.
Figure 1
Organisation anatomique de l’intestin grêle.
Les cellules souches potentielles apparaissent en rouge, et sont localisées au fond de la crypte intestinale. Elles entretiennent un compartiment prolifératif constitué par leurs descendants immédiats, les progéniteurs. Ces cellules donnent naissance aux quatre types de cellules différenciées, les cellules à mucus, les cellules neuroendocrines, les entérocytes et les cellules de Paneth. Au fur et à mesure de leur différenciation, les cellules épithéliales issues des progéniteurs progressent le long de la villosité vers la lumière intestinale, où elles desquament par apoptose.
Les travaux de C. Leblond ont permis d’identifier pour la première fois en 1959 les cellules souches de l’épithélium intestinal grâce à leur capacité de rétention du BrdU. Ainsi 4 à 5 cellules souches, enfouies dans le fond de chaque crypte, sont responsables de l’auto-renouvellement incessant de cet épithélium (Figure 1). Malheureusement, ces cellules souches restent une énigme pour les chercheurs. Il n’y a jusqu’à ce jour aucun critère fiable phénotypique ou moléculaire permettant de les distinguer de leurs descendants immédiats, les progéniteurs. Récemment, la voie de signalisation Wnt, connue pour son rôle clé au cours du développement embryonnaire, a été impliquée chez l’adulte dans le contrôle des cellules souches de l’épithélium intestinal (Figure 2). Cela a été démontré par deux approches réciproques par inhibition ou activation de la signalisation Wnt. La délétion du facteur de transcription Tcf4, effecteur clé de la voie dans les cellules souches intestinales ou l’expression de Dickkopf-1 (Dkk-1) ((→) m/s 1998, n° 10, p. 1144) inhibiteur spécifique de la voie, entraîne l’absence du compartiment cryptique [4-6] (Figure 3). Parallèlement à ces découvertes, il fut démontré qu’une activation aberrante de cette voie de signalisation est retrouvée dans plus de 80 % des cancers colorectaux sporadiques par mutation du gène APC, suggérant que cette voie pouvait être impliquée à la fois dans le contrôle normal et pathologique du compartiment souche. Tout d’abord, le groupe de H. Clevers a montré que le programme génétique des cellules cancéreuses coliques était similaire à celui du compartiment cryptique [7]. Ensuite, notre équipe a récemment développé un nouveau modèle murin permettant d’étudier les effets précoces de l’activation de la signalisation Wnt dans l’épithélium intestinal. Nous avons invalidé de façon conditionnelle et inductible le gène Apc (Adenomatous Polyposis Coli), régulateur négatif de la voie [8] (Figure 2). Cette stratégie nous a permis d’étudier les conséquences de l’absence d’Apc dans l’ensemble des cellules épithéliales de l’intestin, cellules prolifératives et cellules différenciées. Très rapidement après la perte d’Apc, s’installe une dysplasie sévère caractérisée par un accroissement du compartiment de prolifération, des anomalies de la différenciation et un retard de migration cellulaire (Figure 3). Dans la villosité, aucune anomalie morphologique n’est évidente, les cellules conservent leur statut post-mitotique bien que le gène codant la cycline D1, gène cible de la voie de signalisation relayée par Wnt, soit fortement induit. Ce résultat est important puisqu’il suggère que les cellules post-mitotiques ne sont pas des cibles d’Apc lors du développement du processus tumoral intestinal. Seules les cellules du compartiment prolifératif semblent être capables de s’engager dans un processus tumoral. Cela confirme un postulat intuitif selon lequel, seules les cellules souches de l’intestin et leurs descendants immédiats résident suffisamment de temps dans ce compartiment prolifératif pour acquérir les différentes mutations oncogéniques nécessaires à la transformation tumorale. Toutefois, en l’absence de marqueur spécifique des cellules souches intestinales, il est difficile de connaître la sensibilité respective des cellules souches et de leurs descendants directs à l’activation constitutive de la voie de signalisation Wnt liée à l’absence d’Apc. Le modèle murin que nous avons développé conduisant à une amplification de ce compartiment souche devrait se révéler un puissant outil pour leur caractérisation. Tous ces arguments nous incitent à proposer que l’initiation du processus tumoral intestinal serait consécutive à un dérèglement du contrôle homéostatique des cellules souches. L’identification de marqueurs spécifiques reste une priorité, de même que le développement d’un système d’analyse fonctionnel permettant de vérifier le potentiel d’auto-renouvellement de ces cellules souches, et leur capacité à se différencier en plusieurs types cellulaires. De nombreux travaux ont permis d’impliquer la voie de signalisation Wnt dans l’amplification de différents types de cellules souches, embryonnaires, hématopoïétiques, neuronales et mammaires [9-11]. Dans l’intestin, la compréhension des mécanismes qui régulent le renouvellement des cellules souches apparaît de plus en plus essentiel pour mieux appréhender les processus moléculaires de l’homéostasie intestinale et du développement tumoral et le développement de nouvelles thérapies.
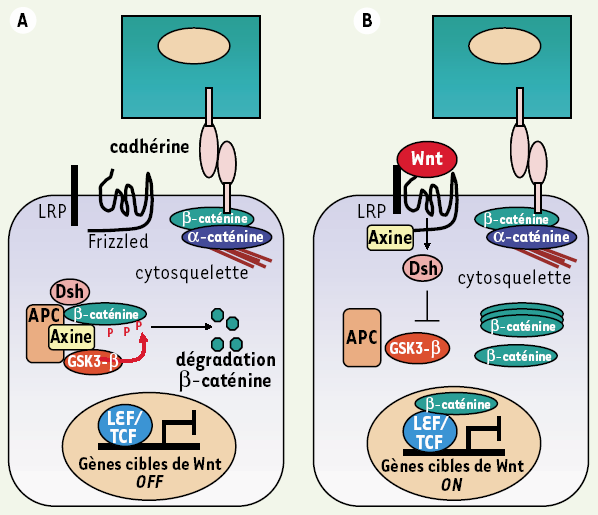
Figure 2
Voie de signalisation Wnt.
En l’absence de Wnt (A), la β-caténine est incluse dans un complexe protéique comprenant l’axine, APC et la kinase GSK3-β (glycogen synthase kinase 3β). Elle est phosphorylée par cette dernière, ce qui entraîne sa dégradation par le protéasome. La β-caténine peut aussi être liée à la cadhérine et contrôler l’adhérence intercellulaire. En présence du ligand Wnt (B) lié au complexe récepteur frizzled/LRP, la β-caténine se dissocie du complexe APC/Axine/GSK, n’est pas phosphorylée, et migre dans le noyau où elle se lie aux facteurs de transcription LEF/TCF, ce qui déclenche la transcription de gènes cibles (adapté de [10]).
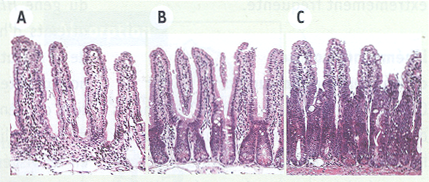
Figure 3
Effets immédiats des modulations de la voie de signalisation Wnt sur le compartiment prolifératif de l’épithélium intestinal murin.
A. Invalidation de la voie de signalisation Wnt provoquée par l’injection rétro-orbitaire d’une préparation adénovirale codant pour la protéine Dkk-1. Coupe histologique réalisée cinq jours après l’injection révélant une absence du compartiment prolifératif. B. Muqueuse saine d’un animal contrôle adulte présentant une activation physiologique de la voie de signalisation Wnt. C. Activation de la voie Wnt induite par l’invalidation conditionnelle du gène Apc dans l’ensemble des cellules épithéliales intestinales, avec apparition, dès cinq jours, d’une expansion du compartiment prolifératif.
Parties annexes
Références
- 1. Clarke MF, Fuller M. Stem cells and cancer : two faces of eve.Cell 2006 ; 124 : 1111-5.
- 2. Radtke F, Clevers H. Self-renewal and cancer of the gut : two sides of a coin.Science 2005 ; 307 : 1904-9.
- 3. Bjerknes M, Cheng H. Gastrointestinal stem cells. II. Intestinal stem cells.Am J Physiol Gastrointest Liver Physiol 2005 ; 289 : G381-7.
- 4. Korinek V, Barker N, Moerer P, et al. Depletion of epithelial stem-cell compartments in the small intestine of mice lacking Tcf-4.Nat Genet 1998 ; 19 : 379-83.
- 5. Kuhnert F, Davis CR, Wang HT, et al. Essential requirement for Wnt signaling in proliferation of adult small intestine and colon revealed by adenoviral expression of Dickkopf-1. Proc Natl Acad Sci USA 2004 ; 101 : 266-71.
- 6. Pinto D, Gregorieff A, Begthel H, Clevers H. Canonical Wnt signals are essential for homeostasis of the intestinal epithelium.Genes Dev 2003 ; 17 : 1709-13.
- 7. Van de Wetering M, Sancho E, Verweij C, et al. The beta-catenin/TCF-4 complex imposes a crypt progenitor phenotype on colorectal cancer cells.Cell 2002 ; 111 : 241-50.
- 8. Andreu P, Colnot S, Godard C, et al. Crypt-restricted proliferation and commitment to the Paneth cell lineage following Apc loss in the mouse intestine.Development 2005 ; 132 : 1443-51.
- 9. Kielman MF, Rindapaa M, Gaspar C, et al. Apc modulates embryonic stem-cell differentiation by controlling the dosage of beta-catenin signaling.Nat Genet 2002 ; 32 : 594-605.
- 10. Reya T, Clevers H. Wnt signalling in stem cells and cancer. Nature 2005 ; 434 : 843-50.
- 11. Woodward WA, Chen MS, Behbod F, Rosen JM. On mammary stem cells.J Cell Sci 2005 ; 118 : 3585-94.
Liste des figures
Figure 1
Organisation anatomique de l’intestin grêle.
Les cellules souches potentielles apparaissent en rouge, et sont localisées au fond de la crypte intestinale. Elles entretiennent un compartiment prolifératif constitué par leurs descendants immédiats, les progéniteurs. Ces cellules donnent naissance aux quatre types de cellules différenciées, les cellules à mucus, les cellules neuroendocrines, les entérocytes et les cellules de Paneth. Au fur et à mesure de leur différenciation, les cellules épithéliales issues des progéniteurs progressent le long de la villosité vers la lumière intestinale, où elles desquament par apoptose.
Figure 2
Voie de signalisation Wnt.
En l’absence de Wnt (A), la β-caténine est incluse dans un complexe protéique comprenant l’axine, APC et la kinase GSK3-β (glycogen synthase kinase 3β). Elle est phosphorylée par cette dernière, ce qui entraîne sa dégradation par le protéasome. La β-caténine peut aussi être liée à la cadhérine et contrôler l’adhérence intercellulaire. En présence du ligand Wnt (B) lié au complexe récepteur frizzled/LRP, la β-caténine se dissocie du complexe APC/Axine/GSK, n’est pas phosphorylée, et migre dans le noyau où elle se lie aux facteurs de transcription LEF/TCF, ce qui déclenche la transcription de gènes cibles (adapté de [10]).
Figure 3
Effets immédiats des modulations de la voie de signalisation Wnt sur le compartiment prolifératif de l’épithélium intestinal murin.
A. Invalidation de la voie de signalisation Wnt provoquée par l’injection rétro-orbitaire d’une préparation adénovirale codant pour la protéine Dkk-1. Coupe histologique réalisée cinq jours après l’injection révélant une absence du compartiment prolifératif. B. Muqueuse saine d’un animal contrôle adulte présentant une activation physiologique de la voie de signalisation Wnt. C. Activation de la voie Wnt induite par l’invalidation conditionnelle du gène Apc dans l’ensemble des cellules épithéliales intestinales, avec apparition, dès cinq jours, d’une expansion du compartiment prolifératif.