Résumés
Résumé
Le diagnostic pré-implantatoire (DPI) a pour objectif l’étude des caractéristiques génétiques d’un embryon âgé de trois jours. Il offre ainsi à des couples ayant un risque élevé de transmettre une maladie héréditaire une alternative au diagnostic prénatal (DPN). Si, au début de son application, les pathologies et les couples pris en charge ainsi que le cadre réglementaire du DPI étaient très proches de ceux du DPN, des indications propres au DPI émergent peu à peu. Les pathologies prises en charge, notamment, se diversifient, en particulier dans les pays où l’absence de réglementation autorise toutes les pratiques. Certaines de ces applications ne sont d’ailleurs pas sans poser de sérieux problèmes éthiques. Même en France, où cette activité est particulièrement encadrée, la récente modification de la loi reflète cette évolution.
Summary
Preimplantation genetic diagnosis (PGD) purpose is to assess the genetic status of 3 day-old embryos. PGD offers thus to couples « at-risk » of a genetic disorder an earlier option to prenatal diagnosis (PND). At the beginning, PGD’s indications, patients and law were very closed to PND, but PGD specificities are gradually raising. Particularly, indications vary considerably in countries where the absence of law authorizes all the practices. Some of these applications are moreover raising serious ethical issues. Even in France, where this activity is particularly supervised, the recent modification to the law marks this evolution.
Corps de l’article
Le diagnostic pré-implantatoire consiste en l’analyse génétique de cellules prélevées à partir d’embryons issus de la fécondation in vitro. Il permet à des couples à risque élevé de transmettre une maladie génétique d’éviter l’épreuve du diagnostic prénatal et d’une éventuelle interruption de grossesse. Il impose cependant le recours à une aide médicale à la procréation pour des couples qui ne présentent souvent pas de problème de stérilité. Du fait des contraintes et des faibles chances de succès de la fécondation in vitro, il reste cependant une technique d’exception. La France s’est dotée de lois encadrant rigoureusement cette activité. Inversement, ce type de diagnostic génétique se développe rapidement dans d’autres pays pour des indications qui posent parfois des problèmes éthiques.
Diagnostic prénatal et diagnostic pré-implantatoire
Le diagnostic prénatal (DPN) correspond aux pratiques médicales ayant pour objectif de détecter in utero, chez l’embryon ou le foetus, une affection d’une particulière gravité. Le diagnostic pré-implantatoire (DPI) est une variante très précoce du diagnostic prénatal : il consiste à analyser le patrimoine génétique d’une ou deux cellules embryonnaires, prélevées à partir d’embryons issus de fécondation in vitro (FIV), au troisième jour de leur développement (Figure 1). Il permet de ne transférer que les embryons indemnes de la maladie génétique présente dans la famille, bien qu’éventuellement porteurs du trait. Il évite ainsi aux couples concernés l’épreuve du diagnostic prénatal et l’éventuelle interruption médicale de grossesse qui s’ensuit parfois. Deux grands types d’analyse génétique peuvent être réalisées : une hybridation in situ fluorescente (FISH) sur noyau interphasique, à la recherche d’une anomalie chromosomique, ou une amplification génomique (PCR), à la recherche d’une anomalie génique. Le statut de l’embryon (sain, atteint) est déterminé dans la journée, permettant le transfert des embryons sains dans l’utérus de la patiente au quatrième jour de leur développement.
Figure 1
Technique du diagnostic pré-implantatoire.
Après stimulation hormonale et déclenchement de l’ovulation, une ponction ovarienne est réalisée. Les ovocytes ainsi recueillis sont inséminés par injection intracytoplasmique d’un spermatozoïde (ICSI), afin d’éviter une éventuelle contamination par des spermatozoïdes accolés à la zone pellucide. Au troisième jour de développement embryonnaire, une biopsie est réalisée : après perforation de la zone pellucide par un laser, une à deux cellules sont prélevées sous contrôle microscopique. Le diagnostic est ensuite réalisé sur la ou les deux cellules séparément, soit par des méthodes de diagnostic moléculaire (PCR, DPI génique), soit par des méthodes d’analyse chromosomique (FISH - hybridation in situ fluorescente, DPI chromosomique). Le transfert des embryons sains dans l’utérus de la patiente est réalisé au quatrième jour du développement embryonnaire.
DPI : la réglementation française
Le DPI s’est développé en Grande-Bretagne et a d’abord été appliqué à la sélection d’embryons féminins dans le cas de maladies récessives liées à l’X [1]. Les progrès techniques ont ensuite permis la réalisation du premier DPI de mucoviscidose en 1992 [2]. Dix ans plus tard, seulement, la technique s’est implantée en France, probablement du fait de la crainte de dérives eugéniques. La France s’est dotée d’un arsenal législatif visant à prévenir ces dérives potentielles. Ainsi, en 1994, les lois de bio-éthique ont autorisé la pratique du diagnostic pré-implantatoire sous certaines conditions (article L2131-4) : le couple doit avoir une forte probabilité de donner naissance à un enfant atteint d’une maladie génétique d’une particulière gravité, reconnue comme incurable au moment du diagnostic. L’anomalie ou les anomalies responsables doivent avoir été identifiées préalablement chez les parents, et le diagnostic doit se limiter à l’affection considérée. Un consentement de chacun des parents doit être obtenu.
Quatre ans plus tard, les décrets d’application de cette loi sont enfin parus et, en 1999, deux centres ont été autorisés à pratiquer ce type de diagnostic. Il s’agissait du CHU de Strasbourg et de la Fédération d’Activité Médicale parisienne constituée de quatre services de l’AP-HP, les services de génétique et de cytogénétique de l’hôpital Necker-Enfants Malades, et ceux de gynécologie-obstétrique et de biologie de la reproduction de l’hôpital Antoine-Béclère. Aujourd’hui, avec l’accréditation du CHU de Montpellier, ce sont trois centres en France qui exercent cette activité, et participent au Groupe d’étude du DPI (GET-DPI). En France, le DPI est donc strictement encadré au plan législatif, et se limite au diagnostic de maladies génétiques, dans le cadre d’un risque élevé d’atteinte embryonnaire. La loi française exclut ainsi tout « dépistage » en matière de DPI.
Le texte de loi s’est récemment modifié, autorisant le typage HLA d’embryons dans le but de pouvoir offrir à un aîné malade une greffe de sang de cordon prélevé à la naissance chez l’enfant conçu après « DPI » (loi n° 2004-800 du 6 août 2004). Cette indication est limitée en France aux seuls couples ayant un risque de maladie génétique, ce qui a donné naissance au concept du « bébé du double espoir ». Les décrets ne sont pourtant pas publiés un an après, ce qui pose de difficiles problèmes pour les couples en attente.
Dans le reste du monde, le DPI n’étant souvent pas aussi réglementé, son activité s’est considérablement développée, pour des indications qui posent parfois de sérieuses questions éthiques. Le Consortium européen de diagnostic pré-implantatoire (European society of human reproduction and embryology, ESHRE-PGD Consortium), fondé en 1997, collecte l’ensemble des données mondiales de DPI des centres qui y sont adhérents. Ces données font l’objet de publications régulières [3-6].
Pratique du DPI
Pathologies prises en charge
Les pathologies génétiques prises en charge sont en grande majorité des maladies fréquentes et graves (Tableau I). Parmi les indications chromosomiques, les translocations réciproques représentent la moitié des DPI réalisés (40 %) [3-6], tandis que les DPI pour translocations robertsoniennes sont minoritaires (30 % environ) [3-6]. Parmi les maladies monogéniques récessives, la mucoviscidose reste la première indication, notamment lorsqu’elle s’associe à une agénésie des canaux déférents, car les couples ont alors, en plus du risque génétique, un problème d’infertilité. La dystrophie myotonique de Steinert est la première indication parmi les maladies autosomiques dominantes. Aujourd’hui, la liste des pathologies prises en charge par DPI ne cesse de s’allonger, et l’apport de nouvelles techniques d’amplification du génome à partir de cellules uniques [7, 8] devrait permettre d’éviter la phase longue et ardue de mise au point du diagnostic sur cellules isolées, facilitant l’accès à cette technique des couples à risque de maladies plus rares.
Tableau I
Principales indications prises en charge par DPI (évolution 1997-2001).
Au début des années 2000, l’activité de DPI pour recherche d’aneuploïdie embryonnaire a pris un essor considérable, puisqu’elle représente aujourd’hui la moitié des indications de DPI dans le monde (PGS, Preimplantation genetic screening, Tableau I). Ce dépistage à la recherche d’anomalies du nombre de certains chromosomes (en pratique, les chromosomes X, Y, 13, 16, 18, 21, et 22 sont le plus souvent testés) a quatre indications majeures : un âge maternel supérieur à 35 ans, des échecs répétés de la FIV (supérieur ou égal à 3), plus de 2 fausses couches spontanées alors que les parents ont un caryotype normal et, enfin, un certain nombre d’autres situations (antécédent de trisomie, triploïdie…). Dans le même temps, les premiers diagnostics de sexe pour convenance personnelle (PGD-SS, social sexing ou family balancing) ont été rapportés (4 % de l’activité rapportée par le consortium en 2001) [6]. Du fait de l’encadrement juridique, l’activité des centres de DPI français n’est pas superposable à l’activité mondiale, la loi française interdisant aussi bien le PGS que le PGD-SS.
Dans le centre de DPI de la FAMA (Fédération d’activités médicales associées) Necker-Béclère, les couples sont reçus dans le cadre d’une consultation multidisciplinaire « en trinôme » (gynécologue, généticien et biologiste de la reproduction). En effet, l’indication d’une telle procédure semble bien double : indication d’un diagnostic génétique d’une part, et prise en charge par fécondation in vitro, d’autre part. Ainsi, 441 cycles de DPI ont débuté dans le centre de DPI Necker-Béclère, la moitié pour des maladies monogéniques et l’autre moitié pour des indications chromosomiques ; en cinq ans, 245 DPI ont été réalisés, 112 pour des indications géniques, et 133 pour des indications chromosomiques.
En France, à côté des maladies fréquentes (telles que la mucoviscidose, la maladie de l’X fragile, l’amyotrophie spinale, la maladie de Steinert, et la détermination du sexe des embryons pour les maladies récessives liées à l’X), il a été proposé de répartir les indications plus rares entre les différents centres français. Ainsi, le centre de Montpellier s’est plutôt spécialisé dans les diagnostics génétiques de prédisposition au cancer, celui de Strasbourg dans la chorée de Huntington et l’achondroplasie, celui de Paris dans le diagnostic spécifique d’affections liées au chromosome X (notamment le déficit en OTC, ornithine carbamyl transférase) [9], les myopathies de Duchenne-Becker, l’hydrocéphalie liée à l’X, l’adrénoleucodystrophie, l’hémophilie A et l’incontinentia pigmenti [10], et, enfin, une application plus particulière, le diagnostic pré-implantatoire des mutations de l’ADN mitochondrial [11, 12]. Cependant, l’accès au DPI se modifie et l’activité des centres se diversifie de plus en plus. À titre d’exemple, en 2004, sept nouveaux tests sur cellule unique ont été modélisés dans notre laboratoire, ce qui conduit à prendre en charge aujourd’hui dans notre centre 13 maladies différentes et non plus 5 comme c’était le cas en 2000. Sur le plan cytogénétique, le diagnostic pré-implantatoire de tous les remaniements chromosomiques simples (impliquant au maximum deux chromosomes) est actuellement proposé.
Couples concernés
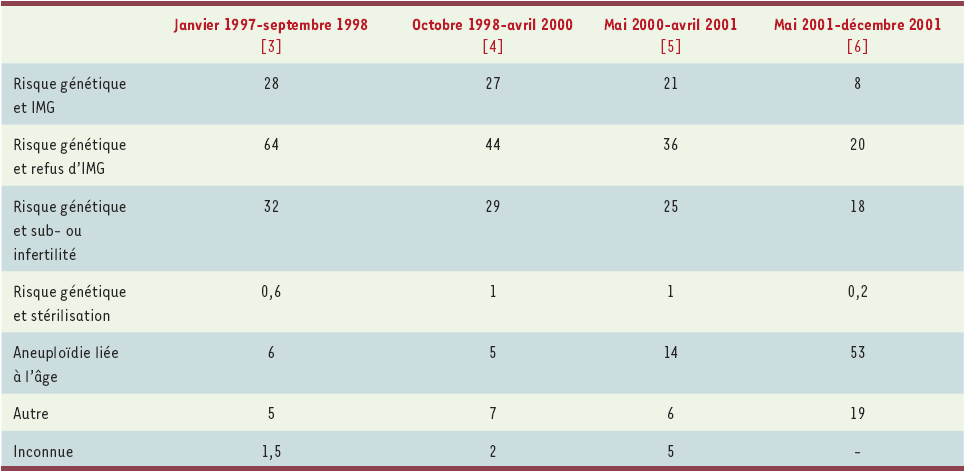
Parmi les patients pris en charge pour DPI, il existe une forte proportion (1/4 environ) de couples ayant, en plus du risque de maladies génétiques, un problème de subfertilité ou d’infertilité (Tableau II). Environ 1/4 des couples ont connu la douloureuse expérience d’une interruption de grossesse pour raison médicale, et 40 % ont eu au moins une fausse couche spontanée (ce qui est majoritairement le cas des translocations réciproques). Moins de 20 % des couples qui font la demande d’un DPI ont un enfant sain vivant [3-6]. Ces pourcentages varient bien sûr considérablement si le PGS est inclus : dans ce cas, le nombre de couples ayant vécu une interruption médicale de grossesse chute à 11 %, mais seulement 14 % ont un enfant sain vivant [3-6]. Enfin, la raison principale pour ne pas s’engager dans une démarche de DPI a changé : si la raison invoquée auparavant était la lourdeur du traitement de la fécondation in vitro et de l’ICSI, il s’agit plutôt à présent du faible taux de succès offert par cette procédure [3-6].
Tableau II
Raison principale (%) à l’origine de la demande de DPI (évolution 1997-2001).
Limites du DPI
La prouesse technologique d’un DPI est d’obtenir un nombre suffisant d’embryons à haut potentiel de développement, dont il faut déterminer le diagnostic génétique à partir d’une seule cellule. L’absence de critères non invasifs permettant de connaître la viabilité d’un embryon réduit les équipes clinicobiologiques à obtenir un nombre élevé d’embryons de bonne morphologie.
Dans le cadre du diagnostic chromosomique, les mosaïques embryonnaires sont fréquentes et source d’erreur diagnostique. Dans le cadre du DPI génique, en dehors des impossibilités du diagnostic (mise en évidence de duplication, analyse de fragment de grande taille), le peu de matériel biologique disponible exige de recourir à une optimisation des techniques de PCR pour obtenir le niveau de sensibilité requis. Il en résulte un risque de contamination de la réaction par d’autres cellules ou par des fragments d’ADN préalablement amplifiés. Ces contaminations peuvent être, là encore, source d’erreur diagnostique. Par ailleurs, il persiste un risque inhérent à la PCR sur cellule unique, celui du phénomène d’allèle drop-out (amplification d’un seul des deux allèles présents dans la cellule [13]). Les conséquences de ce phénomène peuvent être dramatiques, par exemple dans le cas d’une pathologie autosomique dominante où seul l’allèle sain est amplifié, conduisant à méconnaître l’allèle atteint dans la cellule et à une erreur diagnostique. Enfin, à côté de ces difficultés, le bref délai du diagnostic (12 à 24 heures) imposé par la nécessité du transfert rapide des embryons impose le recours à des techniques d’analyse elles-mêmes rapides.
Le consortium de DPI a fait état de 11 erreurs diagnostiques en ne considérant que les DPI effectués dans le cadre de diagnostic génétique (soit environ 400 grossesses), c’est-à-dire en excluant les dépistages (PGS) et les diagnostics de sexe pour convenance [3-6] : deux erreurs ont été rapportées dans le cadre d’un diagnostic de sexe, l’une pour une myopathie de Duchenne et l’autre pour une rétinite pigmentaire liée à l’X ; des erreurs ont également été rapportées dans le cadre d’une β-thalassémie, de la dystrophie myotonique de Steinert et de la neuropathie amyloïde ; enfin, trois erreurs ont été rapportées dans le cadre d’un diagnostic de la mucoviscidose, et trois erreurs diagnostiques concernent un DPI chromosomique. Au total, les données les plus récentes font état d’un risque d’erreur de 2,2 %, comprenant un risque d’erreur d’environ 0,9 % à la suite d’un diagnostic chromosomique, et de 9,1 % après PCR [6]. Ce risque d’erreur justifie de proposer un diagnostic prénatal de confirmation pour toute grossesse après DPI (Tableau III). Si le nombre absolu de confirmations est stable (environ 50 % des enfants nés après DPI ont bénéficié d’une vérification du diagnostic réalisé au stade pré-implantatoire), la période où cet examen est réalisé évolue : ainsi, la proportion de diagnostics réalisés à la naissance augmente (Tableau III). On peut y voir le reflet de la part importante de DPI de dépistage à la recherche d’aneuploïdie embryonnaire, qui ne justifie pas de recourir à un diagnostic prénatal de confirmation, mais aussi le refus d’un grand nombre de patientes de recourir à un examen invasif une fois la grossesse obtenue après FIV et DPI.
Tableau III
Taux de confirmations (%) pré- et postnatales du DPI (évolution 1997-2001).
Échecs et succès
La principale contrainte du DPI est la nécessité de recourir à une fécondation in vitro pour des couples souvent normalement fertiles. D’après les données publiées, le risque d’annulation avant la ponction ovocytaire est de près de 30 %, compte tenu des critères de superovulation exigés, et la probabilité d’aller jusqu’au transfert d’embryon est d’environ 75 %. Actuellement, les chances pour une femme d’être enceinte après transfert embryonnaire sont inférieures à celles d’une fécondation in vitro « classique » (taux d’implantation de 20 %, contre 28 %). Au total, les chances d’avoir un enfant sain au terme de la procédure sont d’environ 16 %. Dans notre centre, nous limitons à 3 le nombre de tentatives de DPI. En cinq années d’activité, la FAMA a été à l’origine de 47 grossesses, et 41 enfants sont nés grâce à cette technique. Ces enfants bénéficient d’une consultation à l’âge de 2 ans, puis d’un suivi sous forme d’un questionnaire adressé aux parents.
Le débat éthique
Il concerne en premier lieu les développements possibles de cette activité. Si, dans un premier temps, les indications du DPI ont été celles du diagnostic prénatal, elles ont depuis beaucoup évolué : des applications très diverses du DPI se sont développées, notamment la détermination de la ploïdie de l’embryon avant transfert lors de fécondation in vitro (aneuploidy screening), le typage HLA des embryons dans le cadre d’affections hématologiques (« bébés-médicaments ») et, enfin, la très controversée détermination du sexe embryonnaire pour convenance personnelle (social sexing). La recherche d’aneuploïdie embryonnaire représente aujourd’hui quasiment la moitié des DPI rapportés et le sexage d’embryon pour des raisons non médicales 4 % de cette activité. L’opposition française au « diagnostic » de sexe embryonnaire pour convenance personnelle a été exprimée sans ambiguïté [14]. Au niveau mondial, le bénéfice d’une recherche d’aneuploïdie embryonnaire reste largement discuté [15-17].
Un développement plus récent concerne la possibilité de sélectionner des embryons selon les antigènes d’histocompatibilité lymphocytaire (HLA) qu’ils ont reçus de leurs parents, de sorte qu’ils soient immunologiquement compatibles avec un frère ou une soeur malade et nécessitant une greffe de moelle [18]. Une telle compatibilité est recherchée afin que l’enfant, une fois né, puisse être un donneur éventuel de sang de cordon : ainsi est né le concept du « bébé médicament » (encore appelé « bébé donneur », « bébé docteur » ou « bébé du double espoir »), et avec lui le débat sur l’instrumentalisation éventuelle de la procréation. La France vient de modifier ses textes, en autorisant le typage HLA d’embryons dans le cadre d’une maladie héréditaire ; elle interdit en revanche ce typage lorsqu’il n’y a pas de risque de maladie héréditaire [19]. La position du comité d’éthique français avait en effet été claire : « La justification première du DPI est la naissance d’un enfant indemne d’une affection génétique grave qui le menace. La recherche d’une compatibilité immunologique avec un aîné malade doit toujours venir en seconde position ». En d’autre termes, l’absence de bénéfice direct pour l’embryon interdit de recourir à ce type de procédure. Cependant, cette application se développe dans d’autres pays dans le cas où un premier enfant atteint de cancer pourrait bénéficier d’une greffe de cellules de sang de cordon compatible. Dans ces pays, l’absence de réglementation autorise ces pratiques, devenant ainsi une source de nomadisme médical.
Enfin, parmi les indications géniques, la prise en charge de pathologies dominantes, le plus souvent à révélation tardive, augmente : plusieurs publications font ainsi état de diagnostics pré-implantatoires de gènes de prédisposition aux cancers (cancer du côlon dans la polypose familiale colique [20], cancers du sein et de l’ovaire [21], rétinoblastome, syndrome de Li et Fraumeni, syndrome de Von Hippel Lindau [22]), et de maladies neurodégénératives comme la maladie d’Alzheimer [23]. Le diagnostic prénatal de ces affections est largement discuté et le diagnostic pré-implantatoire est souvent considéré comme la moins mauvaise solution pour ces couples qui refusent de prendre le risque d’avoir un enfant atteint. La demande de DPI pour ces affections est de plus en plus importante.
Conclusions : en pratique…
Le DPI s’installe progressivement en France et trouve sa place parmi les outils diagnostiques de la médecine contemporaine. Les résultats mondiaux du DPI présentés annuellement dans le cadre du Consortium européen de diagnostic pré-implantatoire font état d’un accroissement important de l’activité des centres. La demande de DPI va donc croissante, y compris dans les indications strictement médicales. L’adéquation des moyens devrait se préparer dans ce sens.
Parties annexes
Références
- 1. Jones KW, Singh L, Edwards RG. The use of probes for the Y chromosome in preimplantation embryo cells. Hum Reprod 1987 ; 2 : 439-45.
- 2. Handyside AH, Lesko JG, Tarin JJ, et al. Birth of a normal girl after in vitro fertilization and preimplantation diagnostic testing for cystic fibrosis. N Engl J Med 1992 ; 327 : 905-9.
- 3. Geraedts J, Handyside A, Harper J, et al. ESHRE Preimplantation genetic diagnosis (PGD) Consortium : preliminary assessment of data from January 1997 to September 1998. ESHRE PGD Consortium steering committee. Hum Reprod 1999 ; 14 : 3138-48.
- 4. Geraedts J, Handyside A, Harper J, et al. European society of human reproduction and embryology preimplantation genetic diagnosis consortium steering committee. ESHRE preimplantation genetic diagnosis (PGD) consortium : data collection II (May 2000). Hum Reprod 2000 ; 15 : 2673-83.
- 5. ESHRE PGD Consortium steering committee. ESHRE Preimplantation genetic diagnosis consortium : data collection III (May 2001). Hum Reprod 2002 ; 17 : 233-46.
- 6. Sermon K, Moutou C, Harper J, et al. ESHRE PGD Consortium data collection IV : May-December 2001. Hum Reprod 2005 ; 20 : 19-34.
- 7. Handyside AH, Robinson MD, Simpson RJ, et al. Isothermal whole genome amplification from single and small numbers of cells : a new era for preimplantation genetic diagnosis of inherited disease. Mol Hum Reprod 2004 ; 10 : 767-72.
- 8. Hellani A, Coskun S, Benkhalifa M, et al. Multiple displacement amplification on single cell and possible PGD applications. Mol Hum Reprod 2004 ; 10 : 847-52.
- 9. Ray PF, Gigarel N, Bonnefont JP, et al. First specific preimplantation genetic diagnosis for ornithine transcarbamylase deficiency. Prenat Diagn 2000 ; 20 : 1048-54.
- 10. Gigarel N, Frydman N, Burlet P, et al. Single cell co-amplification of polymorphic markers for the indirect preimplantation genetic diagnosis of hemophilia A, X-linked adrenoleukodystrophy, X-linked hydrocephalus, and incontinentia pigmenti loci on Xq28. Hum Genet 2004 ; 114 : 298-305.
- 11. Gigarel N, Ray PF, Burlet P, et al. Single cell quantification of the 8993T>G NARP mitochondrial DNA mutation by fluorescent PCR. Mol Genet Metab 2005 ; 84 : 289-92.
- 12. Steffann J, Frydman N, Gigarel N, et al. Analysis of mtDNA variant segregation during early human embryonic development : a tool for successful NARP preimplantation diagnosis. J Med Genet 2005 (online).
- 13. Ray PF, Handyside AH. Increasing the denaturation temperature during the first cycles of amplification reduces allele dropout from single cells for preimplantation genetic diagnosis. Mol Hum Reprod 1996 ; 2 : 213-8.
- 14. Ray PF, Munnich A, Nisand I, et al. The place of “social sexing” in medicine and science. Hum Reprod 2002 ; 17 : 248-9.
- 15. Munne S, Chen S, Fischer J, et al. Preimplantation genetic diagnosis reduces pregnancy loss in women aged 35 years and older with a history of recurrent miscarriages. Fertil Steril 2005 ; 84 : 331-5.
- 16. Platteau P, Staessen C, Michiels A, et al. Preimplantation genetic diagnosis for aneuploidy screening in women older than 37 years. Fertil Steril 2005 ; 84 : 319-24.
- 17. Staessen C, Platteau P, Van Assche E, et al. Comparison of blastocyst transfer with or without preimplantation genetic diagnosis for aneuploidy screening in couples with advanced maternal age : a prospective randomized controlled trial. Hum Reprod 2004 ; 19 : 2849-58.
- 18. Verlinsky Y, Rechitsky S, Schoolcraft W, et al. Preimplantation diagnosis for Fanconi anemia combined with HLA matching. JAMA 2001 ; 285 : 3130-3.
- 19. Verlinsky Y, Rechitsky S, Sharapova T, et al. Preimplantation HLA testing. JAMA 2004 ; 291 : 2079-85.
- 20. Ao A, Wells D, Handyside AH, et al. Preimplantation genetic diagnosis of inherited cancer : familial adenomatous polyposis coli. J Assist Reprod Genet 1998 ; 15 : 140-4.
- 21. Simpson JL, Carson SA, Cisneros P. Preimplantation genetic diagnosis (PGD) for heritable neoplasia. J Natl Cancer Inst Monogr 2005 ; 34 : 87-90.
- 22. Rechitsky S, Verlinsky O, Chistokhina A, et al. Preimplantation genetic diagnosis for cancer predisposition. Reprod Biomed Online 2002 ; 5 : 148-55.
- 23. Verlinsky Y, Rechitsky S, Verlinsky O, et al. Preimplantation diagnosis for early-onset Alzheimer disease caused by V717L mutation. JAMA 2002 ; 287 : 1018-21.
Liste des figures
Figure 1
Technique du diagnostic pré-implantatoire.
Après stimulation hormonale et déclenchement de l’ovulation, une ponction ovarienne est réalisée. Les ovocytes ainsi recueillis sont inséminés par injection intracytoplasmique d’un spermatozoïde (ICSI), afin d’éviter une éventuelle contamination par des spermatozoïdes accolés à la zone pellucide. Au troisième jour de développement embryonnaire, une biopsie est réalisée : après perforation de la zone pellucide par un laser, une à deux cellules sont prélevées sous contrôle microscopique. Le diagnostic est ensuite réalisé sur la ou les deux cellules séparément, soit par des méthodes de diagnostic moléculaire (PCR, DPI génique), soit par des méthodes d’analyse chromosomique (FISH - hybridation in situ fluorescente, DPI chromosomique). Le transfert des embryons sains dans l’utérus de la patiente est réalisé au quatrième jour du développement embryonnaire.
Liste des tableaux
Tableau I
Principales indications prises en charge par DPI (évolution 1997-2001).
Tableau II
Raison principale (%) à l’origine de la demande de DPI (évolution 1997-2001).
Tableau III
Taux de confirmations (%) pré- et postnatales du DPI (évolution 1997-2001).