Corps de l’article
Un des aspect fondamentaux du développement de l’embryon réside dans la constante diversification des types cellulaires. L’une des premières stratégies utilisée par l’embryon en phase de croissance pour débuter ce processus de diversification consiste en la formation de trois feuillets embryonnaires, le mésoderme, l’ectoderme et l’endoderme. Dès lors, ces feuillets vont communiquer entre eux de façon à spécifier des zones cellulaires et à leur donner l’une ou l’autre identité. C’est ainsi, par exemple, que sont ébauchés la majorité des organes. Au niveau moléculaire, ce mécanisme de spécification se traduit par la convergence de signaux qui vont activer certains gènes clés dans le noyau des cellules cibles. Ces gènes clés, typiquement des facteurs de transcription, vont à leur tour contrôler l’expression de gènes cibles et établir ainsi une nouvelle combinaison génique, qui donnera à la cellule une nouvelle identité. Les gènes de la famille Pax illustrent parfaitement ce processus ((→) m/s 1997, n° 2, p. 147). En effet, plusieurs d’entre eux jouent un rôle important dans la détermination précoce de lignées cellulaires ou de structures embryonnaires.
En se fondant sur les homologies de séquence, on peut distinguer quatre classes parmi les neuf membres de la famille Pax: Pax3/7, Pax4/6, Pax1/9 et finalement Pax2/5/8. Cette conservation de séquence confère aux membres d’une même classe une activité fonctionnelle largement redondante. Ces facteurs de transcription reconnaissent effectivement la même séquence consensus de liaison à l’ADN [1] et peuvent se substituer l’un à l’autre in vivo [2]. De plus, chacun de ces gènes possède un profil d’expression unique bien que, dans une même classe, les profils se chevauchent largement. En conséquence, lorsqu’un gène Pax est inactivé, le phénotype majeur s’exprimera dans les régions où aucun autre membre de son sous-groupe n’est co-exprimé. C’est le cas par exemple de souris mutantes pour Pax8, chez lesquelles on observe des anomalies sévères de la thyroïde, alors que la formation des reins n’est pas affectée, malgré l’expression de Pax8 dans ces deux tissus ((→) m/s 1998, n° 8-9, p. 984) [3].
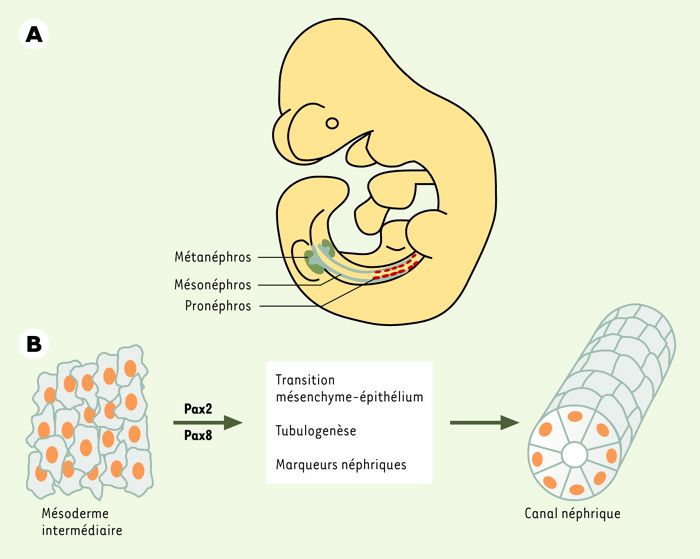
C’est en tenant compte de cette redondance fonctionnelle entre protéines Pax d’une même classe que nous avons récemment mis en évidence une fonction importante pour Pax8 dans le processus de formation du rein [4]. Trois ébauches successives de reins se succèdent durant le développement embryonnaire: le pronéphros, le mésonéphros et finalement le métanéphros ou rein adulte. Les deux premières, malgré leur existence transitoire, n’en sont pas moins essentielles au développement normal du rein adulte puisque chacune de ces structures émerge de la précédente. C’est donc l’induction du pronéphros, le premier des reins embryonnaires, qui signe le début du développement rénal. On sait depuis quelques années que le gène Pax2 est nécessaire à la formation du metanéphros (rein adulte) [5]. Chez les embryons Pax2-/-, dépourvus de métanéphros, il y a formation du pronéphros et du mésonéphros (Figure 1A). Étant donné la redondance fonctionnelle des gènes Pax, il apparaît probable que Pax8, l’autre membre de la famille Pax2/5/8 exprimé dans le rein, puisse compenser l’absence de Pax2 à ces stades les plus précoces du développement rénal. Nous avons en effet pu montrer que: (1) Pax8 est le marqueur le plus précoce de l’ébauche rénale; (2) qu’il est co-exprimé avec Pax2, et ce avant même la formation du pronéphros; et (3) que l’expression des deux gènes est contrôlée de façon indépendante dans cette région [4]. Dans ces circonstances, on peut s’attendre à ce que l’inactivation simultanée de Pax2 et de Pax8 entraîne un phénotype rénal précoce et sévère. Cette prédiction s’est révélée exacte au point même d’abolir l’établissement de la lignée néphrique chez les embryons ayant une inactivation des gènes Pax2 et Pax8. En effet, ces embryons sont incapables d’induire la transition mésoderme-épithélium nécessaire à la formation du canal néphrique, la structure de base du pronéphros et les marqueurs moléculaires précoces de la lignée néphrogénique sont absents ((→) m/s 2002, n° 2, p. 139) [4]. C’est dire que Pax2 et Pax8 sont absolument nécessaires à l’acquisition, par des cellules du feuillet mésodermique, d’une identité néphrogénique (Figure 1B).
Figure 1
Développement embryonnaire du rein.
A. Chez les vertébrés, le développement du système néphrogénique se fait en trois phases: le pronéphros, le mésonéphros et le métanéphros. Ce dernier est conservé chez l’adulte alors que les deux formes transitoires se métamorphosent en composantes du système génital. Chaque stade se forme à partir du précédent, de sorte que le développement rénal débute par l’induction du pronéphros. Le canal néphrique est représenté en bleu. B. Les facteurs de transcription Pax2 et Pax8 sont nécessaires et suffisants pour induire un destin néphrique dans les cellules du mésoderme intermédiaire qui formeront le pronéphros.
Si Pax2 et Pax8 sont effectivement les déterminants de la lignée néphrique, on peut penser que leur expression à l’extérieur de l’ébauche rénale soit capable d’y induire cette identité cellulaire. De fait, l’infection d’embryons de poulet avec un virus exprimant le gène Pax2 entraîne l’apparition de canaux néphriques (de type pronéphros) dans la région qui devrait normalement former les gonades [4]. Nous apportons bien la preuve expérimentale qu’ensemble Pax2 et Pax8 remplissent les critères nécessaires et suffisants pour justifier leur qualificatif de « clé moléculaire »: nécessaires à la spécification de la lignée néphrogénique et suffisants pour l’induire hors de sa localisation anatomique normale.
Une tendance généralisée?
L’action de Pax2 et Pax8 dans la lignée néphrogénique n’est pas le seul exemple de spécification cellulaire par les gènes Pax. Le rôle de Pax5 dans la détermination des progéniteurs hématopoïétiques lymphoïdes vers la lignée lymphocytaire B est ainsi très bien caractérisé. Ici aussi, l’absence du gène Pax5 bloque complètement la différenciation de cette lignée cellulaire [6], alors que son expression constitutive dans les cellules souches du système hématopoïétique est suffisante pour engager les progéniteurs lymphoïdes vers un destin de lymphocytes B, aux dépens d’autres lignées cellulaires [7]. De même, on sait que Pax7 est nécessaire à la spécification des cellules satellites des muscles [8], Pax8 à la spécification des cellules folliculaires de la thyroïde [3], Pax4 à la formation des cellules β du pancréas (productrices d’insuline) [9], alors que Pax6 est nécessaire aux cellules α du même organe (productrices de glucagon) [10] ((→) m/s 1997, n° 8-9, p. 1064). Bien qu’il n’y ait pas encore de preuve expérimentale directe que l’expression de ces protéines Pax4, 6, 7 soit suffisante pour la spécification tissulaire, tout porte à croire que leur mode d’action est similaire à celui de Pax2/8 dans le rein ou de Pax5 dans le système immunitaire.
Déterminer le mécanisme de spécification de nouvelles identités cellulaires est essentiel à la compréhension du développement embryonnaire. Il est fascinant de constater que, dans le cas de Pax, plusieurs des membres d’une même famille de gènes partagent cette fonction d’induction de spécification cellulaire, mais que les réponses sont extrêmement diverses selon le contexte. On peut penser que certains mécanismes d’action des Pax sont restreints à telle où telle lignée, alors que d’autres sont plus généraux. À titre d’exemple, une des conclusions des études de la fonction de Pax5 dans le système immunitaire est que la spécification cellulaire se fait en grande partie par répression des destins cellulaires alternatifs, notamment myéloïde et lymphocytaire T [7, 11]. S’agit-il là d’un mécanisme qui s’étend à l’ensemble des cas de spécification cellulaire par les gènes Pax? Il est trop tôt pour le dire. Par ailleurs, nous devrons identifier les signaux d’activation des gènes Pax ainsi que leurs partenaires moléculaires vraisemblablement responsables de la diversité de la réponse cellulaire aux signaux Pax. Finalement, et c’est là le défi le plus important, la compréhension des mécanismes d’action des gènes Pax devra nécessairement passer par l’identification de leurs cibles transcriptionelles.
Ce sont là des questions cruciales qui vont nécessiter un effort considérable. Heureusement, certains développements récents tels que le séquençage systématiques de génomes modèles (humain, souris, mouche, etc.) et la possibilité de criblages de gènes à grande échelle, nous permettent aujourd’hui d’aborder plus facilement ces questions. En quelque sorte, maintenant que nous détenons la clé de certaines destinées cellulaires, il nous reste à étudier et comprendre comment fonctionne leur serrure moléculaire.
Parties annexes
Références
- 1. Czerny T, Schaffner G, Busslinger M. DNA sequence recognition by Pax proteins: bipartite structure of the paired domain and its binding site. Genes Dev 1993; 7: 2048-61.
- 2. Bouchard M, Pfeffer P, Busslinger M. Functional equivalence of the transcription factors Pax2 and Pax5 in mouse development. Development 2000; 127: 3703-13.
- 3. Mansouri A, Chowdhury K, Gruss P. Follicular cells of the thyroid gland require Pax8 gene function. Nat Genet 1998; 19: 87-90.
- 4. Bouchard M, Souabni A, Mandler M, Neubuser A, Busslinger M. Nephric lineage specification by Pax2 and Pax8. Genes Dev 2002; 16: 2958-70.
- 5. Torres M, Gomez-Pardo E, Dressler GR, Gruss P. Pax-2 controls multiple steps of urogenital development. Development 1995; 121: 4057-65.
- 6. Urbanek P, Wang ZQ, Fetka I, Wagner EF, Busslinger M. Complete block of early B cell differentiation and altered patterning of the posterior midbrain in mice lacking Pax5/BSAP. Cell 1994; 79: 901-12.
- 7. Souabni A, Cobaleda C, Schebesta M, Busslinger M. Pax5 promotes B lymphopoiesis and blocks T cells development by repressing notch 1. Immunity 2002; 17: 781-93.
- 8. Seale P, Sabourin LA, Girgis-Gabardo A, Mansouri A, Gruss P, Rudnicki MA. Pax7 is required for the specification of myogenic satellite cells. Cell 2000; 102: 777-86.
- 9. Sosa-Pineda B, Chowdhury K, Torres M, Oliver G, Gruss P. The Pax4 gene is essential for differentiation of insulin-producing β-cells in the mammalian pancreas. Nature 1997; 386: 399-402.
- 10. St-Onge L, Sosa-Pineda B, Chowdhury K, Mansouri A, Gruss P. Pax6 is required for differentiation of glucagon-producing α-cells in mouse pancreas. Nature 1997; 387: 406-9.
- 11. Nutt SL, Heavey B, Rolink AG, Busslinger M. Commitment to the B-lymphoid lineage depends on the transcription factor Pax5. Nature 1999; 401: 556-62.
Liste des figures
Figure 1
Développement embryonnaire du rein.
A. Chez les vertébrés, le développement du système néphrogénique se fait en trois phases: le pronéphros, le mésonéphros et le métanéphros. Ce dernier est conservé chez l’adulte alors que les deux formes transitoires se métamorphosent en composantes du système génital. Chaque stade se forme à partir du précédent, de sorte que le développement rénal débute par l’induction du pronéphros. Le canal néphrique est représenté en bleu. B. Les facteurs de transcription Pax2 et Pax8 sont nécessaires et suffisants pour induire un destin néphrique dans les cellules du mésoderme intermédiaire qui formeront le pronéphros.