Corps de l’article
Toxoplasma gondii est un parasite ubiquitaire, à développement intracellulaire obligatoire. L’infection se fait par ingestion de kystes contenus dans les viandes parasitées ou d’oocystes présents sur des légumes souillés par les fèces de chat. La toxoplasmose touche la plupart des homéothermes. Habituellement asymptomatique, cette parasitose persiste sous une forme chronique, suite à l’enkystement de bradyzoïtes « dormants », dans les tissus de l’hôte, en particulier le cerveau [1]. Elle menace la santé dans deux situations : (1) au cours de la grossesse, l’infection congénitale peut entraîner chez le foetus des lésions oculaires et cérébrales, sévères et irréversibles ; (2) chez des sujets immunodéprimés, la réactivation d’une infection latente peut être responsable d’une encéphalite mortelle [2].
Les mécanismes de prédisposition à la toxoplasmose restent mal connus. Les modèles animaux sont utilisés pour les étudier. Le rat est un modèle représentatif de la pathologie humaine. À l’inverse de la souris, il ne développe pas de maladie aiguë mais une infection chronique caractérisée par la présence d’anticorps anti-toxoplasme et la formation de kystes intracérébraux [3]. Le rat Lewis (LEW) se différencie des autres souches de rat par une résistance totale à l’infection. L’absence d’anticorps anti-toxoplasme et de parasite, suite à l’infection, indique que la dissémination parasitaire est totalement prévenue [4]. Cette résistance présente un caractère dominant puisqu’elle s’observe chez les rats hybrides de première génération, issus du croisement entre la souche LEW et des souches sensibles.
À l’aide de chimères hématopoïétiques, nous avons montré que cette résistance s’exerce via des cellules du système immunitaire [4]. Une étude de liaison sur des rats hybrides de deuxième génération issus du croisement entre la souche résistante LEW et une souche sensible Brown Norway (BN), a identifié sur le chromosome 10 une région contrôlant la résistance à l’infection toxoplasmique [5]. Ce locus a été baptisé Toxo1. Des lignées réciproques LEW et BN congéniques pour différentes régions de Toxo1 ont été créées. Les études réalisées à l’aide de ces lignées ont confirmé les résultats de l’étude de liaison et permis de localiser Toxo1 dans un intervalle réduit. Surtout, elles ont montré que la résistance ou la sensibilité à la toxoplasmose dépend exclusivement de l’origine génomique de Toxo1, quel que soit par ailleurs le reste du génome [5]. L’issue de l’infection toxoplasmique apparaît donc contrôlée par Toxo1 selon un mode mendélien.
Il est habituellement admis que la sensibilité ou la résistance aux agents infectieux résulte d’interactions entre différents gènes et l’environnement. Le contrôle de l’infection est donc par essence multigénique. Cependant, dans certains cas, l’issue d’une infection peut être sous le contrôle d’un seul gène. Des mutations naturelles de la lignée germinale affectant le système immunitaire selon un mode de transmission mendélien, et associées à une sensibilité ou à une résistance particulière à un agent infectieux, ont pu être ainsi identifiées chez l’homme et la souris [6]. Par exemple, la résistance à l’infection par Plasmodium vivax est observée dans des cas de mutations du gène DARC (Duffy antigen receptor for chemokines) chez l’homme, et la résistance aux infections par des pathogènes intracellulaires est associée chez la souris à des mutations du gène Nramp1 (natural resistance-associated macrophage protein 1, ou Slc11a1, solute carrier family 11 number 1). Cette approche de génétique directe a permis de mieux comprendre les mécanismes immunitaires de défense contre les agents infectieux et de découvrir la spécificité vis-à-vis d’agents pathogènes de certains de ces mécanismes. L’identification du (des) gène(s) de Toxo1, contrôlant l’issue de l’infection toxoplasmique fournit l’occasion de découvrir une voie physiopathologique méconnue de la toxoplasmose.
Le mécanisme de résistance du rat LEW à l’infection est très efficace. Le toxoplasme a totalement disparu de l’organisme dès les premiers jours de l’infection, et la réponse anticorps vis-à-vis du parasite est quasi inexistante. Sachant que la résistance s’exerce via les cellules hématopoïétiques et que le macrophage joue un rôle majeur dans la défense contre Toxoplasma gondii, nous avons analysé le sort du parasite en présence des macrophages péritonéaux in vitro et ex vivo. Les résultats obtenus indiquent que le contrôle de l’infection par Toxo1 s’exerce après la phase d’invasion à travers la réponse du macrophage qui contrôle la prolifération intracellulaire du parasite et sa dissémination (Figure 1) [5]. Ce contrôle ne s’exerce pas dans les fibroblastes. L’implication d’autres cellules de l’immunité innée, telle la cellule dendritique, reste à étudier.
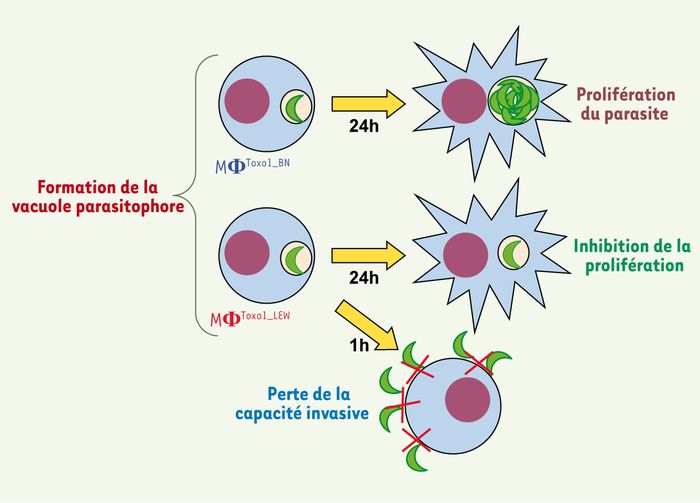
Figure 1
Modèle du mode d’action de Toxo1 sur le contrôle par les macrophages de la prolifération et de la dissémination parasitaire.
Nous avons montré qu’à la suite d’un contact initial parasite/macrophage, T. gondii est capable d’envahir et de former une vacuole parasitophore dans les macrophages que l’origine génomique de Toxo1 soit celle de la souche résistante LEW (MΦToxo1_LEW) ou celle de la souche sensible BN (MΦToxo1_BN). En revanche, le parasite s’avère incapable de proliférer dans les macrophages MΦToxo1_LEW au sein de la vacuole parasitophore dans laquelle il reste au moins 24 heures sans être tué. À l’opposé, le parasite prolifère normalement dans la vacuole parasitophore des MΦToxo1_BN. De plus, après une heure de contact avec les MΦToxo1_LEW, nous avons observé que les parasites extracellulaires perdent leur capacité à envahir des cellules naïves [5].
Toxo1 s’étend sur une région d’environ 7,6 mégabases en q24 sur le chromosome 10, synthénique de 17p13 chez l’homme. Elle contient plusieurs dizaines de gènes identifiés chez le rat ou suspectés par génomique comparative. L’identification du gène, ou groupe de gènes, impliqué dans l’issue de l’infection suit une double stratégie. Les études fonctionnelles visent à analyser, aux niveaux biochimique et moléculaire, les mécanismes du contrôle de la prolifération du parasite et de sa dissémination, par les macrophages. Les résultats de ces études permettront de sélectionner dans Toxo1 des gènes candidats. Le travail de dissection génétique est par ailleurs poursuivi. Nous sélectionnons des rats, issus de croisement en retour à partir des lignées congéniques déjà créées, caractérisés d’un point de vue génomique par des recombinaisons dans Toxo1. L’étude de l’issue de l’infection chez ces rats permettra de localiser le(s) gène(s) de contrôle dans un intervalle plus réduit en vue de son (leur) identification.
En conclusion, l’approche de génétique directe permise par le modèle devrait révéler une voie physiopathologique majeure de la toxoplasmose. Le caractère pathogène des parasites du phylum Apicomplexa auquel appartient Toxoplasma gondii et Plasmodium falciparum, l’agent responsable du paludisme, est lié aux dégâts tissulaires induits par la prolifération du parasite. L’encéphalite toxoplasmique est caractérisée par la destruction des tissus nerveux, et l’anémie au cours du paludisme, est liée à la destruction des globules rouges. L’identification du (des) gène(s) et mécanismes de Toxo1, permettra de mieux comprendre la toxoplasmose et éventuellement d’autres maladies causées par des parasites du phylum Apicomplexa, avec de possibles retombées dans les domaines de la prévention et du traitement.
Parties annexes
Références
- 1. Black MW, Boothroyd JC. Lytic cycle of Toxoplasma gondii. Microbiol Mol Biol Rev 2000 ; 64 : 607-23.
- 2. Carruthers VB. Host cell invasion by the opportunistic pathogen Toxoplasma gondii. Acta Trop2002 ; 81 : 111-22.
- 3. Dubey JP, Frenkel JK. Toxoplasmosis of rats : a review, with considerations of their value as an animal model and their possible role in epidemiology. Vet Parasitol 1998 ; 77 : 1-32.
- 4. Sergent V, Cautain B, Khalife J, et al. Innate refractoriness of the lewis rat to toxoplasmosis is a dominant trait that is intrinsic to bone marrow-derived cells. Infect Immun 2005 ; 73 : 6990-7.
- 5. Cavailles P, Sergent V, Bisanz C, et al. The rat Toxo1 locus directs toxoplasmosis outcome and controls parasite proliferation and spreading by macrophage-dependent mechanisms. Proc Natl Acad Sci USA 2006 ; 103 : 744-9.
- 6. Casanova JL, Schurr E, Abel L, Skamene E. Forward genetics of infectious diseases : immunological impact. Trends Immunol 2002 ; 23 : 469-72.
Liste des figures
Figure 1
Modèle du mode d’action de Toxo1 sur le contrôle par les macrophages de la prolifération et de la dissémination parasitaire.
Nous avons montré qu’à la suite d’un contact initial parasite/macrophage, T. gondii est capable d’envahir et de former une vacuole parasitophore dans les macrophages que l’origine génomique de Toxo1 soit celle de la souche résistante LEW (MΦToxo1_LEW) ou celle de la souche sensible BN (MΦToxo1_BN). En revanche, le parasite s’avère incapable de proliférer dans les macrophages MΦToxo1_LEW au sein de la vacuole parasitophore dans laquelle il reste au moins 24 heures sans être tué. À l’opposé, le parasite prolifère normalement dans la vacuole parasitophore des MΦToxo1_BN. De plus, après une heure de contact avec les MΦToxo1_LEW, nous avons observé que les parasites extracellulaires perdent leur capacité à envahir des cellules naïves [5].