Résumés
Résumé
L’adsorption sur carbones activés est un procédé courant pour éliminer les micropolluants de l’eau. Le but de cette étude est de mieux comprendre les propriétés d’adsorption de neuf micropolluants : l’ibuprofène (IBP), la carbamazépine (CBZ), l’ofloxacine (OFX), le bisphénol A (BPA), le diclofénac (DFN), le mecoprop (MCP), le pentachlorophénol (PCP), le benzotriazole (BZT) et la caféine (CAF) sur deux carbones activés microporeux : un feutre et un tissu. Les adsorbants ont été caractérisés et les isothermes et cinétiques d’adsorption de chaque molécule ont été étudiées à 25 °C et comparées. La capacité d’adsorption a été comparée au nombre de doubles liaisons des molécules dans le but de déterminer l’importance du π-stacking dans le phénomène de l’adsorption.
Mots-clés:
- Adsorption,
- carbones activés,
- tissu,
- micropolluants,
- isothermes,
- cinétiques
Abstract
Adsorption on activated carbons is frequently used in order to remove micropollutants from polluted water. The objective of this study is to better understand the adsorption properties of nine micropollutants: ibuprofen (IBP), carbamazepine (CBZ), ofloxacin (OFX), bisphenol A, (BPA), diclofenac (DFN), mecoprop (MCP), pentachlorophenol (PCP), benzotriazol (BZT) and caffeine (CAF) onto two microporous activated carbons: a felt and a fabric. Thus, the adsorbents were characterized, and the adsorption isotherms and adsorption kinetics of each molecule were studied at 25 °C and compared. Adsorption capacities were compared to the number of double bonds of molecules in order to examine the importance of π-stacking in the adsorption phenomenon.
Key Words:
- Adsorption,
- activated carbon,
- fabric,
- micropollutants,
- isotherms,
- kinetics
Corps de l’article
1. Introduction
Le nombre de contaminants organiques détectés et identifiés dans les eaux de surface et les nappes phréatiques est en constante augmentation. Parmi ces composés, de nombreuses études ont montré la présence de molécules médicamenteuses, de pesticides et des traces de solvants organiques dans l’eau, à concentration inférieure au µg∙L‑1 (LUO et al., 2014; MIÈGE et al., 2009). Ces composés ne sont pas traités par les stations d’épuration classiques.
L’objectif de ce travail est d’étudier les propriétés d’adsorption de micropolluants en solution aqueuse sur des carbones activés microporeux sous forme de tissu et de feutre. Pour ce faire, nous avons sélectionné neuf molécules organiques et deux carbones activés. Nous avons caractérisé ces carbones puis avons déterminé les cinétiques d’adsorption aux concentrations initiales de 10‑4 et environ 10‑3 mol∙L‑1 (100 ppm) ainsi que des isothermes d’adsorption à 25 °C dans un tampon phosphate. Les résultats d’adsorption ont alors été corrélés aux propriétés physico-chimiques des micropolluants et des carbones pour tenter de mieux comprendre les mécanismes d’adsorption.
2. Matériels et méthodes
2.1 Caractéristiques des adsorbants et adsorbats
Deux adsorbants ultramicroporeux : le tissu KIP1200 (nommé KIP) et le feutre CSV4 (nommé CSV) fournis par Dacarb, France, ont été caractérisés par adsorption-désorption d'azote à 77 K et par adsorption de CO2 à 273 K, par des titrages acido-basiques (méthode de Boehm [BOEHM, 2002]) et des mesures du pHPZC (pH du point isoélectrique). Les clichés MEB indiquent des fibres d’environ 10 µm de diamètre dans les deux supports.
Neuf molécules ont été utilisées comme adsorbat (Figure 1) dont des médicaments : la carbamazépine (CBZ), le diclofénac (DFN), l’ibuprofène (IBP) et l’ofloxacine (OFX), un produit anticorrosion : le benzotriazole (BZT), un perturbateur endocrinien : le bisphénol A (BPA), deux herbicides : le mecoprop (MCP) et le pentachlorophénol (PCP), et une molécule utilisée comme indicateur de pollution anthropogénique des eaux usées : la caféine (CAF). Les volumes ont été calculés avec le logiciel Chemsketch à partir des dimensions du plus petit parallélépipède dans lequel chaque molécule est incluse (Tableau 1).
Figure 1
Formules des adsorbats (à pH 7,4)
Adsorbate formula (at pH 7.4)
Tableau 1
Caractéristiques des molécules
Molecular characteristics
2.2 Conditions expérimentales
Toutes les solutions ont été préparées dans un tampon phosphate Na2HPO4/KH2PO4 ~0,04 mol∙L‑1 à pH 7,4. Des disques de tissu et de feutre ont été découpés (12 mg pour les études des isothermes, 20 mg pour les cinétiques d’adsorption à 10‑4 mol∙L‑1 et 17 mg pour les cinétiques à 10‑3 mol∙L‑1) puis agités à 250 tr∙min‑1 dans un agitateur orbital (Innova 40, New Brunswick) en présence de solutions de concentration connue pour étudier les isothermes et les cinétiques d’adsorption à 10‑4 mol∙L‑1.
Avant l’étude des cinétiques à 25 °C, les disques de tissu de carbone ont été introduits dans 25 mL de tampon phosphate pendant 12 h dans le but d’éliminer toutes les bulles de gaz. Les cinétiques aux fortes concentrations (100 ppm, c.-à-d. environ 10‑3 mol∙L‑1), ont été analysées in situ par un spectromètre UV (JASCO-970) piloté par ordinateur et alimenté en circulation fermée par une pompe HPLC en une solution de micropolluant (100 mL) au contact d’un tissu de carbone activé.
Pour les cinétiques à 10‑4 mol∙L‑1, les disques ont été introduits dans des flacons de 500 mL d’une solution pendant 10 à 20 jours. Des prélèvements réguliers de 300 µL ont été analysés par chromatographie liquide haute pression (pompes Waters 515 HPLC, injecteur automatique Waters 2707, colonne Sunfire C18, détecteur à barrette d’iode Waters 996, logiciel Empower, mode isocratique). La phase mobile a été préparée à partir d’eau UHQ, de méthanol, d’acide phosphorique et/ou d’acétonitrile (proportions variant de 10/90 à 90/10 [V/V] eau/méthanol + 0,1 % H3PO4 selon le polluant étudié).
Pour l’étude des isothermes d’adsorption à 25 °C, des flacons contenant un disque de carbone activé et 50 mL de solution de concentration fixée (de 2 à 120 mg∙L‑1) ont été agités jusqu’à ce que l’équilibre soit atteint. Après filtration (sur des membranes de 0,45 µm), les solutions ont été dosées par HPLC.
Les tracés des isothermes d’adsorption ont été réalisés à l’équilibre thermodynamique, c'est-à-dire lorsque les solutions résiduelles ont été filtrées et analysées après une durée supérieure au temps d’équilibre déterminé grâce aux cinétiques. Pour toutes les molécules, et à forte concentration (100 ppm), 7 jours ont été suffisants, sauf pour l’OFX (21 jours), le DFN (14 jours) et le PCP (10 jours). Les cinétiques aux faibles concentrations (2 ppm) ont été réalisées, mais ne sont pas présentées dans cet article.
3. Résultats et discussion
3.1 Propriétés physico-chimiques des adsorbants
3.1.1 Chimie de surface
Les deux carbones possèdent peu de fonctions de surface (Tableau 2). Les fonctions carbonyles sont majoritaires pour le tissu KIP et le feutre CSV. Les deux adsorbants sont globalement chargés positivement au pH de travail (7,4).
Tableau 2
Chimie de surface des carbones activés
Surface chemistry of the activated carbons
3.1.2 Caractérisation texturale
Les résultats de l’adsorption de N2 montrent que le tissu KIP et le feutre CSV sont des matériaux microporeux et majoritairement ultramicroporeux (Tableau 3). Le tissu KIP a une surface spécifique BET plus grande (1 560 m2∙g‑1) que celle du feutre (1 230 m2∙g‑1). La distribution de taille de pores simulée par DFT montre que le feutre possède une distribution plus large des supermicropores (diamètre des pores compris entre 0,7 nm et 2 nm) que le tissu KIP, ce qui pourrait permettre une meilleure diffusion des grosses molécules au sein du feutre.
Tableau 3
Caractéristiques texturales des carbones activés
Textural characteristics of the activated carbons
3.2 Cinétiques d’adsorption
Les cinétiques d’adsorption ont été étudiées à 25 °C pour deux concentrations : 10‑4 mol∙L‑1 (Figure 2) et 100 ppm (environ 10‑3 mol∙L‑1; Figure 3). Les cinétiques d’adsorption ont été suivies en traçant l’évolution en fonction du temps du ratio C/C0 où C représente la concentration à un temps t et C0 la concentration initiale (100 ppm). Les résultats reportés sur la figure 3 montrent que l’équilibre est rapidement atteint pour les molécules les plus petites. Pour l’adsorption sur le tissu KIP, la durée pour atteindre l’équilibre suit l’ordre suivant : BZT < CAF < IBP < BPA < MCP < CBZ < PCP < DFN < OFX. Il semble que la vitesse de diffusion dans le réseau des pores dépende du volume des molécules : plus la molécule est petite, plus la cinétique d’adsorption est rapide. Cependant, l’affinité de la molécule avec le carbone paraît être aussi un paramètre important. En effet, la cinétique d’adsorption du PCP sur le tissu KIP s’est avérée lente (plus de 7 jours) alors que son volume est de 0,18 nm3 (contre 0,04 nm3 pour le BZT et 0,85 nm3 pour l’OFX).
Figure 2
Cinétiques d’adsorption de neuf micropolluants sur le tissu KIP analysées continûment in situ (C0 = 100 mg∙L‑1; 17 mg dans 100 mL; pH = 7,4; T = 25 °C)
Adsorption kinetics of nine micropollutants onto KIP fabric analyzed continuously in situ (C0 = 100 mg∙L‑1; 17 mg in 100 mL; pH = 7.4; T = 25 C)
Figure 3
Cinétiques d’adsorption pour les neuf micropolluants sur tissu KIP (C0 = 10‑4 mol∙L‑1; V = 500 mL; m = 20 mg; pH = 7,4; 250 tr∙min‑1;T = 25 °C)
Adsorption kinetics of nine micropollutants onto KIP fabric (C0 = 10‑4 mol∙L‑1; V = 500 mL; m = 20 mg; pH = 7.4; 250 rpm; T = 25 °C)
Les figures 3 et 4 montrent le ratio C/C0, c'est-à-dire pour une concentration initiale de 10‑4 mol∙L‑1 en fonction du temps respectivement pour l’adsorption sur le KIP et le CSV. L’équilibre est atteint plus lentement que pour les cinétiques aux concentrations initiales de 10‑3 mol∙L‑1, mais la durée pour atteindre l’équilibre suit le même ordre pour l’ensemble des molécules d’adsorbat. En effet, pour les deux supports, certaines molécules (BZT, CAF et MCP) mettent 3 à 6 jours pour atteindre l’équilibre tandis que d’autres (CBZ, DFN, PCP et OFX) mettent une quinzaine de jours pour l’atteindre.
Figure 4
Cinétiques d’adsorption pour les neuf micropolluants sur feutre CSV (C0 = 10‑4 mol∙L‑1; V = 500 mL; m = 20 mg; pH = 7,4; 250 tr∙min‑1;T = 25 °C)
Adsorption kinetics of nine micropollutants onto CSV felt (C0 = 10‑4 mol∙L‑1; V = 500 mL; m = 20 mg; pH = 7.4; 250 rpm; T = 25 °C)
Les tracés de la quantité adsorbée à l’équilibre Qe (mg∙g‑1) en fonction du temps de contact (non montrés) ont été simulés suivant un algorithme itératif utilisant la méthode des moindres carrés, par une équation de cinétique de second ordre (1) :
Le tableau 4 présente la quantité maximale adsorbée à l’équilibre Qmax, la constante cinétique de pseudo-second ordre k2 et la vitesse initiale k2*Qe2 calculées par la simulation.
3.3 Isothermes d’adsorption
Les isothermes d’adsorption à 25 °C à l’exception de celle de l’OFX, ont été reproduites en utilisant un modèle de Langmuir-Freundlich (Équation 2) (HO et MCKAY, 1999) :
où Qe est la quantité adsorbée à l’équilibre (mmol∙g‑1), Ce la concentration à l’équilibre (mmol∙L‑1), Klf la constante de Langmuir-Freundlich (L∙mg‑1), Qm la capacité d’adsorption monocouche (mmol∙g‑1) et n l’exposant de Langmuir-Freundlich. Seule l’isotherme de l’OFX est mieux simulée par un modèle de Langmuir. Les isothermes sont présentées sur la figure 5 et les paramètres simulés dans le tableau 5.
Figure 5
Isothermes d'adsorption et leurs simulations pour le tissu KIP (a) et pour le feutre CSV (b) (C0 = 2 à 120 mg∙L‑1; 12 mg dans 50 mL; pH = 7,4; T = 25 °C)
Adsorption isotherms and their simulations for KIP fabric (a) and for CSV felt (b) (C0 = 2 à 120 mg∙L‑1; m = 12 mg; V = 50 mL; pH = 7.4; T = 25 °C)
(a)
(b)
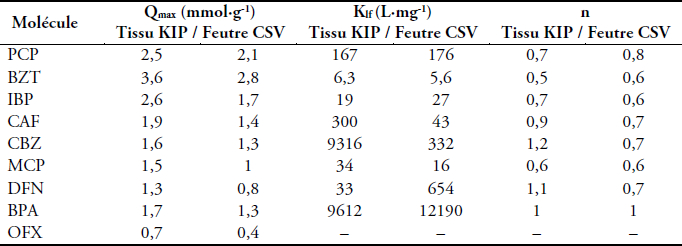
Tableau 5
Paramètres de Langmuir-Freundlich pour les différents micropolluants
Langmuir-Freundlich parameters for the different micropollutants
Le taux de recouvrement des micropolluants est plus élevé sur le tissu KIP que sur le feutre CSV. En effet, il y a plus de sites d’adsorption sur le tissu que sur le feutre dans la mesure où la surface spécifique du tissu KIP est plus grande que celle du feutre CSV (Tableau 3). Les capacités d’adsorption des plus petites molécules sont plus grandes (le PCP avec 4,1 mmol∙g‑1 sur le tissu KIP et 2,1 mmol∙g‑1 sur le feutre CSV; et le BZT avec 3,6 mmol∙g‑1 sur le tissu KIP et 2,1 mmol∙g‑1 sur le feutre CSV) et celles des plus grosses sont plus faibles (l’OFX avec 0,7 mmol∙g‑1 sur le tissu KIP et 0,4 mmol∙g‑1 sur le feutre CSV; et le DFN avec 1,3 mmol∙g‑1 sur le tissu KIP et 0,8 mmol∙g‑1 sur le feutre CSV). Ces valeurs montrent que les petites molécules ont un accès plus important à la porosité et qu’elles auraient la possibilité de s’adsorber dans des pores plus petits que les grosses. En effet, des auteurs (BRÁS et al., 2005) ont montré que la surface géométrique accessible était directement liée à la quantité maximale adsorbée pour le PCP, ce qui semble être le cas pour les autres molécules.
La constante de Langmuir-Freundlich Klf permet de déterminer l’affinité entre les molécules et le carbone. Plus Klf est grand (Tableau 5), plus l’isotherme d’adsorption est coudée (Figure 5) et plus l’affinité de la molécule avec le carbone est élevée. Ici le DFN et le BPA semblent montrer une bonne affinité avec le carbone, mais sont peu adsorbés. Le PCP, le MCP ainsi que le BZT ne semblent pas posséder une bonne affinité avec le carbone. Cela pourrait provenir du fait qu’ils ne possèdent qu’un seul cycle aromatique. Pour le PCP et le BZT, du fait de leur petite taille, ces adsorbats sont malgré tout adsorbés en grande quantité.
Une corrélation entre la valeur de Klf et le nombre de doubles liaisons au sein des adsorbats est observée (Figure 6) ce qui pourrait montrer l’importance des interactions π- π entre les molécules d’adsorbat et le carbone activé lors de l’adsorption. Toutefois, cette corrélation n’est pas observée pour DFN sur KIP et BPA sur CSV ce qui indique que les interactions π- π ne sont pas les seules à entrer en jeu lors de l’adsorption.
Figure 6
Constante de Langmuir-Freundlich en fonction du nombre de doubles liaisons pour le tissu KIP (a) et pour le feutre CSV (b)
Langmuir-Freundlich constant versus the number of double bonds for KIP fabric (a) and for CSV felt (b)
(a)
(b)
Conclusion
Les cinétiques d’adsorption de micropolluants organiques sur des carbones activés (tissu KIP et feutre CSV) principalement ultramicroporeux ont été étudiées à 100 ppm sur KIP et à 10‑4 mol∙L‑1 sur KIP et CSV. Pour ces supports, la vitesse d’adsorption dépend du volume des molécules. Les petites molécules sont adsorbées plus rapidement (quelques jours pour BZT, CAF et MCP) et les plus grosses molécules plus lentement (une quinzaine de jours pour CBZ, DFN, PCP et OFX). Les durées pour atteindre l’équilibre sont longues (quelques jours à plus de 15 jours), car la cinétique d’adsorption est contrôlée par la diffusion jusqu’aux pores les plus fins (ultramicropores). Toutefois, l’affinité entre molécules et carbone semble jouer un rôle dans les cinétiques d’adsorption. Cette affinité a pu être estimée à partir des simulations des isothermes d’adsorption par un modèle de Langmuir-Freundlich. Une corrélation entre Klf (constante de Langmuir-Freundlich) liée à l’affinité, et le nombre de doubles liaisons pourrait montrer l’importance des interactions π-π entre les molécules d’adsorbat et le carbone activé lors de l’adsorption. Certaines molécules possèdent une bonne affinité avec le carbone mais ne s’adsorbent pas en grande quantité (OFX, CBZ, DFN). Les capacités d’adsorption, dépendent du volume (ou surface) poreux accessible aux molécules. La comparaison des isothermes d’adsorption a révélé que le tissu KIP adsorbait en plus grande quantité que le feutre CSV, résultat interprétable par la plus grande surface spécifique du KIP.
Parties annexes
Remerciements
Les auteurs remercient l’Agence Nationale de la Recherche (ANR) pour le financement de ces travaux et de la bourse de thèse de Sylvain Masson dans le cadre de projet PARME (ANR-11-ECOT-005-03), ainsi que Émile Fournier et Yannick Issoukou pour leurs participations à certaines expériences.
Références bibliographiques
- BOEHM H.P. (2002). Surface oxides on carbon and their analysis: a critical assessment. Carbon, 40, 145–149.
- BRÁS I., L. LEMOS, A. ALVES et M.F.R. PEREIRA (2005). Sorption of pentachlorophenol on pine bark. Chemosphere, 60, 1095–1102.
- HO Y.S. et G. MCKAY (1999). Pseudo-second order model for sorption processes. Process Biochem., 34, 451–465. DOI: 10.1016/S0032-9592(98)00112-5
- LUO Y., W. GUO, H.H. NGO, L.D. NGHIEM, F.I. HAI, J. ZHANG, S. LIANG et X.C. WANG (2014). A review on the occurrence of micropollutants in the aquatic environment and their fate and removal during wastewater treatment. Sci. Total Environ., 473–474, 619–641.
- MIÈGE C., J.M. CHOUBERT, L. RIBEIRO, M. EUSÈBE et M. COQUERY (2009). Fate of pharmaceuticals and personal care products in wastewater treatment plants – Conception of a database and first results. Environ. Pollut., Special Issue Section: Ozone and Mediterranean Ecology: Plants, People, Problems, 157, 1721–1726. DOI: 10.1016/j.envpol.2008.11.045
Liste des figures
Figure 1
Formules des adsorbats (à pH 7,4)
Adsorbate formula (at pH 7.4)
Figure 2
Cinétiques d’adsorption de neuf micropolluants sur le tissu KIP analysées continûment in situ (C0 = 100 mg∙L‑1; 17 mg dans 100 mL; pH = 7,4; T = 25 °C)
Adsorption kinetics of nine micropollutants onto KIP fabric analyzed continuously in situ (C0 = 100 mg∙L‑1; 17 mg in 100 mL; pH = 7.4; T = 25 C)
Figure 3
Cinétiques d’adsorption pour les neuf micropolluants sur tissu KIP (C0 = 10‑4 mol∙L‑1; V = 500 mL; m = 20 mg; pH = 7,4; 250 tr∙min‑1;T = 25 °C)
Adsorption kinetics of nine micropollutants onto KIP fabric (C0 = 10‑4 mol∙L‑1; V = 500 mL; m = 20 mg; pH = 7.4; 250 rpm; T = 25 °C)
Figure 4
Cinétiques d’adsorption pour les neuf micropolluants sur feutre CSV (C0 = 10‑4 mol∙L‑1; V = 500 mL; m = 20 mg; pH = 7,4; 250 tr∙min‑1;T = 25 °C)
Adsorption kinetics of nine micropollutants onto CSV felt (C0 = 10‑4 mol∙L‑1; V = 500 mL; m = 20 mg; pH = 7.4; 250 rpm; T = 25 °C)
Figure 5
Isothermes d'adsorption et leurs simulations pour le tissu KIP (a) et pour le feutre CSV (b) (C0 = 2 à 120 mg∙L‑1; 12 mg dans 50 mL; pH = 7,4; T = 25 °C)
Adsorption isotherms and their simulations for KIP fabric (a) and for CSV felt (b) (C0 = 2 à 120 mg∙L‑1; m = 12 mg; V = 50 mL; pH = 7.4; T = 25 °C)
(a)
(b)
Liste des tableaux
Tableau 1
Caractéristiques des molécules
Molecular characteristics
Tableau 2
Chimie de surface des carbones activés
Surface chemistry of the activated carbons
Tableau 3
Caractéristiques texturales des carbones activés
Textural characteristics of the activated carbons
Tableau 5
Paramètres de Langmuir-Freundlich pour les différents micropolluants
Langmuir-Freundlich parameters for the different micropollutants