Résumés
Résumé
L’objectif de la présente étude est d’observer l’efficacité de la coagulation-floculation par le sulfate d’aluminium sur l’élimination des composés organiques à fonctions phénoliques (phénol et pyrogallol). L’intérêt s’est porté plus particulièrement sur l’incidence de sels minéraux constitutifs de la dureté « calcium et magnésium » et souvent présents dans la matrice minérale des eaux algériennes.
Des essais de Jar-Test ont été réalisés sur les deux composés phénoliques dissous dans l’eau distillée seule, puis enrichie en sels minéraux. Ces essais ont été réalisés sur des solutions synthétiques d’eau distillée enrichies par les ions de calcium et de magnésium introduits sous différentes formes (CaCl2•2H2O; CaSO4•2H2O; CaCO3; MgCl2•6H2O; MgSO4•7H2O) et, enfin, avec les eaux souterraines de la région. Différents paramètres réactionnels ont été variés (ex. : l’effet du pH et l’influence de la teneur en sels) et cette approche a permis une meilleure compréhension des mécanismes d’interactions composés phénoliques / sels calciques et magnésiens.
Les résultats obtenus indiquent que l’efficacité du procédé dépend du nombre et de la position des groupements phénoliques sur les molécules. Les principaux mécanismes seraient soit une adsorption physique, soit un échange de ligand ou une complexation à la surface des flocs d’hydroxydes d’aluminium. L’ajout de sels minéraux semble améliorer les rendements d’élimination de composés phénoliques testés et avoir un effet sur la gamme optimale de pH de coagulation. Une application de ce procédé à des eaux minéralisées (eaux de forage) de la région de Biskra, située au sud-est de l’Algérie, a abouti à une amélioration des rendements comparés à ceux dans de l'eau distillée.
Mots-clés :
- Composés phénoliques,
- sels minéraux,
- coagulation-floculation,
- sulfate d’aluminium,
- dureté,
- pH
Abstract
The objective of this study was to observe the effectiveness of coagulation-flocculation by aluminum sulfate on the removal of organic compounds with phenolic functional groups (phenol and pyrogallol). The work focused on the impact of the inorganic components of water hardness, calcium and magnesium, which are often present in the inorganic matrix of Algerian waters. Jar-test trials were conducted on the two phenolic compounds dissolved in distilled water only and then in water enriched with mineral salts. The tests were performed on synthetic solutions of distilled water enriched with calcium and magnesium ions, introduced in various forms (CaCl2•2H2O; CaSO4•2H2O; CaCO3; MgCl2•6H2O; MgSO4•7H2O). Several reaction parameters were varied, notably the pH and the salt content, and this approach yielded a better understanding of the mechanisms of interaction between phenolic compounds and calcium/magnesium salts.
The obtained results indicate that the process efficiency depends on the number and position of phenolic groups on the organic molecules. The main mechanisms could be a physical adsorption, a ligand-exchange reaction or surface complexation on the aluminum hydroxide floc. The addition of inorganic salts appears to improve removal efficiencies for the tested phenolic compounds and affects the optimal pH range for coagulation. The application of this method to mineralized waters (well water), collected in the region of Biskra located in the southeastern Algeria, resulted in improvement of yields, compared to those obtained in distilled water.
Keywords:
- Phenolic compounds,
- inorganic salts,
- coagulation-flocculation,
- aluminum sulfate,
- hardness,
- pH
Corps de l’article
1. Introduction
L’eau dans le monde a un impact fondamental sur l’économie, elle est au centre des intérêts stratégiques, elle est indispensable à l’être humain, et c’est aussi un élément de production de richesse (TABET HELAL et GHELLAI, 2007)
Les eaux susceptibles d'être utilisées comme eaux potables sont les eaux souterraines mais également, et de plus en plus, les eaux superficielles. Si les premières ne nécessitaient par le passé qu'un simple traitement de désinfection, il n'en est pas toujours ainsi actuellement; quant aux secondes, elles ne sont rendues potables que par des traitements longs et coûteux. En effet, les eaux de surface contiennent, à des concentrations très différentes, de nombreux composés organiques et minéraux dissous et en suspension (ACHOUR, 2001).
La matière organique des eaux de surface constitue un milieu très hétérogène, comprenant des molécules à structures très complexes de masse moléculaire élevée, mais aussi des composés organiques simples (phénol, acides aminés, sucres, etc.) (LEFEBVRE et CROUE, 1995). La présence de phénols dans l'environnement provient des eaux résiduaires et des flux d'air rejetés lors de la production, de la transformation ou de l'utilisation du phénol. Les échappements des moteurs thermiques, la dégradation photochimique du benzène, la décomposition de déchets organiques divers, le métabolisme humain et animal sont également responsables de la présence de phénols dans l'environnement (ENVIRONNEMENT CANADA, 2002).
Le phénol est rapidement absorbé lors de son introduction dans l’organisme. L’adsorption percutanée d’une solution de concentration égale à 25 mg•kg‑1 de C14-phénol est d’environ 19 % pour la peau humaine (BONNARD et al., 2011). Après absorption, le phénol se distribue rapidement dans tout l’organisme avec des concentrations supérieures à celles du sérum dans le foie, la rate, les reins et les surrénales (BONNARD et al., 2011).
Une absorption prolongée de faibles quantités de phénol à travers la peau ou par voie respiratoire peut provoquer, à terme, une intoxication systémique : les troubles fonctionnels consistent essentiellement en céphalées, nausées, dysphagie, hypersalivation, diarrhée, anorexie, hypertension, tremblements (BISSON et al., 2005) et aussi maux de tête, faiblesse musculaire, perte de conscience. Ces symptômes apparaissent très rapidement en 15 à 30 min (BONNARD et al., 2011). Ils sont potentiellement toxiques et ils ne sont pas biodégradables (RAJKUMAR et al., 2005). Ils présentent un réel problème pour les eaux polluées (EHTASH, 2011). Pour protéger la santé humaine et les écosystèmes de la haute toxicité de ces produits, un traitement efficace des eaux chargées en phénols doit être réalisé.
Dans les filières classiques de traitement d’eaux potables, la coagulation-floculation peut réduire d’une façon notable ces substances organiques malgré leur état dissous (CHRISTIAN et al., 2000). L’efficacité de ce procédé dépend de la composition des milieux aqueux, de la nature du coagulant introduit, ainsi que de la structure des composés organiques à éliminer, notamment les groupements fonctionnels, dont ils sont porteurs (GUESBAYA, 1998; LEFEBVRE, 1990; RAHNI, 1994; REZEG, 2004).
Par ailleurs, l’influence de sels minéraux sur l’efficacité de la floculation des composés organiques a été peu étudiée et a concerné seulement les substances humiques (AFOUFOU, 2002; GUESBAYA, 1998; LEFEBVRE, 1990; MAZET et WAIS MOSSA, 1991). Il s’agit alors de mettre en évidence et de préciser l’impact de sels communément présents dans les eaux à traiter et de déterminer si les effets observés sont bénéfiques ou inhibiteurs par rapport au processus d’élimination des composés phénoliques par le sulfate d’aluminium, ainsi que les mécanismes intervenant entre ces composés et le coagulant.
Les eaux du Sahara Septentrional en Algérie sont fortement minéralisées (plus de 1 000 µs•cm‑1) et se caractérisent par une dureté excessive avec des teneurs élevées en calcium et magnésium (plus de 100 °F) et de fortes teneurs en chlorures, sulfates et sodium (ACHOUR et GUERGAZI, 2002; DJELLOULI et al., 2010; YOUCEF et ACHOUR, 2001). Nous avons entrepris d’évaluer au cours de cette étude l’efficacité de la coagulation-floculation par le sulfate d’aluminium sur des molécules organiques simples de type aromatique hydroxylé (phénol et pyrogallol) dans l’eau distillée enrichie par des sels minéraux. Nous avons étudié l’influence du pH en présence des sels de calcium ou de magnésium sur l’efficacité de la floculation de ces composés. Une application de ce procédé sur des eaux minéralisées de la région de Biskra (eaux de forage) a également été réalisée.
2. Matériel et méthodes
2.1 Préparation des solutions de composés phénoliques
Les composés organiques testés sont représentés par le phénol et le pyrogallol et contiennent dans leur structure chimique des fonctions hydroxylées. Pour les besoins de notre étude, nous avons utilisé des produits commercialisés par Aldrich. Les principales caractéristiques de ces produits sont récapitulées au tableau 1.
Tableau 1
Caractéristiques des composés organiques étudiés.
Characteristics of organic compounds studied.
Les solutions synthétiques de composés organiques (20 mg•L‑1) sont préparées par dissolution dans différents milieux de dilution. Les eaux de dilution sont, d’une part, l’eau distillée enrichie par les ions de calcium et de magnésium (100 mg•L‑1) introduits sous différentes formes (CaCl2•2H2O; CaSO4•2H2O; CaCO3; MgCl2•6H2O; MgSO4•7H2O) et, d’autre part, des eaux de trois sources minéralisées de la région de Biskra dopées aux composées phénoliques (Tableau 2).
Une eau minérale commercialisée provenant de la région d’Ifri située en Kabyle (nord de l’Algérie;
Une eau provenant d’un forage situé dans la commune de Chetma situé à 7 km de la ville de Biskra;
Une eau provenant d’un forage situé au jardin London dans la ville de Biskra, cette eau est destinée à l’irrigation.
Tableau 2
Caractéristiques physico-chimiques des eaux de dilution des composés phénoliques.
Physico-chemical characteristics of the dilution water for the phenolic compounds.
2.2 Préparation du coagulant
Comme sel coagulant, le sulfate d’aluminium en poudre [Al2(SO4)3•18H2O] a été utilisé. Une solution mère de 10 g•L‑1 a été préparée périodiquement par dissolution de cette poudre dans de l’eau distillée.
2.3 Méthodes de dosage
Le dosage des composés simples, phénol et pyrogallol, a été réalisé sur un spectrophotomètre « Jenway 6405 UV/Vis » à la longueur d’onde λ = 270 nm.
Les paramètres physico-chimiques des eaux de dilution ont été déterminés par les méthodes standards d’analyse (RODIER et al., 2009) ou par les méthodes décrites par les catalogues de l’appareillage utilisé.
2.4 Description des essais de floculation
Les essais de jar-test ont été réalisés sur un floculateur à six agitateurs (Floculateur Fisher 1198). Ce floculateur permet de réaliser simultanément six essais dans des béchers en verre de 500 mL. Au cours de l’étude, les solutions enrichies en composés organiques et en coagulant ont été soumises pendant 3 min à une agitation rapide de 200 tr•min‑1. La vitesse a été par la suite réduite à 60 tr•min‑1 pour une durée d’une demi-heure. Après une décantation de 30 min, le surnageant a été récupéré pour être filtré sous vide sur membrane OSMONICS INC de porosité 0,45 µm. Le filtrat était ensuite dosé par analyse au spectrophotomètre.
Le pourcentage d’abattement de composés organiques a été évalué par le rendement qui s’exprime par :
Co et Cf représentent respectivement les concentrations initiales et finales en composés organiques exprimées en mg•L‑1.
3. Résultats et discussion
3.1 Influence de la dose de coagulant
Les essais de coagulation-floculation ont été conduits sur des solutions synthétiques contenant une concentration constante du phénol ou du pyrogallol (20 mg•L‑1) dans de l’eau distillée à pH non ajusté. Des doses croissantes de sulfate d’aluminium ont été introduites dans les différentes solutions. La figure 1 présente les résultats définitifs obtenus. Ils montrent que les rendements d’élimination des composés organiques évoluent différemment selon la structure chimique de ces composés. De plus, l’effet de la dose de coagulant introduite est variable d’un composé à l’autre.
Figure 1
Influence de la dose de coagulant sur l'élimination des composés phénoliques (Co = 20 mg•L‑1, pH non-ajusté).
Effect of coagulant dosage on the removal of phenolic compounds (Co = 20 mg•L‑1, unadjusted pH).
Le pourcentage d’abattement du phénol est faible. Ce composé présente un optimum d’élimination pour les faibles ou moyennes doses de coagulant, inférieures à 50 mg•L‑1. Par ailleurs, le pyrogallol est partiellement éliminé. À l’optimum, l’élimination du phénol atteint 13,54 %, alors que celle du pyrogallol atteint 42,62 %. Ces rendements sont observés respectivement pour une dose de 40 mg•L‑1 et de 5 mg•L‑1 en sulfate d’aluminium.
En se référant aux données bibliographiques (JULIEN et al., 1994), les molécules aromatiques n’ayant pas de groupements fonctionnels ou ayant un seul groupement fonctionnel non ionisé (ou très peu ionisé) ne sont pas (ou très peu) éliminées par coagulation-floculation. Dans le cadre de cette étude, il s’agit du phénol.
Des travaux antérieurs (ACHOUR, 2001; GUESBAYA, 1998) avaient pu également mettre en évidence que le phénol et le résorcinol étaient très peu éliminés quelle que soit la dose de coagulant.
LEFEBVRE (1990) indique que les composés aromatiques présentant au moins deux fonctions acides (identiques ou différentes) en position ortho sont éliminés. C’est le cas du pyrogallol dans nos conditions expérimentales. La présence de deux fois deux groupements acides (-COOH ou -OH) contigus sur ces composés semble leur conférer un comportement semblable aux substances humiques. REZEG et ACHOUR (2009) ont montré aussi que l’élimination des composés tels que le pyrogallol et l’acide pyroméllitique est fonction de la concentration initiale de ces composés et du pH du milieu.
3.2 Effet du pH en présence des sels minéraux
Cette phase de l’étude a pour but d’apprécier l’influence du pH sur l’élimination du phénol et du pyrogallol, en présence des sels de calcium ou de magnésium. La dose introduite de sulfate d’aluminium est de 40 mg•L‑1 pour le phénol et 5 mg•L‑1 pour le pyrogallol. Pour des valeurs de pH variant entre 2 et 11, nous avons abouti aux résultats résumés aux figures 2 et 3. Notons que l’ajustement du pH des solutions a été réalisé durant la phase rapide de l’agitation, et effectué grâce à des solutions de HCl et de NaOH (2 M).
Figure 2
Effet du pH sur l’élimination du phénol en présence des sels minéraux (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, dose du coagulant = 40 mg•L‑1).
Effect of pH on the removal of phenol in the presence of inorganic salts (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, the coagulant dose = 40 mg•L‑1).
Figure 3
Effet du pH sur l’élimination du pyrogallol en présence des sels minéraux (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, dose du coagulant = 5 mg•L‑1).
Effect of pH on the removal of pyrogallol in the presence of inorganic salts (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, the coagulant dose = 5 mg•L‑1).
Concernant les composés organiques testés, les ions calcium et magnésium entraînent une amélioration de rendement d’élimination des composés phénoliques testés.
Lors de l’ajout des sels de calcium ou magnésium, le pourcentage d’élimination des composés phénoliques testés croît au fur et à mesure que le nombre des fonctions hydroxyles augmente dans la structure de ces composés suivant l’ordre pyrogallol > phénol.
L’ajout des sels minéraux semble avoir un effet sur la gamme optimale du pH de coagulation-floculation des composés organiques simples. D’autre part, l’ajout des ions SO42-, Cl- et CO32- élargit la gamme du pH optimal vers des pH basiques favorisant la formation des espèces anioniques de l’aluminium. Ces anions tels que le SO42-, Cl- et CO32- peuvent être considérés comme des ligands concurrents des ions hydroxyles. Ils peuvent interférer sur la précipitation des hydroxydes d’aluminium en déplaçant les ions OH- (CLÉMENT et al., 1983; GUESBAYA, 1998).
Dans le cas du pyrogallol, il semblerait que les pKa de la première et la deuxième fonction jouent un rôle dans l’élimination de ces composés, surtout en présence des sels de magnésium.
Pour expliquer l’effet bénéfique du calcium, et par extension celui du magnésium, diverses hypothèses sont avancées. Les ions calcium sont ainsi susceptibles d’inverser la charge négative des espèces hydrolysées de l’aluminium même à des pH basiques lorsque la force ionique du milieu est maintenue constante. De plus, la formation de complexes Ca-composé organique peut aboutir directement à la formation d’une forme insoluble pouvant précipiter (ACHOUR, 2001; JECKEL, 1986). L’adsorption préalable d’ions Ca2+ sur les flocs d’hydroxyde d’aluminium peut également jouer un rôle de pontage entre les composés organiques dissociés et les flocs d’hydroxyde d’aluminium (ACHOUR, 2001; JECKEL, 1986).
Toutefois, les résultats correspondant à l’ajout des cations et des anions bivalents ou monovalents montrent bien que la présence de ces ions se traduit par une compétition entre les effets promoteur de Mg2+ et Ca2+ et inhibiteur des sulfates, chlorures et carbonates.
Les effets de Ca2+ et HCO3- / CO32- pourraient être antagonistes avec un effet promoteur du calcium et un effet inhibiteur du HCO3- / CO32-.
3.3 Influence de la teneur en sels minéraux
Cette phase de l’étude a eu pour but de tester l’effet de teneurs croissantes de Ca2+ ou de Mg2+ sur l’élimination du phénol et du pyrogallol dans l’eau distillée. Des essais de floculation ont été conduits sur des solutions synthétiques d’eau distillée, contenant une concentration fixe (20 mg•L‑1) de chaque composé testé. Nous avons ajouté des quantités croissantes de Ca2+ ou Mg2+ allant de 10 à 400 mg•L‑1 et les solutions ont été coagulées par les mêmes doses constantes de sulfate d’aluminium. Elle est de 40 mg•L‑1 pour le phénol et 5 mg•L‑1 pour le pyrogallol.
Le tableau 3 récapitule les valeurs des écarts (Ec %) des pourcentages d’élimination des composés phénoliques testés dans l’eau distillée par rapport aux pourcentages d’élimination en présence des teneurs croissantes du Ca2+ ou du Mg2+ à l’optimum d’élimination qui s’exprime par :
Tel que X0 et X1 représentent respectivement les pourcentages d’élimination de composé testé dans l’eau distillée seule et en présence de sels minéraux.
Tableau 3
Récapitulatif des écarts des pourcentages d’élimination des composés phénoliques en présence des sels minéraux.
Summary of efficiencies and deviations in percentages of removal of the phenolic compounds in the presence of inorganic salts.
Les résultats résumés dans ce tableau montrent que la présence des ions calcium et magnésium entraîne une amélioration des rendements d’élimination par rapport à ceux observés dans l’eau distillée. Cependant, dans le cas du phénol ajusté à pH = 9, la présence des sels de sulfate de calcium entraîne une dégradation des rendements d’élimination.
Dans les solutions dont les pH sont voisins de la neutralité, la formation en quantité notable d’hydroxyde d’aluminium peut avoir lieu. Ce dernier favorise alors un phénomène d’adsorption physique ou un échange de ligand avec les ions OH- à la surface de cet hydroxyde. Les formes hydrolysées cationiques sont négligeables du fait du pH élevé de ces solutions. De plus, les anions minéraux peuvent fortement entrer en compétition avec les hydroxydes vis-à-vis de la complexation de l’ion aluminium.
Par ailleurs, l’effet inhibiteur des sulfates et des bicarbonates pourrait être expliqué par l’adsorption de ces anions sur les hydroxydes métalliques en abaissant ainsi la charge de surface ou même, à la limite, la faire changer de signe. Dans nos conditions expérimentales, les anions suivants sont classés dans l’ordre croissant du pouvoir inhibiteur vis-à-vis de l’élimination des composés phénoliques : SO42- > Cl- > CO32-.
3.4 Floculation des composés organiques en eaux minéralisées
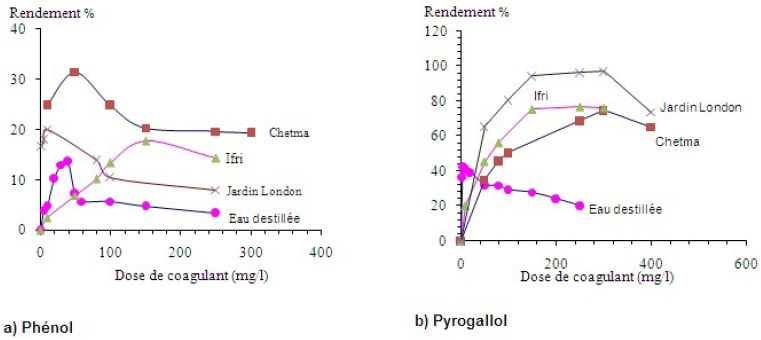
Pour une meilleure appréciation de l’influence de la minéralisation totale sur l’élimination des composés organiques, nous avons testé au cours des manipulations des eaux minéralisées qui sont citées précédemment. Les résultats de la figure 4 montrent que les rendements optimaux d’élimination de ces composés organiques varient d’une eau à une autre.
Figure 4
Évolution du pourcentage d’élimination des composés phénoliques (Co = 20 mg•L‑1) dans les eaux de minéralisation variable.
Evolution of the percentage of removal of phenolic compounds (Co = 20 mg•L‑1) in various mineralized waters.
Comparée aux résultats en eau distillée, la minéralisation des milieux de dilution semble modifier l’élimination des composés organiques par coagulation-floculation. Il y a lieu d’observer que l’effet de la minéralisation totale apparaît comme bénéfique au cours de l’élimination du phénol et du pyrogallol.
La présence de quantités appréciables de calcium et de magnésium constituant la dureté des eaux peut par ailleurs contribuer à l’amélioration de l’élimination des composés organiques testés. Le pH de l’eau conditionne les formes de l’aluminium et, de ce fait, le mécanisme de floculation prédominant. Dans les eaux minéralisées fortement tamponnées et dont les pH sont voisins de la neutralité, la formation en quantité notable d’hydroxyde d’aluminium peut avoir lieu. Il favoriserait alors un phénomène d’adsorption physique ou un échange de ligand avec les ions OH- à la surface de cet hydroxyde.
La comparaison des résultats de nos essais avec ceux obtenus par d’autres auteurs (ACHOUR et GUESBAYA, 2005; REZEG et ACHOUR, 2009) sur les composés organiques simples (phénol, résorcinol, pyrogallol, phloroglucinol, etc.) met en exergue certains aspects des mécanismes possibles de coagulation-floculation de la matière organique dans les eaux naturelles. Ainsi, la présence de sels minéraux et leurs proportions relatives entre éléments promoteurs et inhibiteurs influencent directement l’efficacité d’élimination de la matière organique et la dose de coagulant requise. La structure chimique des composés organiques, notamment de type aromatique, sera également déterminante dans l’optimisation de son élimination. La réactivité des composés phénoliques vis-à-vis du coagulant pourrait donc être dépendante non seulement de la structure chimique de ces composés, de l’importance des groupements fonctionnels dans cette structure, mais aussi de la composition minérale de l’eau et donc des interactions des sels minéraux avec les groupements fonctionnels de ces composés.
4. Conclusion
Cette étude expérimentale a été consacrée à l’élimination, par floculation au sulfate d’aluminium, du phénol et du pyrogallol dans l’eau distillée enrichie par les sels minéraux et dans des eaux minéralisées de la région de Biskra, située au sud-est de l’Algérie.
Les résultats obtenus montrent que le phénol a été très peu éliminé, quelle que soit la dose de coagulant. Par contre, le pyrogallol est beaucoup mieux éliminé. En effet, les composés aromatiques présentant deux ou trois fonctions hydroxyles en position ortho sont éliminés. Le mécanisme prédominant serait une réaction de ces composés à la surface des hydroxydes métalliques solides. Les espèces hydrolysées de l’aluminium peuvent en effet être constituées par des flocs comportant un mélange de Al(OH)3 amorphe et des formes cationiques Al(OH)2+ et Al(OH)2+. L’adsorption peut être ainsi de nature électrostatique mais également purement physique si les groupements acides ne sont pas dissociés. Un autre mécanisme de surface peut être représenté par une complexation ou un échange de ligand avec les groupements hydroxyles à la surface du floc (cas du pyrogallol). Un mécanisme de complexation avec les formes solubles cationiques ou anioniques de l’aluminium peut également se produire selon que le pH soit acide ou basique.
Pour étudier l’impact individuel de chaque ion, nous avons travaillé en solution synthétique d’eau distillée enrichie par les ions de Ca2+ et de Mg2+ introduits sous différentes formes. Nous nous sommes intéressés à déterminer l’effet des paramètres pH et teneurs en sels minéraux. Les résultats et discussions apportés au cours de cette étape font ressortir les conclusions suivantes :
L’ajout de sels minéraux a montré une influence notable sur l’élimination des composés phénoliques. La nature des ions inorganiques présents en solutions synthétiques est ainsi un facteur important pour la réactivité de l’aluminium vis-à-vis des molécules organiques;
La présence des cations Ca2+ et Mg2+ serait bénéfique alors que la présence des anions SO42-, Cl-, CO32- serait néfaste. Cependant, leur effet inhibiteur dépend de la nature du cation associé comme il a été observé en testant le sulfate de magnésium ou le sulfate de calcium. Dans nos conditions expérimentales, l’ion magnésium joue un rôle prépondérant par rapport aux ions calcium;
Quel que soit le pH de traitement, les ions Ca2+ et Mg2+ entraînent une amélioration de rendement d’élimination des composés phénoliques testés par rapport à ceux mesurés dans l’eau distillée seule. Cependant, les pH optimaux d’élimination de ces composés en présence des sels de calcium ou des sels de magnésium sont voisins de la neutralité ou basiques;
Des anions tels que les sulfates, les chlorures ou les carbonates, peuvent entrer en compétition avec les OH- des composés phénoliques et complexer l’aluminium.
En eaux minéralisées, le rendement d’élimination des composés phénoliques testés est étroitement lié aux paramètres de minéralisation et, plus particulièrement, à la proportion de la dureté par rapport à la minéralisation totale.
La réactivité des composés phénoliques vis-à-vis du coagulant pourrait donc être dépendante, non seulement de la structure chimique de ces composés, de l’importance des groupements fonctionnels dans cette structure, mais aussi de la composition minérale de l’eau et donc des interactions des sels minéraux avec les groupements fonctionnels de ces composés.
Parties annexes
Bibliographie
- ACHOUR S. (2001). Incidence des procédés de chloration, de floculation et d’adsorption sur l’évolution de composés organiques et minéraux des eaux naturelles. Thèse de Doctorat d’État, Université de Tizi-ouzou, Algérie, 231 p.
- ACHOUR S. et S. GUERGAZI (2002). Incidence de la minéralisation des eaux algériennes sur la réactivité de composés organiques vis-à-vis du chlore. Rev. Sci. Eau, 15, 649-668.
- ACHOUR S. et N. GUESBAYA (2005). Coagulation-floculation par le sulfate d’aluminium de composés organiques phénoliques et de substances humiques. Larhyss J., 4, 153-168.
- AFOUFOU F. (2002). Incidence de la préoxydation au chlore et au permanganate de potassium sur l’élimination des substances humiques par floculation. Mémoire de Magister, École Nationale Supérieure d'Hydraulique, Blida, Algérie, 109 p.
- BISSON M., R. DIDERICH, G. LACROIX, J.P. LEFEVRE, S. LEVEQUE, H. MAGAUD, et C. VILLEY (2005). « INERIS - Fiche de données toxicologiques et environnementales des substances chimiques - Phénol ». Verneuil-en-Halatte, France.
- BONNARD N., M.T. BRONDEAU, D. JARGOT, D. LAFON, S. MIRAVAL et SCHNEIDER (2011). Phénol, Fiche toxicologique. Fiche établie par les services techniques et médicaux, Institut national de recherche et de sécurité, Paris, France, 8 p.
- CHRISTIAN V., B. KIMBERLY, I. EVA et V. DEBBIS (2000). Impact of enhanced and optimized coagulation on removal of organic matter and biodegradable fraction in drinking. water. Water Res., 34, 3247-3257.
- CLÉMENT M., R. SEUX et B. MOUSSA (1983). Études des facteurs déterminant la fuite en aluminium dans les eaux d’alimentation préparées à partir d’eaux clarifiées par des sels de ce métal. Trib. Cebedeau, 480, 336, 469-481.
- DJELLOULI H.M., S. TALEB, A. BENGHALEM, A. CHERITI et A. MESLI (2010). Étude in vitro de l’inhibition de la précipitation de l’oxalate de calcium par les eaux saumâtre sahariennes par conductimètre. Phys. Chem. News, 52, 98-106.
- EHTASH M. (2011). Purification des eaux polluées par du phénol dans un pertracteur à disques tournants. Thèse de Doctorat en génie des procédés, Institut national des sciences appliquées de Rouen, France, 196 p.
- ENVIRONNEMENT CANADA (2002). Qualité des eaux de surface au Canada - Un aperçu. Direction de la qualité des eaux, Direction générale des eaux intérieures, Ottawa, Canada, 4 p.
- GUESBAYA N. (1998). Élimination des composés organiques par le procédé de coagulation-floculation. Mémoire de Magister en sciences hydrauliques, Université de Biskra, Algérie, 98 p.
- JECKEL M. (1986). Interactions of humic acids and aluminum salts in flocculation process. Water Res., 20, 1535-1542.
- JULIEN F., B. GUEROUX et M. MAZET (1994). Comparaison de l’élimination de molécules organiques par coagulation-floculation et par adsorption sur flocs d’hydroxyde métallique préformés. Water Res., 28, 2567-2574.
- LEFEBVRE E. (1990). Coagulation des substances humiques aquatiques par le fer ferrique en milieu aqueux. Effet de la préoxydation. Thèse de Doctorat, Université de Poitiers, France, 220 p.
- LEFEBVRE E. et J.P. CROUE (1995). Modification de la matière organique lors des traitements conventionnels de potabilisation. Rev. Sci. Eau, 8, 463-479.
- MAZET M. et M.T. WAIS MOSSA (1991). Influence des sels minéraux sur l’adsorption des acides humiques sur flocs d’hydroxydes de fer préformés. Environ. Technol., 12, 725-730.
- RAJKUMAR D., K. PALANIVELU et N. BALASUBRAMANIAN (2005). Combined electrochemical degradation and activated carbon adsorption treatments for wastewater containing mixed phenolic compounds. Environ. Eng. Sci., 4, 1-9.
- RAHNI M. (1994). Coagulation-floculation de quelques composés organiques par le fer ferreux en milieu aqueux. Étude de mécanisme et comparaison avec l’adsorption. Thèse de Doctorat, Université de Poitiers, France, 141 p.
- REZEG A. (2004). Élimination d’acides organiques hydroxylés et carboxylés par coagulation-floculation au sulfate d’aluminium. Mémoire de Magister en sciences hydrauliques, Université de Biskra, Algérie, 81 p.
- REZEG A. et S. ACHOUR (2009). Mécanismes d’élimination d’acides organiques aromatiques par le sulfate d’aluminium et effet de la minéralisation. Courrier Sav., 9, 25-33.
- RODIER J., B. LEGUBE et N. MERLET (2009). L’analyse de l’eau. 9e édition, DUNOD (Éditeur), Paris, France.
- Tabet Helal M.A. et N. Ghellai (2007). Caractérisation des eaux du barrage Hammam Boughrara (Algérie, Nord Occidental) destinées à la consommation humaine et à l’irrigation. Workshop : Gestion de l’Eau, Atelier Écotoxicologue et Hydrologie. Université de Corse, France, p. 260-270.
- YOUCEF L. et S. ACHOUR (2001). Défluoruration des eaux souterraines du sud algérien par la chaux et le sulfate d’aluminium. Courrier Sav., 1, 65-71.
Liste des figures
Figure 1
Influence de la dose de coagulant sur l'élimination des composés phénoliques (Co = 20 mg•L‑1, pH non-ajusté).
Effect of coagulant dosage on the removal of phenolic compounds (Co = 20 mg•L‑1, unadjusted pH).
Figure 2
Effet du pH sur l’élimination du phénol en présence des sels minéraux (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, dose du coagulant = 40 mg•L‑1).
Effect of pH on the removal of phenol in the presence of inorganic salts (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, the coagulant dose = 40 mg•L‑1).
Figure 3
Effet du pH sur l’élimination du pyrogallol en présence des sels minéraux (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, dose du coagulant = 5 mg•L‑1).
Effect of pH on the removal of pyrogallol in the presence of inorganic salts (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, the coagulant dose = 5 mg•L‑1).
Figure 4
Évolution du pourcentage d’élimination des composés phénoliques (Co = 20 mg•L‑1) dans les eaux de minéralisation variable.
Evolution of the percentage of removal of phenolic compounds (Co = 20 mg•L‑1) in various mineralized waters.
Liste des tableaux
Tableau 1
Caractéristiques des composés organiques étudiés.
Characteristics of organic compounds studied.
Tableau 2
Caractéristiques physico-chimiques des eaux de dilution des composés phénoliques.
Physico-chemical characteristics of the dilution water for the phenolic compounds.
Tableau 3
Récapitulatif des écarts des pourcentages d’élimination des composés phénoliques en présence des sels minéraux.
Summary of efficiencies and deviations in percentages of removal of the phenolic compounds in the presence of inorganic salts.






![Effet du pH sur l’élimination du phénol en présence des sels minéraux (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, dose du coagulant = 40 mg•L‑1).](/fr/revues/rseau/2014-v27-n3-rseau01631/1027810ar/media/5029384n.jpg)
![Effet du pH sur l’élimination du pyrogallol en présence des sels minéraux (Co = 20 mg•L‑1, [Ca2+] = [Mg2+] = 100 mg•L‑1, dose du coagulant = 5 mg•L‑1).](/fr/revues/rseau/2014-v27-n3-rseau01631/1027810ar/media/5029385n.jpg)