Résumés
Résumé
Les éléments minéraux contenus dans les eaux jouent un rôle important dans la croissance et la structure des biofilms élaborés en eaux douces. De plus, les concentrations en minéraux contenus dans les biofilms dépendent de leurs concentrations dans les eaux et sont susceptibles d'évoluer. Ces éléments minéraux peuvent être assimilés par les algues et les microorganismes présents dans les biofilms. C’est pourquoi l'étude a porté sur la répartition et le temps d'incorporation des principaux minéraux retrouvés au sein d'un biofilm épiphytique élaboré en eau douce anthropisée. Deux types de supports à biofilms ont été sélectionnés, dont Phalaris arundinaceae (baldingères) qui est très répandue au sein de notre zone d’étude, et des substrats artificiels de bambous plantés afin de connaître l’âge du biofilm. Les principaux paramètres physico-chimiques des eaux ont été suivis au cours du temps (de mars à juillet 2007) au sein de trois stations situées sur le bassin versant du Ribou (Cholet, France) notées TR, ZB et AV. Les résultats de l’étude ont révélé que les éléments chimiques majoritairement retrouvés sont le Si, le Fe, le Mn, l'Al, et dans une moindre mesure, le K, le Na, le Mg, le S, le P, et le Ca dont les proportions sont variables selon les biofilms et le temps de colonisation. La présence de Si est toujours majoritaire dans les biofilms étudiés (40 - 80 %) grâce à la présence de diatomées. Certains éléments comme le Fe, le P, le Ca, le K sont présents sur l'ensemble de la surface colonisée puisque toutes les cellules bactériennes ou algales contiennent ces éléments. Enfin, des relations entre les paramètres physico-chimiques et biologiques dans les eaux et les biofilms ont été mises en évidence par Analyses en Composantes Principales (ACP), notamment les concentrations en Fe dans les eaux et les proportions atomiques dans les biofilms en période estivale. Cette étude a apporté de nouvelles données de terrain sur la dynamique de fonctionnement entre les eaux et les biofilms.
Mots-clés :
- Biofilm épiphytique,
- éléments minéraux,
- microanalyse EDX,
- MEB,
- analyses semi-quantitatives,
- algues
Abstract
The mineral content in water plays an important role in the growth and the structure of biofilms grown in fresh waters. Moreover, the concentration of inorganic ions within biofilms depends on their concentrations in waters. The minerals can be assimilated by algae and microorganisms within biofilms. Therefore, this study focused on the distribution and the assimilation time of the main minerals within epiphytic biofilms grown in fresh waters contaminated by human activities. Two kinds of biofilm substrates were selected such as Phalaris arundinacea, which was widespread in our study area, and artificial substrates made of bamboo planted to control the biofilm age. The main physicochemical parameters of the water were monitored at three stations TR, ZB and AV. The results revealed that several inorganic elements, such as Fe, Mn, Si, Al, Na, K, Mg, S, P and Ca, were found within the natural biofilms. Among them, Si, Fe, Mn and Al were found in a high proportion. The Si was the most common element found within all biofilms studied (40-80%), reflecting the presence of diatoms with their silica walls. Some elements such as Fe, P, Ca, K were present throughout the colonized surface. We noted that Fe, Mn, Si and Al, which can form oxides, were most often found in biofilms. Finally, the relationships between physicochemical and biological parameters in waters and biofilms were explored by Principal Component Analysis (PCA), e.g., the Fe concentrations in waters and Fe proportions within the biofilms during the summer. The research has provided new information on the dynamics operating between waters and biofilms.
Keywords:
- Epiphytic biofilm,
- mineral compounds,
- X-ray microanalysis,
- SEM,
- semi-quantitative analysis,
- algae
Corps de l’article
1. Introduction
Les biofilms sont surtout constitués d'agrégats cellulaires bactériens emprisonnés dans une matrice de polysaccharides (COSTERTON, 1999), d'algues (diatomées, chlorophycées) et sont capables d'assimiler de nombreux minéraux (HIERNAUX, 2005; MIYATA et al., 2007; MORIN et al., 2008; QUINTELAS et al., 2009). De plus, certains éléments peuvent perturber la structure des diatomées (CONWAY, 1978; DE LA ROCHA et al., 2000) et par conséquent influencer la structure des biofilms. Parmi les minéraux retrouvés dans le biofilm, le fer (Fe) qui est abondant dans les eaux naturelles, influence de manière importante les caractéristiques physico-chimiques des milieux aquatiques par des processus d’adsorption et de précipitation (BOUST et al., 1999). Cet élément peut être retrouvé sous formes d’oxydes, d’hydroxydes ou d’oxy-hydroxydes (CORNELL et SCHWERTMANN, 1996). Le manganèse (Mn) est également très représenté dans les eaux et s'incorpore très bien dans les biofilms. Il peut présenter différents états d’oxydation dans le milieu naturel (II, III, IV). À des pH proches de 7, le manganèse contenu dans l’eau est majoritairement sous frme Mn (II) et est incorporé au sein du biofilm puis oxydé par les bactéries (P. putida, L. discophora) ou les champignons (ascomycètes) en MnO2 (MIYATA et al., 2007). Néanmoins, l’oxydation du Mn (II) par les spores de Bacillus pouvait passer d’un degré d’oxydation IV via un degré d’oxydation intermédiaire Mn (III) (WEBB et al., 2005). Certains éléments comme le Zn (II) et l’As (V) s’adsorbent très bien sur les oxydes de Mn (TANI et al., 2004; MIYATA et al., 2007). Cependant, il existe des interactions avec les oxydes de Mn pouvant limiter l’adsorption de certains métaux comme l’As (V) notamment par la présence de Ni (II), Co (II) et de Zn (II). En 2005, MURRAY et al. ont montré l’importance du processus biologique de formation des oxydes de Mn dans l’oxydation du Cr (III) en Cr (VI) mobile. D'autres minéraux comme le Cd peuvent perturber le système des perméases chez certaines diatomées. Certains minéraux peuvent être associés à des carbonates comme des carbonates de calcium (CaCO3), de magnésium (MgCO3), de manganèse (MnCO3), de zinc (ZnCO3), de fer (FeCO3). Les deux principaux qui peuvent être formés par les microorganismes sont la calcite et l’aragonite de structure CaCO3 (BANFIELD et HAMERS, 1997). La calcite résulte également de la saturation de l’eau. Des composés carbonatés sont aussi présents dans les eaux naturelles comme la dolomite (CaMg(CO3)2) et la sidérite (FeCO3).
D'autres éléments minéraux comme le silicium (Si) sont également présents dans les eaux et les biofilms. La forme la plus répandue est le quartz alpha SiO2. La silice colloïdale est une autre forme de quartz qui est souvent retrouvée dans les milieux aquatiques. En présence d’eau, la surface de ce composé s’hydroxyle pour former majoritairement des groupes silanols (HIERNAUX, 2005). Par ailleurs, des complexes silicium-aluminium (Si-Al) sont très souvent retrouvés dans la nature comme les micas (par exemple, la biotite de formule brute K(Mg,Fe)3(OH,F)2(Si3AlO10)).
Les concentrations et la nature des éléments minéraux peuvent varier selon les eaux à cause de la composition des sols, des apports anthropiques et des paramètres physico-chimiques (HIERNAUX, 2005; BOUST et al., 1999). De plus, le développement des algues dépend de plusieurs de ces paramètres, notamment du pH, des concentrations en nutriments, de la luminosité (GOLD, 2002). Elles sont également capables d'accumuler les métaux en raison du rapport élevé entre la surface et le volume cellulaire facilitant leur absorption à l'interface avec le milieu environnant. Enfin, les algues et les microorganismes peuvent facilement adhérer sur des supports végétaux ou inertes, immergés en eaux douces (BOURGUES ET HART, 2007; GOLD, 2002). Par conséquent, les paramètres des eaux peuvent très certainement influencer la structure, la composition et la répartition des éléments majeurs et mineurs au sein des biofilms épiphytiques. À ce jour, l'incorporation au cours du temps, l’influence des saisons et la répartition des éléments minéraux au sein d'un biofilm élaboré en eau douce, ne sont pas bien connues, c'est ce que nous avons étudié dans cet article en mettant en oeuvre la microscopie électronique à balayage (JÖBGEN et al., 2004) et la microanalyse EDX (NEWBURY, 1986; HIERNAUX, 2005) puis le dénombrement des algues et des cyanobactéries dans les eaux et les biofilms.
2. Matériel et méthodes
2.1 Présentation des eaux de stations pour l'étude des biofilms
Les stations TR, ZB, et AV sont localisées au niveau du bassin versant du lac de Ribou situé au sud-est de Cholet dans le département du Maine-et-Loire (49) en France. Les eaux de stations TR (rivière) et AV (situé aval du barrage du lac de Verdon) se jettent dans un plan d’eau représenté par la station ZB (plan d’eau : lac de Ribou). Les stations sont soumises à des apports importants de carbone organique total (COT), dissous (COD), de phosphore (P), d’orthophosphates (P-PO4) et subissent chaque année des épisodes d'efflorescences à cyanobactéries au début du printemps (stations ZB et AV) puis durant la période estivale (juillet-août) sur toutes les stations étudiées. En été, le milieu est très souvent réducteur avec des faibles concentrations en oxygène dissous, accompagnées de relargage de Fe et de Mn qui se retrouvent à des concentrations très élevées dans les eaux (DE NARDI et al., 2010). Les protocoles de mesures et de dosages des principaux paramètres physico-chimiques effectués sur trois stations (TR, ZB et AV) du 27 mars jusqu'au 16 juillet 2007, ont été basés selon les normes décrites dans l'ouvrage officiel des analyses d'eau (RODIER, 1996). Les résultats des analyses d'eau et des biofilms ont été répertoriés dans le tableau 1.
Tableau 1
Suivis des paramètres physico-chimiques des trois stations de mars à juillet 2007. Les valeurs moyennes sont indiquées dans le tableau (nd : absence de données) CE : CyanobactériesE, DE : DiatoméesE, AE AlguesE (E : Eau, B : biofilm), les données sont exprimées en abondance relative (%) pour les taxons présents respectivement dans les eaux et les biofilms. SiB, FeB et MnB sont exprimés en abondances relatives atomiques par rapport à tous les principaux métaux contenus dans les biofilms.
Physico-chemical parameters obtained from 3 sites from March to July 2007. The average values are indicated in the table (nd in the table means no data available) CE: Cyanobacteria, DE: Diatoma, AE Algae (E: water, B: biofilm). The data are given in relative atomic abundance (%) between taxons within waters and biofilms respectively. SiB, FeB and MnB are given in relative atomic abundance (%) compared among all mineral compounds contained within biofilms.
2.2 Préparation des échantillons pour une observation des biofilms au MEB
Le protocole de préparation des échantillons mis en oeuvre par ELLS et HANSEN en 2006 a été adapté à nos échantillons. Une solution de glutaraldéhyde à 4 % (50 mL) a été préparée avec de l’eau du lac de Ribou préalablement filtrée à l’aide de filtres millipores (0,45 μm) servant de solution tampon. L’utilisation de ces filtres permet d’éliminer les particules en suspension et les bactéries présentes dans l’eau, ce qui empêche les biais dans les échantillons observés par microscopie électronique à balayage (MEB, JEOL JSM 6310F). Ensuite, des tiges immergées de l’hélophyte Phalaris arundinacea (baldingère) présent en abondance ont été prélevées au sein des trois stations (5-10 cm de profondeur). À chaque campagne, le prélèvement des tiges a été effectué en parallèle avec les prélèvements d’eau pour les analyses physico-chimiques. Le tissu vivant prélevé a été rapidement immergé dans la solution de glutaraldéhyde fraîchement préparée et contenue dans une boîte de Petri. Puis, à l’aide d’une lame de rasoir, la tige a été sectionnée de manière à avoir une coupure nette et de façon à ne pas détériorer ou déformer les échantillons qui doivent être observés au MEB. Trois à cinq échantillons avec du biofilm mesurant quelques millimètres sont ensuite rapidement transférés dans un tube plastique contenant aussi de la solution de glutaraldéhyde à 4 % pour fixer les structures cellulaires. Les tubes ont ensuite été placés dans une cloche à vide et laissés 2 heures (sous vide). Cela permet d’enlever l’air présent dans l’échantillon et de favoriser la pénétration du glutaraldéhyde. Enfin, ce dernier a été retiré et mis en suspension dans l'eau du lac préalablement filtrée. À ce stade de la préparation, ils peuvent être conservés 15 jours au réfrigérateur à 4 °C.
Les échantillons ont subi une succession de traitements pour permettre leur observation au MEB :
Une solution de tétroxyde d'osmium (OsO4) à 2 % a été préparée dans le but de rendre l’échantillon plus conducteur. Cette dernière est composée de 50 % d'eau du lac de Ribou et 50 % d'OsO4 à 4 %. L'échantillon a été immergé dans la solution à 2 %.
Après avoir enlevé le tétroxyde d'osmium, puis lavé avec de l'eau déminéralisée (3 x 10 min.), l'échantillon a ensuite été déshydraté avec une solution d'éthanol à 50 % (20 min.), puis à 70 % (20 min.), 90 % (20 min.) et à 100 % (4 x 20 min.).
L'échantillon a été traité avec du HMDS (Hexaméthyldisilasane, [(CH3)6Si2NH]). Ce traitement qui permet le maintien des structures cellulaires a été effectué en trois étapes :
dans le tube : 50 % éthanol et 50 % HMDS, pendant 15 minutes;
25 % éthanol et 75 % HMDS, pendant 15 minutes;
dans une coupelle : 100 % HMDS, pendant une nuit à température ambiante.
Enfin, pour rendre l’échantillon conducteur, une étape de métallisation au carbone (30s) s’avère nécessaire (Métalliseur Baltec MED 020) avant toute observation au MEB. Ce sont les électrons secondaires qui sont analysés à 3 keV.
2.3 Analyses chimiques des biofilms par microanalyse EDX
Les analyses EDX sont effectuées à l’aide d’un système à dispersion d’énergie de rayons X (Link-Isis, Oxford). Un faisceau de 20 keV est envoyé sur l’échantillon à analyser. Les électrons présents dans le coeur de la matière sont éjectés. La désexcitation de l’atome ainsi ionisé se fait par une transition d’un électron vers les orbitales ayant préalablement perdu leurs électrons. Ce processus libère un photon X caractéristique des éléments chimiques considérés. Ces photons sont alors analysés (NEWBURY et al., 1986). Par cette méthode, une étude semi-quantitative entre chaque élément contenu dans les biofilms peut être effectuée ainsi que la réalisation de cartographies permettant d’étudier la répartition de chaque élément chimique (HIERNAUX, 2005). Le nombre de coups/s est approximativement de 1 000 et la sensibilité de la méthode est de 1 % (pourcentage atomique).
L'espèce sélectionnée P. arundinacea est directement présente en abondance sur les trois sites étudiés : ZB, AV, TR, et c'est pourquoi elle a été choisie pour l'étude. Puis, plusieurs dizaines de supports bambous séchés et rigides ont été plantés verticalement dans des zones immergées au niveau des trois stations. Le support étant le même pour toutes les stations, cela a permis de s'affranchir de l'influence du support au moment de la colonisation par les biofilms et aussi d’avoir une référence (t = 0 jours) pour suivre l’évolution de ce dernier au cours du temps à t = 10 jours et t = 29 jours. De plus, ils ne se déforment pas au contact de l’eau. Cependant, l’inconvénient de ce support est sa richesse en silicium visible en analyse EDX qui a lieu directement sur le support sans décrochage préalable du biofilm. Toutefois, il ne contient pas d’autres éléments excepté le P (environ 1 % atomique) et du Ca (moins de 1 % atomique). Dans nos conditions, il n’est pas possible de comparer la colonisation entre les supports séchés et les biofilms épiphytiques à cause de l’influence des supports sur les biofilms (CATTANEO et AMIREAULT, 1992; ISHIDA et al., 2008). Selon les campagnes de prélèvements, trois bambous (diamètre 0,8 ± 1 mm, taille moyenne de 30 cm) et/ou trois tiges de végétaux (d'environ 10 cm) recouvertes de biofilms ont été prélevés sur chaque site afin de mettre en évidence les proportions entre tous les éléments chimiques contenus dans les biofilms. Les supports à biofilms (bambous, végétaux) ont été découpés à l'aide d'une lame de rasoir pour obtenir quatre échantillons de 3 mm par bambou et séchés à l'air, ce qui permet d'avoir une valeur moyenne du pourcentage atomique relatif, déterminée sur plusieurs surfaces colonisées. L'analyse élémentaire par microsonde EDX est réalisée à de très faibles grossissements (× 300 au MEB) dans le but d'obtenir des proportions (en minéraux) représentatives des échantillons étudiés. Le nombre de quatre échantillons, qui a été établi expérimentalement à partir d'une étude préalable effectuée sur dix échantillons de 3 mm, suffisait pour suivre l'évolution des proportions des minéraux au sein d'un biofilm. Nous remarquerons que lorsque le support est recouvert par le biofilm, le faisceau EDX ne pénétrant que sur quelques micromètres (environ 5 - 6 µm), n'atteint plus la surface de ce dernier.
Pour réaliser une cartographie par élément, plusieurs échantillons ont été traités au glutaraldéhyde à 4 % puis laissés sous vide pendant 2 h avant de subir uniquement une étape de déshydratation à l’éthanol. Cette étape, qui permet de fixer les biofilms sur leurs supports, n'apporte pas de minéraux susceptibles d'interférer avec les éléments du biofilm comme l'osmium.
2.4 Dénombrements des algues et des cyanobactéries
Les dénombrements d’algues (essentiellement des chlorophycées dans notre cas), de diatomées et de cyanobactéries ont été effectués dans les biofilms et les eaux. À chaque dénombrement, nous avons distingué les algues des diatomées car les paramètres physico-chimiques influençant la croissance de ces deux taxons ne sont pas les mêmes bien que les diatomées soient des algues siliceuses. Pour effectuer les dénombrements, les biofilms, recouvrant les surfaces des baldingères (tiges immergées), ont préalablement été rincés à l’eau distillée stérile, puis récupérés par décrochage (sur 10 cm par tige) à l’aide d’une lame de rasoir. Ces derniers ont été mis en suspension dans 3 mL d’eau distillée contenue dans un tube à essai, puis traités aux Ultrasons (47 kHz) pendant 5 min. pour dissocier les amas visibles à l’oeil nu. Une goutte de suspension a été prélevée puis déposée entre lames et lamelles. Le comptage des taxons a été réalisé au microscope optique G × 1000 à immersion. Sur 100 individus comptés, des abondances relatives ont été établies entre diatomées, algues et cyanobactéries. L’expérience a été répétée deux fois. En parallèle, les dénombrements ont été effectués dans les eaux respectives. Un volume de 100 mL d’eau a été filtré sur une membrane d’acétate de cellulose de diamètre 0,45 μm, placée sur un module de filtration. L’aspiration a été réalisée à l’aide d’une pompe à vide. L’ensemble du phytoplancton, incluant les cyanobactéries, a été retenu sur la membrane et mis dans un tube à essai contenant 3 mL d’eau distillée stérile. Le tube a été placé sous agitation à l’aide d’un vortex durant 30 s. Le comptage a été réalisé comme précédemment entre lames et lamelles.
2.5 Analyses statistiques
Les Analyses en Composantes Principales et les coefficients de Pearson ont été réalisés à l’aide du logiciel SPSS version 18.0 sur les données physico-chimiques et biologiques obtenues sur l’ensemble des trois stations lors des campagnes de prélèvements mensuelles entre mars et juillet 2007 (Tableau 1). Les données manquantes ont été remplacées par la valeur moyenne. Seules les corrélations les plus significatives (Pearson) ont été retenues. Une analyse de la variance (ANOVA) a été mise en oeuvre pour comparer les abondances relatives des éléments chimiques entre les différents sites.
3. Résultats et discussion
3.1 Étude de biofilms épiphytiques
Le tableau 1 indique les caractéristiques physico-chimiques des eaux durant le début du printemps jusqu’en juillet. Les résultats montrent que le point d’eau le plus minéralisé correspond à la station TR avec des conductivités dépassant les 300 µS•cm-1. Le pH dépasse régulièrement 8 au niveau de toutes les stations au début du printemps et proche de 7 durant l’été 2007 (juin, juillet). La valeur de l’oxydabilité au KMnO4 est plus élevée au niveau des eaux de la station AV durant le mois de mars/avril et est plus élevée au niveau de la station TR jusqu’en juillet. Les concentrations en P total, P-PO4, COT et COD sont en général plus importantes au niveau des eaux de la station TR. En effet, les concentrations en P total au sein de TR varient de 0,1 à 0,7 mg•L-1 et dépassent rarement les 0,1 mg•L-1 au niveau des deux autres stations. Le COT peut également varier d’un facteur 3 par rapport aux eaux AV et ZB. Cela est certainement lié aux apports anthropiques plus importants au sein de cette station (DE NARDI et al., 2010). Les concentrations de chlorophylle a sont plus élevées en moyenne au niveau de la station ZB (13,2-23,8 µg•L-1). Les concentrations en azote ammoniacal sont toujours supérieures au niveau de la station ZB. Les concentrations en azote Kjeldahl se situent souvent entre 1 et 2 mg•L-1. La station TR a une concentration en fer plus élevée par rapport aux deux autres stations (0,524 - 1,98 mg•L-1), alors que la concentration en manganèse est plus importante dans les eaux de la station ZB (0,093-0,293 mg•L-1).
La figure 1 met en évidence les abondances relatives des éléments chimiques issus de biofilms localisés à la surface de tiges immergées de l’espèce P. arundinacea. Les éléments les plus souvent retrouvés sont le silicium, l'aluminium, le potassium, le magnésium, le phosphore, le calcium, le fer et le manganèse. Ces résultats montrent que le silicium, indépendamment de la station de prélèvement, est toujours très majoritaire par rapport aux autres éléments chimiques et représente environ 40 - 60 % des éléments minéraux. La présence de diatomées dans tous les biofilms étudiés contribue à l'apport de Si qui est l'élément constitutif des parois (Germain, 1981). Globalement, l'analyse de la variance (ANOVA) montre que les proportions atomiques relatives des éléments comme le Fe, le Mn, l'Al et le Si varient très significativement selon les stations (p<0,001) et les campagnes de prélèvements (p<0,001). La variation du P est également significative (p<0,05) alors que le Ca, le K et le Mg ne semblent pas varier (p>0,05) dans nos conditions.
Figure 1
Évolution des abondances relatives des principaux éléments présents dans les biofilms épiphytiques (Phalaris arundinacea) échantillonnés au niveau des stations TR, AV et ZB en mars et en juillet 2007; échantillons : N = 12, taille : 3 mm prélevés à 5-10 cm de profondeur.
Evolution of relative abundance of main minerals in epiphytic biofilm (Phalaris arundinacea) sampled at the TR, AV and ZB sites in March and July 2007 (N=12, size: 3 mm, taken at 5-10 cm depth).
3.2 Étude de la répartition par élément chimique
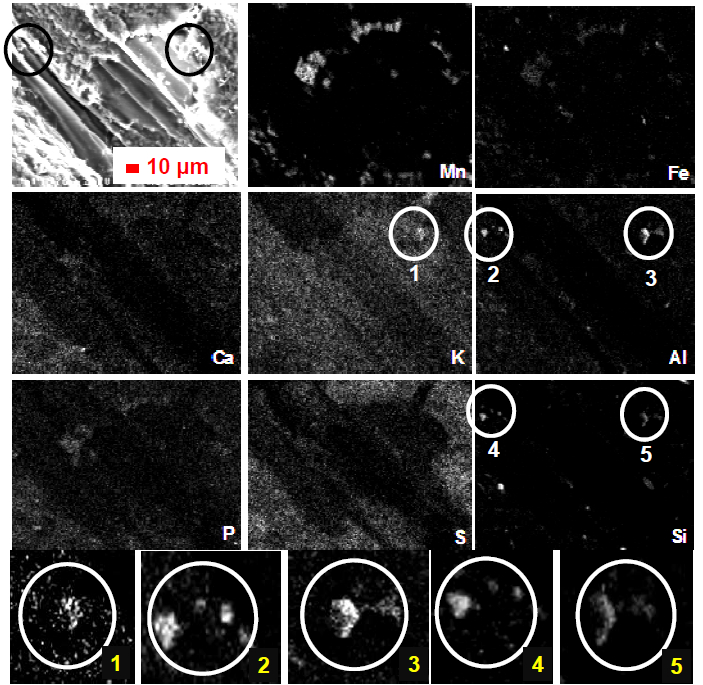
Cette approche est possible grâce à la microanalyse X qui a permis de réaliser une cartographie par élément chimique. Les photographies ont été sélectionnées sur un ensemble de 341 clichés et sont représentatives de toutes nos observations. Les figures 2 à 4 montrent la répartition des principaux éléments chimiques (Mn, Si, Al, Fe, Ca, S, K, P, Cl) obtenus par analyse élémentaire à l’aide d’une microsonde EDX, retrouvés dans les biofilms issus des tiges de P. arundinacea. Dans nos conditions opératoires, les éléments à l'état de traces ne sont pas détectés (<1 %). Des clichés ont été choisis volontairement de façon à se situer sur des zones présentant des strates variables où sont visibles à la fois les biofilms et le support végétal. Cette approche a permis de distinguer les minéraux contenus dans le végétal et ceux contenus dans les biofilms. Les figures 2 à 4 montrent que les biofilms présentent une hétérogénéité dans la répartition des éléments chimiques au sein de la station ZB (COSTERTON et STEWART, 2001). Cependant, des tendances générales ont été observées, notamment avec la présence de manganèse qui apparaît plus marquée sur les premières strates du biofilm, alors que lorsque la colonisation par les diatomées est plus importante (Figure 2 : rectangle à droite), le manganèse n'apparaît quasiment plus. Lors des premières étapes de formation du biofilm, les bactéries sont les principales « colonisatrices » dont certaines sont capables d’oxyder le manganèse (MIYATA et al., 2007). Le Mn incorporé sous forme dissoute dans les bactéries au sein du biofilm s’oxyde majoritairement en MnO2 (MIYATA et al., 2007). Au sein d’amas importants de diatomées (Figure 2, Mn), le manganèse n’apparaît pas ou peu à l’analyse EDX. Sur ces zones, les bactéries apparaissent également moins présentes. Les bactéries semblent jouer un rôle plus important que les diatomées dans l’incorporation du Mn au sein d’un biofilm. Il faut noter que lorsqu’un biofilm est suffisamment épais (plusieurs dizaines de microns dans notre cas), le faisceau d’électrons (pénétration de quelques micromètres dans l’échantillon) n’atteint pas les premières couches de la « matrice » qui sont colonisées par les bactéries. Par conséquent, le manganèse susceptible d'être présent dans les premières couches n’est pas mis en évidence.
Figure 2
Répartition des éléments chimiques majeurs (Mn, Si, Al, Fe , Ca) au sein de biofilms par microanalyses X (date du prélèvement mars 2007, Station ZB)
Distribution of chemical elements (Mn, Si, Al, Fe, Ca) in biofilms, obtained by X-Ray microanalysis (March 2007, ZB site).
Parmi les autres éléments, le Si est aussi présent au niveau des diatomées puisqu’il est le principal élément constitutif de leurs parois (GERMAIN, 1981; GOLD et al., 2002). De ce fait, en se référant aux résultats de microanalyse X, la présence de diatomées contribue fortement à la présence de silicium au sein d’un biofilm. L’Al est souvent présent sur toute la surface. Cependant, il apparaît souvent très présent dans les zones des biofilms riches en diatomées (Figure 3). En effet, il existe dans la nature de nombreux complexes à base de Si et Al, comme il a été observé dans certains biofilms (Figure 4 (cercles blancs)). Par conséquent, il semblerait alors possible que des complexes Si-Al puissent également se former sur les parois des diatomées présentes dans les biofilms épiphytiques. De plus, il apparaît dans certains complexes de Si-Al, du potassium (Figure 4) qui correspondrait à des micas comme la muscovite. Le Ca, le S et le P sont aussi retrouvés dans les biofilms. Bien que ces éléments soient présents dans les plantes, ces derniers apparaissent dans les zones en présence de biofilms (Figure 4). Le S et le P sont également des constituants des microorganismes en général et le Ca intervient dans les processus cellulaires de ces derniers en activant certains gènes (PATRAUCHAN et al., 2005), ou bien dans la structuration et la stabilité mécanique des biofilms (HIERNAUX, 2005; MAYER et al., 1999). Le K et les Cl sont des éléments indispensables à la vie d'une bactérie puisqu'ils interviennent au niveau des pompes à transport actif lors des échanges cellulaires. C'est pourquoi ils sont logiquement présents au sein d'un biofilm. Mais il existe aussi des complexes naturels d'argiles qui contiennent ces éléments et qui sont susceptibles d'être retrouvés dans les biofilms.
Figure 3
Répartition des éléments majeurs (Si, Mn, Fe, Al, Ca, Cl , P, K) au sein de biofilms par microanalyses X (date du prélèvement mars 2007, Station ZB).
Distribution of chemical elements (Si, Mn, Fe, Al, Ca, Cl, P, K) in biofilms, obtained by X-ray microanalysis (March 2007, ZB site).
Figure 4
Répartition des éléments majeurs (Si, Mn, Fe, Al, Ca, S , P, K) au sein de biofilms par microanalyses X (date du prélèvement mars 2007, Station ZB).
Distribution of chemical elements (Si, Mn, Fe, Al, Ca, S, P, K) in biofilms, obtained by X-ray microanalysis (March 2007, ZB site).
Le fer compte parmi les éléments les plus représentés dans les biofilms (Figures 1, 2, 3, 4). Ce dernier est probablement d’origine minérale. Cet élément peut aussi se lier à la matière organique, ou bien être assimilé par les bactéries et les algues. De plus, il représente un pourcentage plus important dans les biofilms en période estivale (Figure 1, juillet 2007). En effet, les résultats observés sur la figure 1 montrent que, globalement, les pourcentages atomiques relatifs du Fe varient de 9 à 15 % selon les stations, sur la campagne de juillet et seulement de 2 à 7 % sur la campagne de mars (p<0,05). Pour confirmer ces résultats, des études antérieures ont montré qu'au niveau de la station TR, l'élément Fe pouvait représenter 60 % de l'ensemble des éléments chimiques d'un biofilm prélevé en milieu réducteur (période estivale), avec des concentrations en O2 dans l'eau de 2 mg•L-1 (DE NARDI, 2009).
Enfin, des études ont montré que les algues (diatomées) étaient capables d'accumuler des métaux comme le Cd, le Zn, l'As, le Ni (CONWAY, 1978; GOLD, 2002; WANG et al., 2001). Les bactéries telles que E. coli retrouvées dans les eaux douces pouvaient assimiler le Cd (II), le Fe (III), le Ni (II) et le Cr (VI) (QUINTELAS et al., 2009). Par conséquent, les minéraux retrouvés dans un biofilm pourraient partiellement dépendre de sa composition algale et bactérienne.
3.3 Évolution temporelle des abondances relatives des éléments chimiques dans les biofilms sur substrats artificiels de bambous
La figure 5 met en évidence l’évolution des abondances relatives des éléments chimiques présents au sein d’un biofilm constitué à la surface de supports bambous immergés. Lors de l’étude, le Si étant déjà incorporé au support, ce dernier ne sera pas étudié. La figure 5 indique qu'au niveau de la station AV, après dix jours d’immersion, aucun élément chimique n'est présent à la surface du support et seulement après 29 jours, il apparaît du Fe, Mn, Al, Na et K, alors qu’au niveau de la station TR, après dix jours seulement, l'analyse du support met en évidence onze éléments (Silicium exclu) avec majoritairement du Mn et de l’Al. L’abondance atomique relative de l'élément calcium est plus élevée pour cette station après dix jours d'immersion. Par conséquent, ce dernier est bien incorporé au biofilm. Cinq éléments sont présents sur des supports plantés au niveau de la station ZB après dix jours (Al, S, Ca, K, Fe) et huit après 29 jours d'immersion. Ces résultats ont montré que la présence et les abondances relatives entre les éléments minéraux sont variables selon le temps d’immersion (p<0,05) et les stations de prélèvements (p<0,05). Par conséquent, l'incorporation des éléments minéraux dans les biofilms est variable selon les eaux de surface. La figure 6 illustre un suivi de la colonisation des supports effectuée par MEB. Le temps de colonisation diffère selon les stations. En effet, à t = 10 jours, les supports plantés au niveau de la station AV ne sont pas colonisés expliquant l'absence d’éléments minéraux (Figure 6) alors qu’au niveau de la station ZB, un début de colonisation est visible par la présence de diatomées (Gomphonema sp.) en surface. Après dix jours de colonisation, la surface du support issu de la station TR est totalement recouverte. Ces résultats montrent que le biofilm se développe plus rapidement au sein de la station TR. Il semble possible que les apports en nutriments tels que le COD et/ou le P puissent jouer un rôle sur le temps de colonisation (PARINET, 2005). En effet, la station TR est la plus concentrée en COD et P. Dans le cadre de notre étude, chaque biofilm est caractéristique d’un prélèvement donné et vraisemblablement lié à l’environnement dans lequel il a évolué. Afin de compléter notre approche, nous nous sommes intéressés aux interactions éléments minéraux/eau/biofilms en incluant les différents taxons étudiés (diatomées, algues et cyanobactéries).
Figure 5
Évolution des abondances relatives des principaux éléments présents dans les biofilms élaborés à la surface de supports bambous immergés (stations TR, ZB et AV).
Evolution of the relative abundance of major mineral elements in biofilms on immersed bamboo (TR, ZB and AV sites).
Figure 6
Photographies prises au MEB de biofilms colonisant les supports artificiels de bambous échantillonnés dans trois stations (TR, ZB et AV) ) à t = 10 jours, 29 jours (TR, ZB, AV) et 49 jours (ZB et AV).
Biofilms colonizing artificial substrates (bamboos) observed by SEM, sampled from three sites (TR, ZB, AV) at t = 10 days, 29 days for TR, ZB, AV and 49 days for ZB and AV only.
3.4 Étude de la relation eau/biofilm par analyses en composantes principales
Les figures 7 et 8 montrent les diagrammes des deux principales composantes représentant les variables (Figures 7A et 8A) et les eaux de stations (Figures 7B et 8B). Ces derniers ont été obtenus à partir des campagnes de prélèvements allant de mars à juillet 2007 (Tableau 1). Les valeurs de COT et COD de la station TR étant très marquées, les résultats influencent fortement l’ACP. Par conséquent, pour une meilleure visibilité, une ACP a été effectuée sur les données de mars à juin (Figure 7), puis une deuxième ACP a été réalisée en incluant les données des paramètres physico-chimiques du mois de juillet (Figure 8). Ces résultats permettent de suivre simultanément l’évolution des paramètres physico-chimiques des eaux et des biofilms au cours des mois. De mars à avril, les eaux sont marquées par les nitrates favorables au développement des algues contenues dans l’eau (AlguesE) pouvant influencer le pH en alcalinisant l’eau et la teneur en oxygène (Concentration O2 et pourcentage de saturation en oxygène noté Oxygène sat). Dans notre cas, à cette période, les biofilms sont plutôt marqués par les diatomées qui sont bien corrélées avec le Si contenu dans ces derniers (SiB) confirmant ainsi les données obtenues par cartographies par éléments (Figures 2, 3). De mai à juin, les stations AV et ZB se distinguent nettement de la station TR. En effet, cette dernière est marquée par les apports anthropiques (COD, COT, Ptotal, P-PO4, Fe, Conductivité) alors que les stations ZB et AV, par le développement algal (DiatoméesE, AlguesB) et des cyanobactéries. Durant cette saison, la production de chlorophylle a apparaît mieux corrélée avec les diatomées contenues dans les eaux. Il semblerait également qu’il y ait une relation nette entre l’ion ammoniacal et l'abondance en cyanobactéries retrouvées dans les biofilms (r = 0,657, p<0,05). En effet, les cyanobactéries immobilisées sont capables de produire de l’ammoniac (PARK et al., 1991). Dans notre cas, ces dernières contribueraient à l’apport de l’ammoniac dans les eaux douces surtout au niveau de la station ZB. Lorsque le pH est inférieur à 9,2, comme le cas présent (Tableau 1), la forme majoritaire retrouvée dans la colonne d’eau est l’ion ammoniacal. Enfin, la corrélation entre le Manganèse (Mn) et l’ion ammoniacal (NH4) sont également significatives (r = 0,718, p<0,05) et traduit un milieu réducteur, avec un relargage du Mn des sédiments ou des apports extérieurs plus marqués au niveau des stations AV et ZB durant mai et juin.
Figure 7
Diagrammes des composantes principales obtenus par ACP représentant les variables (A) et les stations (B) sur des données physicochimiques et algales allant de mars à juin 2007 (une campagne de prélèvements/mois au niveau des trois stations (TR, ZB et AV).
Principal components analysis (PCA) obtained from physicochemical and biological data representing variables (A) and sites (B). Samples were collected once per month at the TR, ZB and AV sites between March and June 2007.
Figure 8
Diagrammes des composantes principales obtenues par ACP représentant les variables (A) et les stations (B) sur des données physicochimiques et algales allant de mars à juillet 2007 (une campagne de prélèvements/mois au niveau des trois stations (TR, ZB et AV).
Principal components analysis (PCA) obtained from physicochemical and biological data representing variables (A) and sites (B). Samples were collected once per month at the TR, ZB and AV sites between March and July 2007.
Dans notre cas, en ajoutant les données de juillet, les processus qui gouvernent la présence de l’ion ammoniacal dans l’eau ne sont plus liés aux cyanobactéries dans les biofilms mais aux apports anthropiques et/ou aux conditions du milieu réducteur. De plus, l’ACP montre qu’il apparaît une corrélation entre le fer présent dans la colonne d’eau et sa proportion relative au sein des biofilms (r 0,625, p<0,05). Cette relation est probablement lié au relargage du fer par les sédiments puisque le milieu est réducteur (DE NARDI et al., 2010), associé à son incorporation dans les biofilms dépendant de sa concentration en solution et de sa biodisponibilité (MIYATA et al., 2007). Son lien étroit avec la matière organique (COT, COD) semblerait montrer des complexes MO-Fe directement liés aux apports anthropiques (DE NARDI et al., 2010). Il pourrait également y avoir un « effet de concentrations » des éléments chimiques lié à l’évaporation. Les proportions de fer dans les biofilms sont également corrélées avec les cyanobactéries présentes dans l’eau (r = 0,652, p<0,05). L’ensemble de ces résultats pourrait alors expliquer les nouvelles corrélations entre les différents paramètres physico-chimiques en période estivale ((Figure 8) non mises en évidence sur la figure 7) et qui seraient une résultante de l’eutrophisation du milieu, amplifiée par le processus d’évaporation.
Il apparaît aussi sur le graphique que les DiatoméesB et la SiB sont logiquement moins bien corrélés car nous raisonnons en abondance relative. Par conséquent, si les proportions de fer sont plus importantes sur la campagne de juillet, cela diminue les proportions de Si et réciproquement, ce qui ne veut pas dire que les teneurs en SiB soient plus faibles. Néanmoins, les résultats antérieurs montrent que lorsque la concentration en fer augmente dans les eaux, son abondance relative augmente au sein des biofilms et atteint près de 60 % (DE NARDI, 2009). Enfin, le MnB et les diatoméesB sont faiblement corrélés (r = 0,553, p<0,05). Cette relation peut s’expliquer par une affinité entre certaines diatomées avec le Mn ou bien que les diatomées adhèrent facilement à une surface déjà colonisée par les bactéries oxydant le Mn (Cocconeis sp, Figure 2, cercles). En effet, nous avons observé par analyse EDX que le Mn apparaît très souvent sur les premières strates lors de la formation des biofilms sur lesquelles viennent adhérer les diatomées.
4. Conclusion
L’abondance atomique relative des principaux éléments retrouvés dans les biofilms est variable selon les campagnes de prélèvements et les stations. En effet, nous avons montré que le biofilm se développait plus rapidement au niveau de la station TR dans lequel se retrouvait un nombre plus important d’éléments minéraux dans des proportions visibles à l’analyse élémentaire par microsonde EDX. L’incorporation des éléments chimiques au sein des biofilms est dépendante des stations étudiées laissant supposer que la nature du biofilm semble très étroitement dépendre de son lieu de prélèvement. Ce dernier pourrait faire l'objet d'une qualification en tant que bioindicateur à part entière en l'analysant scrupuleusement sans se limiter aux diatomées qui sont déjà utilisées comme des bioindicateurs naturels de qualité d'eau. De plus, il est important de souligner que les biofilms épiphytiques contenant de nombreuses espèces chimiques comme le Fe, Mn, Si, Ca, laissent supposer un rôle majeur dans la dynamique et la régulation de ces éléments au sein des systèmes aquatiques continentaux. Enfin, des relations entre des paramètres physicochimiques et biologiques dans les eaux et les biofilms ont été mises en évidence par Analyse en Composantes Principales (ACP) comme les diatomées et le Si dans les biofilms, les concentrations de fer dans les eaux et les proportions de fer dans les biofilms en période estivale, les cyanobactéries retrouvées dans les biofilms et l’ion ammoniacal durant le printemps. De plus, cette approche statistique montre l’évolution des différents paramètres étudiés entre mars et juillet 2007 révélant des spécificités entre les eaux et les biofilms de chaque station. En perspectives, afin de s’affranchir de la variabilité des conditions environnementales, des études futures sur l’élaboration de biofilms à partir d’eaux douces et dans des conditions contrôlées au sein de bioréacteurs s’avèreront indispensables.
Parties annexes
Remerciements
Le SCIAM d'Angers et tout particulièrement R. Filmon (Responsable du service microscopie), R. Mallet et S. Georgeault (techniciens) pour l’aide à la réalisation des images MEB et EDX; B. Parinet, T. Lodé, C. Puaud et P. Coutant, pour leurs précieux conseils concernant l'avancement de ces travaux, AQUASCOP d'Angers pour les analyses d'eaux et V. Tallec pour son aide précieuse en anglais.
Références bibliographiques
- BANFIELD. J.F. et R.J. HAMERS (1997). Processes at minerals and surfaces with relevance to microorganisms and prebiotic synthesis. Dans : Geomicrobiology: Interactions Between Microbes and Minerals.Banfield J.F. and Nealson K.H. (Editors). Rev. Mineral. Geochem., 35, 81-122.
- BOURGUES S. et B.T.H. HART (2007). Nitrogen removal capacity versus epiphytic biofilms. Water Sci. Technol., 55, 175-182.
- BOUST. D., J-C. FISCHER, B. OUDDANE, F. PETIOT et M. WARTEL (1999). Fer et manganese : réactivités et recyclages, programme Seine-Aval, France, 39 p.
- CATTANEO A. et M.C. AMIREAULT (1992). How artificial are artificial substrata for periphyton?, J. N. Am. Benthol. Soc., 11, 244-256.
- CONWAY. H.L. (1978). Sorption of arsenic and cadmium and their effects on growth, micronutrient utilization, and photosynthetic pigment composition of Asterionella Formosa. J. Fish. Res. Board Can., 35, 286-294.
- CORNELL. R.M. et U. SCHWERTMANN (1996). The iron oxides. Structure, properties, reactions, occurrence and uses. VCH, New York, NY. États-Unis, 573 p.
- COSTERTON J.W. (1999). « Introduction to biofilm ». Int. J. Antimicrob. Ag., 11, 217-221.
- COSTERTON B. et P. STEWART (2001). Les biofilms. Science, 287, 48-53.
- ELLS T.C. et L.T. HANSEN (2006). Strain and growth temperature influence Listeria spp. Attachment to intact and cut cabbage. Int. J. Food Microbiol., 111, 34-42.
- DE LA ROCHA C.L., D.A. HUTCHINS, M.A. BRZEZINSKI et Y.H. ZHANG (2000). Effects of iron and zinc deficiency on elemental composition and silica production by diatoms. Mar. Ecol. Prog. Ser., 195, 71-79.
- DE NARDI F. (2009). Excès de phosphore et de matières organiques naturelles dans les eaux de retenues : diagnostic et remèdes, cas du lac de Ribou à Cholet (Maine-et-Loire, France). Thèse de Doctorat, Université d'Angers, France, 226 p.
- DE NARDI F., C. PUAUD, T. LODE, J. LECORFF, B. PARINET et M. PONTIE (2010). Diagnostic préliminaire et perspectives d’élimination du phosphore (P) en excès dans le lac de Ribou (Cholet, Maine-et-Loire, France). J. Water Sci., 23, 159-171.
- GERMAIN H. (1981). Flore des diatomées; eaux douces et saumâtres du Massif Armoricain et des contrées voisines d’Europe occidentale. Société nouvelle des éditions Boubée, Paris, France, 444 p.
- GOLD C. (2002). Étude des effets de la pollution métallique (Cd/Zn) sur la structure des communautés de diatomées périphériques des cours d’eau. Approches expérimentales in situ et en laboratoire. Thèse de Doctorat, Université de Bordeaux 1, France, 175 p.
- GOLD C., A. FEURTET-MAZEL, M. COSTE et A. BOUDOU (2002). Field transfer of periphytic diatom communities to assess short-term structural effects of metals (Cd, Zn) in rivers. Water Res., 36, 3654-3664.
- HIERNAUX P. (2005). Contribution de la fraction minérale des eaux au développement et à la structure des biofilms : apport des méthodes microscopiques et spectroscopiques. Thèse de Doctorat, Université de Poitiers, France, 225 p.
- ISHIDA C.K., S. ARNON, C.G. PETERSON, J.J. KELLY et K.A. GRAY (2008). Influence of algal community structure on denitrification rates in periphyton cultivated on artificial substrata. Microb. Ecol., 56, 140-152.
- JÖBGEN A.M., A. PALM et M. MELKONIAN (2004). Phosphorus removal from eutrophic lakes using periphyton on submerged artificial substrata. Hydrobiologia, 528, 123-142.
- MAYER C., R. MORITZ, C. KIRSCHNER, W. BORCHARD, R. MAIBAUM, J. WINGENDER et H.-C. FLEMMING (1999). The role of molecular interactions: studies on model systems for bacterial biofilms. Int. J. Biol. Macromol., 26, 3-16.
- MIYATA N., D. SUGIYAMA, Y. TANI, H. TSUNO, H. SEYAMA, M. SAKATA et K. IWAHORI (2007). Production of biogenic manganese oxides by repeated cultures of laboratory microcosms. J. Biosci. Bioeng., 103, 432-439.
- MORIN S., T.T. DUONG, A. DABRIN, A. COYNEL, O. HERLORY, M. BAUDRIMONT, F. DELMAS, G. DURRIEU, J. SCHÄFER, P. WINTERTON, G. BLANC et M. COSTE (2008). Long-term survey of heavy-metal pollution, biofilm contamination and diatom community structure in the Riou Mort watershed, South-West France. Environ. Pollut., 151, 532-542.
- MURRAY K.J., M.L. MOZAFARZADEH et B.M. TEBO (2005). Cr(III) oxidation and Cr toxicity in cultures of the manganese (II)-oxidizing Pseudomonas putida strain GB-1. Geomicrobial. J., 22, 151-159.
- NEWBURY D.E., D.C. JOY, P. ECHLIN, C.E. FIORI et J.I. GOLDSTEIN (1986). Advanced scanning electron microscopy and X-Ray microanalysis. Plenum Press, New York, NY, États-Unis, 454 p.
- PARINET J. (2005). Incidence des caractéristiques physico-chimiques et microbiologiques des eaux sur les caractéristiques des biofilms. Rapport de Master recherche, Université de Poitiers, France, 32 p.
- PARK I.H., K.K. RAO et D.O. HALL (1991). Photoproduction of hydrogen, hydrogen peroxide and ammonia using immobilized cyanobacteria. Int. J. Hydrogen Ener., 16, 313-318.
- PATRAUCHAN M.A., S. SARKISOVA, K. SAUER et M.J. FRANKLIN (2005). Calcium influences cellular and extracellular product formation during biofilm-associated growth of a marine Pseudoalteromonas sp. Microbiology, 151, 2885-2897.
- QUINTELAS C., Z. ROCHA, B. SILVA, B. FONSECA, H. FIGUEIREDO et T. TAVARES (2009). Removal of Cd(II), Cr(VI), Fe(III) and Ni(II) from aqueous solutions by an E. coli biofilm supported on Kaolin. Chem. Eng. J., 149, 319-324.
- RODIER J. (1996). L’analyse de l’eau. Eaux naturelles, eaux résiduaires, eaux de mer. 8e édition. DUNOD, Paris, France, 1383 p.
- TANI Y., M. MIYATA, M. OHASHI, T. OHNUKI, H. SEYAMA, K. IWAHORI et M. SOMA (2004). Interaction of inorganic arsenic with biogenic manganese oxide produced by a Mn-oxidizing fungus, strain KR21-2. Env. Sci. Technol., 38, 6618-6624.
- WANG W.X., R.C.H. DEI et X. YAN (2001). Responses of Zn assimilation by coastal plankton to macronutrients. Limnol. Oceangr., 46, 1524-1534.
- WEBB S.M., G.J. DICK, J.R. BARGAR et B.M. TEBO. (2005). Evidence for the presence of Mn(III) intermediates in the bacterial oxidation of Mn(II). Proc. Nat. Acad. Sci., USA, 102, 5558-5563.
Liste des figures
Figure 1
Évolution des abondances relatives des principaux éléments présents dans les biofilms épiphytiques (Phalaris arundinacea) échantillonnés au niveau des stations TR, AV et ZB en mars et en juillet 2007; échantillons : N = 12, taille : 3 mm prélevés à 5-10 cm de profondeur.
Evolution of relative abundance of main minerals in epiphytic biofilm (Phalaris arundinacea) sampled at the TR, AV and ZB sites in March and July 2007 (N=12, size: 3 mm, taken at 5-10 cm depth).
Figure 2
Répartition des éléments chimiques majeurs (Mn, Si, Al, Fe , Ca) au sein de biofilms par microanalyses X (date du prélèvement mars 2007, Station ZB)
Distribution of chemical elements (Mn, Si, Al, Fe, Ca) in biofilms, obtained by X-Ray microanalysis (March 2007, ZB site).
Figure 3
Répartition des éléments majeurs (Si, Mn, Fe, Al, Ca, Cl , P, K) au sein de biofilms par microanalyses X (date du prélèvement mars 2007, Station ZB).
Distribution of chemical elements (Si, Mn, Fe, Al, Ca, Cl, P, K) in biofilms, obtained by X-ray microanalysis (March 2007, ZB site).
Figure 4
Répartition des éléments majeurs (Si, Mn, Fe, Al, Ca, S , P, K) au sein de biofilms par microanalyses X (date du prélèvement mars 2007, Station ZB).
Distribution of chemical elements (Si, Mn, Fe, Al, Ca, S, P, K) in biofilms, obtained by X-ray microanalysis (March 2007, ZB site).
Figure 5
Évolution des abondances relatives des principaux éléments présents dans les biofilms élaborés à la surface de supports bambous immergés (stations TR, ZB et AV).
Evolution of the relative abundance of major mineral elements in biofilms on immersed bamboo (TR, ZB and AV sites).
Figure 6
Photographies prises au MEB de biofilms colonisant les supports artificiels de bambous échantillonnés dans trois stations (TR, ZB et AV) ) à t = 10 jours, 29 jours (TR, ZB, AV) et 49 jours (ZB et AV).
Biofilms colonizing artificial substrates (bamboos) observed by SEM, sampled from three sites (TR, ZB, AV) at t = 10 days, 29 days for TR, ZB, AV and 49 days for ZB and AV only.
Figure 7
Diagrammes des composantes principales obtenus par ACP représentant les variables (A) et les stations (B) sur des données physicochimiques et algales allant de mars à juin 2007 (une campagne de prélèvements/mois au niveau des trois stations (TR, ZB et AV).
Principal components analysis (PCA) obtained from physicochemical and biological data representing variables (A) and sites (B). Samples were collected once per month at the TR, ZB and AV sites between March and June 2007.
Figure 8
Diagrammes des composantes principales obtenues par ACP représentant les variables (A) et les stations (B) sur des données physicochimiques et algales allant de mars à juillet 2007 (une campagne de prélèvements/mois au niveau des trois stations (TR, ZB et AV).
Principal components analysis (PCA) obtained from physicochemical and biological data representing variables (A) and sites (B). Samples were collected once per month at the TR, ZB and AV sites between March and July 2007.
Liste des tableaux
Tableau 1
Suivis des paramètres physico-chimiques des trois stations de mars à juillet 2007. Les valeurs moyennes sont indiquées dans le tableau (nd : absence de données) CE : CyanobactériesE, DE : DiatoméesE, AE AlguesE (E : Eau, B : biofilm), les données sont exprimées en abondance relative (%) pour les taxons présents respectivement dans les eaux et les biofilms. SiB, FeB et MnB sont exprimés en abondances relatives atomiques par rapport à tous les principaux métaux contenus dans les biofilms.
Physico-chemical parameters obtained from 3 sites from March to July 2007. The average values are indicated in the table (nd in the table means no data available) CE: Cyanobacteria, DE: Diatoma, AE Algae (E: water, B: biofilm). The data are given in relative atomic abundance (%) between taxons within waters and biofilms respectively. SiB, FeB and MnB are given in relative atomic abundance (%) compared among all mineral compounds contained within biofilms.