Résumés
Résumé
Cet article présente une revue bibliographique sur la désinfection des eaux de piscines par le brome, sur les mécanismes de formation et le mode d'action du désinfectant, l'acide hypobromeux. L'examen des principaux sous-produits de bromation (bromamines, trihalométhanes, acides haloacétiques, haloacétonitriles, haloaldéhydes, bromate, nitrosamines, etc.) montre que certains de ces sous-produits sont présents dans l'eau de piscine à des concentrations de quelques µg∙L-1 à quelques dizaines de µg∙L-1. L'étude de leur toxicité aiguë et chronique confirme que ces composés doivent être surveillés (en particulier l'acide dibromoacétique et le bromate) pour assurer la sécurité des nageurs et du personnel technique. D'autre part, l'étude de l'efficacité biocide du brome comparé au chlore, vis-à-vis des bactéries pathogènes présentes dans l'eau de piscine, démontre que les espèces de bactéries Escherichia coli et Enterococcus faecalis sont plus sensibles au brome, à la différence de Pseudomonas aeruginosa qui présente une plus grande résistance. De plus, sur le plan médical, plusieurs cas de dermatites de contact irritantes sont rapportés lors de l'utilisation du brome, même si certaines études révèlent que les bromamines sont non irritantes, inodores et désinfectantes. Cependant, le brome présente une plus grande activité bactéricide que le chlore dans des eaux légèrement alcalines et relativement chaudes et peut être alors une alternative au chlore dans le traitement des piscines atypiques, même s'il demeure beaucoup plus onéreux que le chlore.
Mots-clés :
- Brome,
- désinfection,
- sous-produit,
- activité bactéricide,
- toxicité
Abstract
This paper presents a bibliographical review on the disinfection of swimming pool water with bromine. The formation mechanisms and the mode of action of the disinfectant, hypobromous acid, are discussed. The review of the main bromination by-products (bromamines, trihalomethanes, haloacetic acids, haloacetonitriles, bromate, haloaldehydes, nitrosamines, etc.) shows that some of these by-products are present in pool water at concentrations of a few µg∙L-1 to a few tens of µg∙L-1. The study for acute and chronic toxicity confirms that these compounds should be monitored (especially dibromoacetic acid and bromate) to ensure the safety of swimmers and technical staff. The biocidal effectiveness of bromine versus chlorine, against pathogenic bacteria present in swimming water, is detailed. It has been shown that the bacterial species Escherichia coli, and Enterococcus faecalis are more sensitive to bromine, unlike Pseudomonas aeruginosa that is resistant to bromine. It has also been reported several cases of irritant contact dermatitis when using bromine though some studies have revealed bromamines to be disinfecting, odourless and non-irritating. Nevertheless, bromine exhibits greater bactericidal activity than chlorine in slightly alkaline and warm water and could replace chlorine in the treatment of atypical swimming pools, although chlorine is less costly than bromine.
Keywords:
- Bromine,
- disinfection,
- by-product,
- bactericidal activity,
- toxicity
Corps de l’article
1. Introduction
L'étude bibliographique proposée concerne la désinfection des eaux de piscine par le brome, un oxydant moins utilisé que le chlore, mais qui mérite d'être examiné de plus près compte tenu de sa particularité. Après avoir rappelé les propriétés chimiques et bactéricides de ce biocide, la règlementation en vigueur (française et internationale), un inventaire non exhaustif des sous-produits bromés et azotés a permis ensuite de faire une synthèse des concentrations fréquemment relevées dans les eaux de piscines bromées et de dresser un bilan sur la toxicité de ces dérivés.
2. Les propriétés de l'acide hypobromeux
2.1 Les propriétés chimiques de l’acide hypobromeux en milieux aqueux
De manière classique, l'acide hypobromeux est produit par hydrolyse du dibrome (Br2) liquide dans l'eau (Équation 1, VIDON, 1970) et se dissocie en hypobromite OBr- et ion H+ en fonction du pH et de la température selon l’équation équilibrée (Équation 2, VIDON, 1970) :
Le dibrome est un liquide brun foncé très volatil caractérisé par ses vapeurs corrosives, irritantes et toxiques pour les voies respiratoires (densité de vapeur : 5,5; tension de vapeur : 24 KPa à 20 °C et 55 KPa à 40 °C; constante de Henry H : 0,0293 atm à 20 °C).
L'acide bromhydrique (HBr) formé en milieu aqueux entraine une diminution du pH. Ce paramètre doit cependant être compris entre 7,5 et 8,2 pour éviter la formation de dibrome dans la piscine. En effet, un pH inférieur à 7,5 conduit à un risque d'irritations des usagers et de corrosion des installations d'après l'Organisation mondiale de la santé (OMS, 2000).
L’acide hypobromeux est un acide faible de pKa égal à 8,69 à 25 °C (DORÉ, 1989) et c’est la molécule active dans la désinfection des eaux de piscines par le brome. Son homologue chloré HOCl, biocide connu pour la désinfection des piscines par le chlore, est un acide plus fort de pKa égal à 7,5 à 25 °C (DORÉ, 1989). Cette différence de pKa implique que la forme active HOBr est plus importante que celle d'HOCl, à un pH donné, en particulier à des pH compris entre 7,5 et 8,5 (Figure 1). De plus, d’après MORRIS (1966), les pKa de HOBr et de HOCl diminuent lorsque la température augmente (pKHOCl, 25 °C = 7,54; pKHOCl, 0 °C = 7,82), justifiant ainsi l’emploi du brome pour la désinfection des eaux chaudes et légèrement alcalines.
Figure 1
Distribution des différentes formes de systèmes halogène-eau en fonction du pH (T = 25 °C; [halogénure] = 5 x 10-3 M) : a) système chlore-eau et b) système brome-eau (SOULARD et al., 1983)
Distribution of different forms of halogen-water systems according to pH (T = 25°C; [halide] = 5 x 10-3 M): a) chlorine-water system and b) bromine-water system
De manière naturelle, l’acide hypobromeux est généré lors de la chloration des eaux de mer naturellement riches en bromures (65 mg∙L-1) du fait de la différence de potentiel standard d'oxydoréduction entre les couples HOBr/Br- et HOCl/Cl- (E° HOBr/Br- = 1,33V, E° HOCl/Cl- = 1,49V; DORÉ, 1989) (Équation 3, WESTERHOFF et al., 2004; LAGADEC, 2005) :
En réalité, la présence d’ammonium dans l’eau de mer rend le milieu réactionnel plus complexe. Il faut prendre en compte trois réactions parallèles en compétition : la formation rapide des chloramines : kNH2Cl à 25 °C = 2,9 x 106 M-1∙s-1 >> kNHCl2 à 25 °C = 2,3 x 102 M-1∙s-1 >> kNCl3 à 25 °C = 3,4 M-1∙s-1 (WOLFE et al., 1984), la formation rapide des haloamines mixtes (kNHBrCl à 25 °C = 2,86 x 105 M-1∙s-1) (MORRIS et al., 1981) et des bromamines (voir section 3.1).
Plus industriellement, DERREUMAUX et LAMBERT ont développé, en 1973, un procédé de fabrication de l’acide hypobromeux par réaction équimolaire du bromure de sodium (NaBr) sur l'hypochlorite de sodium (NaOCl) en milieux aqueux selon le schéma réactionnel suivant :
Mais de manière plus originale, l’acide hypobromeux est généré par la réaction d'hydrolyse du bromochloro-5,5-diméthylhydantoïne (BCDMH), biocide décrit dans le brevet européen de GREAT LAKES CHEMICAL CORPORATION (2005) et bien antérieurement par WOJTOWICZ (1993) et VIDON (1970). Ce produit, sous forme de galets, est placé dans un brominateur qui permet d'hydrolyser le BCDMH en libérant en quantité équimolaire les deux biocides HOBr et HOCl :
La concentration du produit d'hydrolyse 5,5-diméthylhydantoïne doit être limitée et ne doit pas dépasser 200 mg∙L-1. Cette contrainte est un inconvénient, car il n'existe pas actuellement de test kit piscine pour doser ce produit; son contrôle est nécessairement réalisé par un laboratoire agréé (OMS, 2006b). Parmi les avantages, il faut souligner que le BCDMH permet de maintenir le pH de l'eau de piscine entre 7,5 et 8,2 sans avoir recours à un correcteur de pH (OMS, 2006b). Quant à l’analyse du brome total en présence de chlore libre, elle est réalisée par la méthode à la diéthyl-p-phénylènediamine (DPD) qui est une extension de la méthode de dosage du chlore libre à la DPD (le chlore libre présent qui interfère, est éliminé par un excès de sulfate d’ammonium) (RODIER et al., 2009).
Concernant la réactivité de l’acide hypobromeux, une étude comparative entre le brome et le chlore a été réalisée sur la matière organique naturelle (NOM) par WESTERHOFF et al. (2004) au travers d’études cinétiques sur des isolats NOM. Leurs travaux ont mis en évidence des réactions de substitution plus efficaces avec le brome qu’avec le chlore. Le brome réagit en moyenne 30 fois plus vite que le chlore. Il a été observé une cinétique de réaction en deux étapes (une phase initiale très rapide et une deuxième phase plus lente de consommation). Pour la phase la plus lente, les valeurs de k pour le brome étaient de 15 à 167 M-1∙s-1 sur une plage de pH de 5 à 11 et de seulement 0,7 à 5 M-1∙s-1 sur la même plage de pH pour le chlore. Les constantes cinétiques dépendent de la nature des isolats, du pH, de la température et de l’oxydant. Ainsi, les constantes ont été déterminées pour les deux isolats SR-RO (Suwannee River Reverse Osmosis) et CRW (Colorado River) :
À pH = 5 et T = 24 °C, kHOBr SR-RO = 130 M-1∙s-1, kHOCl SR-RO = 4,9 M-1∙s-1 ; kHOBr CRW = 31 M-1∙s-1, kHOCl CRW = 1,7 M-1∙s-1.
À pH = 5 et T = 10 °C, kHOBr SR-RO = 120 M-1∙s-1, kHOCl SR-RO = 4,3 M-1∙s-1 ; kHOBr CRW = 27 M-1∙s-1, kHOCl CRW = 1,6 M-1∙s-1.
Antérieurement, WAJON et MORRIS (1980) ont démontré la réactivité du brome vis-à-vis de composés organiques azotés présents dans l’eau tels que la diméthylamine et la glycine et l’ont comparée avec celle du chlore. Il a été constaté une meilleure réactivité dans le cas du brome d’après les constantes cinétiques établies à pH = 7 et T = 20 °C, k = 6 x 104 et 4,6 x 105 M-1∙s-1 respectivement pour les dérivés bromés N-bromodiméthylamine et N-bromoglycine; k = 4,3 x 104 et 1,7 x 105 M-1∙s-1 respectivement pour les dérivés chlorés N-chlorodiméthylamine et N-chloroglycine.
Dans le cas des piscines découvertes, les rayonnements UV peuvent être absorbés par de nombreuses molécules apportées par les baigneurs et par les traitements chlorés et bromés. L’action des UV à 253,7 nm, sur le chlore libre (HOCl, OCl-), a bien été étudiée par FENG et al. (2007). Ainsi, la photolyse du chlore libre en milieu dilué est mise en évidence par la détermination des rendements quantiques (1 ± 0,1 pour HOCl et 0,9 ± 0,1 pour OCl-). Cette photolyse conduit à la formation d’acide chlorique HClO3 selon le mécanisme classique des réactions radicalaires :
Le radical hydroxyle HO• peut également réagir sur des structures de type RH conduisant à des composés organochlorés de structure RCl, précurseurs des trihalométhanes chlorés. En présence d’HOBr, il se produit rapidement la réaction radicalaire avec HO• (k = 2 x 109 M-1∙s-1 (SAVARY et al., 2000) pour former le radical BrO• puis enfin l’acide bromique HBrO3 stable dans l’eau. Quant au brome moléculaire Br2, l’énergie de liaison ΔHBr2 de 193 kJ∙mol-1 plus faible que celle du chlore (243 kJ∙mol-1) rend tout à fait possible la photolyse de Br2 avec production de radicaux Br•. Des études de photodissociation du brome moléculaire à 355 nm, piégé dans le parahydrogène solide (pH2), ont permis de déterminer un rendement quantique de 0,29 (KETTWICH et al., 2008). Ainsi, les radicaux Br• générés réagissent sur les composés organiques de structure RH pour former des composés organobromés, précurseurs des trihalométhanes (voir section 3.2).
En conséquence, l’acide hypobromeux sensible aux UV conviendra de préférence pour la désinfection des piscines intérieures à l’abri des UV de type piscine thermale, bains à remous, etc.
2.2 Les propriétés bactéricides de l’acide hypobromeux
Grâce à son pouvoir oxydant puissant, l'acide hypobromeux issu de l'hydrolyse du dibrome réagit sur la microflore en détruisant l'ADN des microorganismes et en générant des ions bromures. Il en est de même pour l'acide hypobromeux provenant de l'hydrolyse du BCDMH, mais dans ce cas, l'acide hypochloreux, également présent dans le milieu réactionnel, oxyde ces bromures en régénérant l'acide hypobromeux (Équation 3), une particularité très intéressante du BCDMH.
L'activité bactéricide d'un biocide varie selon sa nature, le pH, la température et les espèces bactériennes présentes dans le milieu aqueux. En ce qui concerne le brome, il est connu pour ses propriétés bactéricides et pour être en particulier plus efficace que le chlore dans le cas des eaux chaudes et légèrement alcalines, comme en témoignent les travaux de JOHANNESSON (1960), de BROWN et al. (1963, 1964), de VIDON (1970) et de FLAHAUT (1977). Cependant, FLAHAUT (1977) rapporte que le brome est intéressant pour son activité bactéricide, mais qu’il l'est beaucoup moins pour son coût.
Par ailleurs, VIDON (1970) a mis au point une méthode comparative des deux biocides vis-à-vis d'espèces pathogènes et a démontré que le chlore est plus actif que le brome vis-à-vis d'Escherichia coli dans l'eau distillée pure ou dans l'eau contaminée par l'urine à pH = 6. Mais il prouve aussi son contraire vis-à-vis d'E. coli, de Staphylococcus aureus et d'Enterococcus faecalis pour un pH = 7,4. Par la suite, l'auteur a souligné clairement les avantages de l'utilisation du brome dans la désinfection de l'eau de piscine en soulevant toutefois le problème de son innocuité sur les muqueuses et en particulier la conjonctive.
Concernant particulièrement l'espèce Pseudomonas aeruginosa, une étude comparative de l'activité du chlore (sous forme d’acide trichloroisocyanurique ou ATIC) et du brome (sous forme bromochloro-5,5-diméthylhydantoïne ou BCDMH), menée par SHAW (1984), a montré que cette bactérie pathogène, détectée dans un bassin de type spa, présentait une résistance au brome. Ces résultats sont confirmés par l'étude de PRICE et AHEARN en 1988.
Dans une autre étude réalisée par OH et al. (2007), il a été démontré par la détermination du temps de contact (Ct) que l'efficacité bactéricide du BCDMH est moins bonne que celle de l’ATIC vis-à-vis de l'espèce bactérienne E. coli et dans des conditions expérimentales de pH et de température fixées (pH = 5, T = 25 °C). Une élimination bactérienne de 99 % (108 UFC∙mL-1) est obtenue après 60 s de temps de contact avec 8 ppm de désinfectant ATIC soit un Ct de 8 mg∙min∙L-1. Dans les mêmes conditions expérimentales, le même résultat est obtenu qu’après 114 s de temps de contact avec 8 ppm de désinfectant BCDMH soit un plus grand Ct égal à 15,2 mg∙min∙L-1. Les auteurs précisent, par ailleurs, que la résistance des espèces E. coli,P. aeruginosa, E. faecalis, Bacillus cereus, Legionella pneumophila et S. aureus suit respectivement un ordre croissant (66, 368, 372, 506, 812 et 909 s) dans le cas du désinfectant ATIC et dans des conditions expérimentales identiques.
Par contre, LAGIERE et al. (2009) démontrent une meilleure efficacité du BCDMH vis-à-vis de l’espèce P. aeruginosa dans une étude comparative du BCDMH et de NaOCl avec des conditions différentes (mise en contact d’une suspension aqueuse de 106 UFC∙mL-1 avec 1 ppm de brome total à pH = 7,8 et T = 35°C). Une élimination bactérienne de 99,99 % est obtenue après 90 s avec BCDMH soit un Ct de 1,5 mg∙min∙L-1 et le même résultat n’est obtenu qu’après 120 s avec NaOCl soit un plus grand Ct égal à 2 mg∙min∙L-1. D’autre part, les auteurs observent, dans le cas du BCDMH et dans des conditions expérimentales identiques aux précédentes, que la résistance des espèces E. coli, P. aeruginosa et E. faecalis suit respectivement un ordre décroissant (120, 90 et 30 s).
Antérieurement, les travaux de KOSKI et al. (1966) ont permis de mettre en évidence l’efficacité du chlore gazeux par rapport au brome liquide sur l’espèce bactérienne E. faecalis. Ils obtiennent 99,99% d’élimination bactérienne (106 UFC∙mL-1) après 120 s de mise en contact avec 1,05 ppm de brome liquide, à pH = 6,1, soit un Ct de 2,1 mg∙min∙L-1. Dans d’autres conditions expérimentales, ils obtiennent 99,99 % d’élimination bactérienne après 180 s de mise en contact avec 0,46 ppm de chlore gazeux, à pH = 5,4, soit un plus petit Ct égal à 1,38 mg∙min∙L-1. Ils font le même constat pour l’espèce bactérienne E. coli (1,25 x 106 UFC∙mL-1) dans des conditions expérimentales légèrement différentes. Après une mise en contact de 60 s avec 0,560 ppm de brome liquide, à pH = 6,5, ils obtiennent 99,99 % d’élimination bactérienne soit un Ct de 0,56 mg∙min∙L-1 et ils obtiennent ce même résultat après une mise en contact de 30 s avec 0,301 ppm de chlore gazeux, à pH = 5,8, soit un plus petit Ct égal à 0,15 mg∙min∙L-1.
En résumé, l'ensemble de ces résultats tend à remettre en question l'efficacité du brome dans la désinfection de piscines et de spas même avec de fortes teneurs en brome. De plus, sur le plan médical, plusieurs études ont révélé de nombreux cas de dermatites de contact irritantes et d'éruptions cutanées chez des patients utilisant des bains à remous désinfectés au brome, sous forme BCDMH (teneur élevée en brome total ≤ 5 mg∙L-1). Ces données confortent le fait que la désinfection au brome semble controversée (MORGAN, 1983; GOULD, 1983; RYCROFT et PENNY, 1983; PENNY, 1991; LOUGHNEY et HARRISON, 1998; DALMAU et al., 2012).
3. Les sous-produits bromés et azotés de désinfection
Les sous-produits bromés sont formés dans les eaux de piscines désinfectées au brome, les eaux douces riches en bromures (>100 µg∙L-1) et les eaux de mer naturellement bromurées désinfectées au chlore. Une étude bibliographique très récente de TEO et al. (2015) révèle l'extrême complexité du milieu oxydant aqueux tel qu'une piscine. Cette étude précise l'existence d'un grand nombre de sous-produits de désinfection dont la concentration dans l'eau varie avec la température, le pH, le type de piscine et de désinfectant, les dosages utilisés, etc. En plus, la présence de produits cosmétiques contenant des parabènes réactifs au chlore ou au brome complique sensiblement ce milieu oxydant aqueux. La matière organique présente dans l'eau est oxydée par l'acide hypobromeux en de multiples sous-produits dont les plus importants sont rassemblés au tableau 1.
Tableau 1
Principaux sous-produits bromés et azotés retrouvés dans les piscines
Main brominated and nitrogen by-products found in swimming pools
3.1 Les bromamines
Les bromamines inorganiques et organiques proviennent de la réaction entre HOBr et la pollution organique azotée apportée par les baigneurs. La formation de la monobromamine se fait par réaction entre HOBr et NH3 (en équilibre avec les ions ammonium NH4+ naturellement présents dans l'eau). Les bromamines sont relativement instables d'après une étude cinétique réalisée en solution aqueuse par LEI et al. (2004). Par ailleurs, LAGIERE et al. (2009) ont mis en évidence leur instabilité relative au travers de la courbe de breakpoint construite à T = 35 °C dans une étude sur la demande en brome vis-à-vis de l’eau minérale naturelle de Dax possédant 0,37 mg∙L-1 d’ions ammonium (Figure 2). Alors que le chlore crée facilement des chloramines stables et nuisibles (en particulier la trichloramine volatile, irritante pour les yeux et les poumons), les bromamines ont l'avantage de se décomposer rapidement sans provoquer d'irritations (MASSIN et al., 1998; BERNARD et al., 2003; LEI et al., 2004; DE LAAT et al., 2009). De même, WORLEY et WOJTOWICZ font la même observation en 2004 à propos des bromamines inorganiques et organiques. JOHANNESSON observait déjà en 1960 que le pouvoir bactéricide de la monobromamine (NH2Br) équivaut à celui de HOBr. Il est à noter que la monobromamine NH2Br se forme rapidement à pH 7 (k = 7,5 x 107 M-1∙s-1 à 25 °C), (WOJTOWICZ, 1993; WAJON et MORRIS, 1980) selon la réaction équilibrée (Équation 7), Keq à 20 °C = 3,0 x 1010; ΔGf° NH2Br = 77,1 kJ∙mol-1 (HOFFMAN et ANDREWS, 2001) :
Figure 2
Évolution du brome total dans l’eau minérale naturelle de Dax en fonction du brome ajouté (LAGIERE et al., 2009). 0 à B : formation des bromamines minérales; B à C : destruction des bromamines minérales; C à D : formation du brome libre
Evolution of the total bromine in Dax natural mineral water as a function of the added bromine. 0 to B: formation of mineral bromamines; B to C: destruction of mineral bromamines; C to D: formation of free bromine
La monobromamine se transforme progressivement en dibromamine NHBr2 (k = 7,0 x 105 M-1∙s-1 à 25 °C, WOJTOWICZ, 1993) selon la réaction équilibrée (Équation 8) dépendant du pH : Keq à 20 °C = 4,7 x 108; ΔGf° NHBr2 = 181 kJ∙mol-1 (HOFFMAN et ANDREWS, 2001).
Toujours en présence d’HOBr, la dibromamine continue à réagir pour former la tribromamine NBr3 prédominante à un pH inférieur à quatre selon la réaction équilibrée (Équation 9) : Keq à 20 °C = 5,3 x 106; ΔGf° NBr3 = 296 kJ∙mol-1 (HOFFMAN et ANDREWS, 2001).
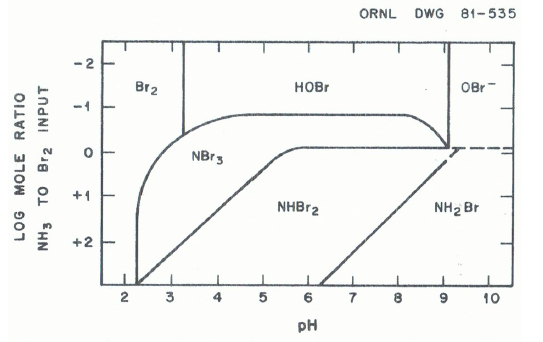
JOHNSON et OVERBY (1971) ont déterminé un diagramme de prédominance des trois bromamines en fonction du pH et du rapport N/Br (Figure 3). Ainsi, dans la plage de pH neutre, la dibromamine se forme dans des solutions avec des rapports N/Br supérieurs à 2/3 tandis que la tribromamine se forme dans des solutions avec des rapports N/Br inférieurs à 2/3. Ces auteurs attribuent aux bromamines un pouvoir biocide équivalent à celui du brome et une grande instabilité : les durées de demi-vie calculées sont inférieures à 5 et 95 min respectivement pour la tribromamine et la dibromamine.
Figure 3
Diagramme de prédominance des principales espèces de brome et bromamines en fonction du pH et du rapport N/Br (JOHNSON et OVERBY, 1971)
Main species of bromine and bromamine predominating at various pH and ratio N/Br
De plus, cette instabilité est confirmée sur le plan thermodynamique par les valeurs largement positives des énergies libres de formation ΔGf° de ces bromamines (HOFFMAN et ANDREWS, 2001). D’autre part, DORÉ (1989) fait ce même constat et confère aux dibromamines des propriétés désinfectantes similaires à celles du brome.
3.2 Les trihalométhanes, les acides haloacétiques et les haloacétonitriles
D'autres sous-produits bromés comme les trihalométhanes (THM) de structures CH3X, CH2X2 et CHX3, les acides haloacétiques (AHA) de structures CH2XCO2H, CHX2CO2H et CX3CO2H et les haloacétonitriles (HAN) de structures CH2XCN, CHX2CN et CX3CN (avec X = Cl, Br) sont présents dans les piscines chlorées et bromées, mais aussi dans les piscines d’eau de mer. Il est à préciser que ces sous-produits sont beaucoup plus stables que les bromamines.
3.2.1 Les THM bromés
Les THM bromés sont générés dans toutes les piscines, mais de manière importante dans les piscines traitées au brome et les piscines d’eau de mer. Pour ces deux types d’eau, il est constaté que le bromoforme (TBM) reste très majoritaire par rapport au chloroforme (TCM) dont la valeur maximum se situe autour de 14 µg∙L-1. Les données sur les sous-produits bromés de quelques piscines bromées et d’eaux de mer montrent une valeur en TBM maximum de 3 600 µg∙L-1 dans une eau bromée qui chute à 930 µg∙L-1 dans l’eau de mer (Tableau 2) (PARINET et al., 2011; LOURENCETTI et al, 2012; BENOIT et JACKSON, 1987; RICHARDSON et al., 2010; CHAMBON et al., 1983; NORIN et RENBERG, 1980). JUDD et JEFFREY (1995) ont fait aussi ce constat et montrent également que l’utilisation du brome augmente de 74 % la production de THM bromés, avec le bromoforme comme sous-produit principal. L’influence du brome sur la formation des THM bromés est donc très importante. Néanmoins les teneurs trouvées pour le TCM, le DCBM et le DBCM dans les piscines traitées au BCDMH ne sont pas négligeables (Tableau 2) et indiquent que l’acide hypochloreux est bien présent et acteur dans la formation des THM.
Tableau 2
Concentrations moyennes des principaux sous-produits bromés dans les piscines
Average concentrations of major brominated by-products in swimming pools
Les composés précurseurs des THM sont des cétones (méthylcétones, β-dicétones), des polyphénols, des acides humiques de structure aromatique type résorcinol, etc. Ces produits se trouvent dans tout type d’eau. Au contact de l’halogène X (brome ou chlore), il se produit la réaction haloforme illustrée dans le cas des méthylcétones (Figure 4) (DORÉ et al., 1979; DORÉ et GOICHON 1980; ROOK, 1974). Le mécanisme réactionnel se décompose en plusieurs phases : formation lente d’énol dépendant du pH (catalysée plus efficacement par OH-), halogénation rapide de la forme énol puis halogénations successives rapides avec attaque de l’halogène sur le même carbone conduisant finalement à la formation des THM. L’étape de formation de l’énol ainsi que sa stabilité conditionnent la vitesse et le rendement de la formation des THM. Il est à noter qu’après la première halogénation, les suivantes possèdent une cinétique plus rapide conduisant à des compétitions entre plusieurs halogènes et spécifiquement avec le brome (en cas de présence de bromures). La vitesse de la réaction haloforme est indépendante de la nature de l’halogène ainsi que de sa concentration, mais le caractère plus nucléophile du brome génère les formes bromées des THM avec des rendements molaires plus importants que dans le cas des THM chlorés.
Figure 4
Mécanisme réactionnel de la réaction haloforme (DORÉ et al., 1979; DORÉ et GOICHON, 1980; ROOK, 1974)
Reaction mechanism of the haloform reaction
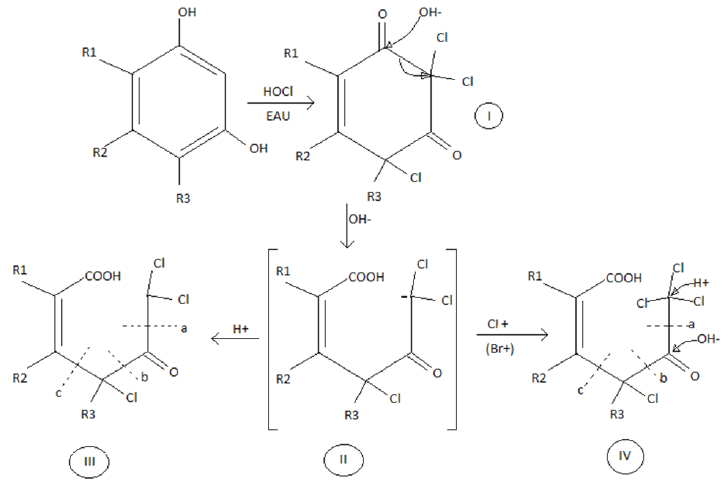
Concernant les substances humiques très réactives avec les halogènes (réactions d’addition, de substitution et d’oxydation possibles), il se produit des THM ainsi que des halocétones et des AHA dont les phases sont précisées dans le mécanisme réactionnel décrit dans la Figure 5, à partir du composé phénolique de type résorcinol à titre d’exemple (ROOK, 1974).
Figure 5
Mécanisme réactionnel de la chloration d’un composé phénolique type résorcinol (ROOK, 1974). Composé I : chloration rapide de l’atome de carbone en ortho, activé par une substitution hydroxyle; composé II : forme intermédiaire; composé III : forme intermédiaire protonée; composé IV : forme intermédiaire rapidement halogénée. Les composés III et IV sont ensuite clivés au niveau des repères a, b et c pour donner différents sous-produits : les THM (clivage a du composé IV), les AHA (clivage b), les halocétones (clivage c)
Reaction mechanism of the chlorination of a phenolic compound resorcinol type. Compound I: rapid chlorination of the carbon atom in ortho, activated by a hydroxyl substitution; compound II: intermediate form; compound III: protonated intermediate form; compound IV: rapidly halogenated intermediate form. Compounds III and IV are then cleaved at marks a, b and c to give various by-products: THM (cleavage a of compound IV), AHA (cleavage b), haloketones (cleavage c)
3.2.2 Les AHA bromés
Les AHA bromés sont des composés non volatils, polaires et solubles dans l’eau. Leur temps de séjour passé dans l’eau peut être important du fait de leur stabilité et ils s'accumulent dans les bassins. PARINET et al. (2011) ont mis en évidence leur formation et spécifiquement un AHA bromé majoritaire : l’acide dibromoacétique (ADBA) dans le cas des eaux de mer (Tableau 2) dont la valeur maximum se situe autour de 1 100 μg∙L-1. D’autre part, l’ANSES (2013) rapporte les résultats d’une étude menée sur des eaux de mer confirmant bien que l’ADBA est majoritaire (teneur médiane en μg∙L-1 : ADBA (147) > ATBA (98) > AMBA (27). La production de ces sous-produits est liée à la concentration en chlore dans l'eau et à la présence de composés azotés (LAKIND et al., 2010; RICHARDSON et al., 2010; KANAN et KARANFIL, 2011).
3.2.3 Les HAN bromés
Les HAN bromés sont générés à des températures relativement élevées par chloration des eaux de mer riches en bromures et composés azotés (UENO et al., 1996; PETERS et al., 1990). La production des HAN serait directement reliée à la teneur en azote (urée, ammonium, créatine, acides aminés) apporté par les baigneurs (OMS, 2006b; LI et BLATCHLEY, 2007; WEAVER et al., 2009) et par les substances humiques présentes dans les eaux naturelles (RECKHOW et al., 1990). Les HAN sont des substances lipophiles, faiblement volatiles. Ils subissent une dégradation à pH neutre et catalysée à pH basique. En présence de chlore libre, cette dégradation est encore plus rapide. L’hydrolyse à pH alcalin conduit à la formation des haloacétamides puis des AHA comme sous-produits ultimes (KRASNER et al., 2006).
La formation de bromoacétonitrile a été mise en évidence lors de la chloration de l’eau de mer dans plusieurs études (ALLONIER et al., 1999; JENNER et al., 1997). Le dibromoacétonitrile et le bromoacétonitrile sont les deux HAN majoritaires (10 % des sous-produits trouvés en piscine), à des concentrations comprises entre 0,3 et 3,4 µg∙L-1 avec des eaux chlorées allant jusqu’à 6 mg∙L-1 (KRISTIANSEN et al., 1994; AGUS et SEDLAK, 2010). Par ailleurs, l’OMS (2006b) cite les travaux de BAUDISCH et al. (1997) sur les eaux de mer indiquant une valeur moyenne de 49 µg∙L-1 trouvée pour le dibromoacétonitrile.
3.3 Les HAD bromés
Les haloaldéhydes (HAD) de structures CX3CH(OH)2, CHX2CH(OH)2 et CH2XCH(OH)2 (avec X = Cl, Br) sont les troisièmes représentants des sous-produits de désinfection les plus fréquemment rencontrés dans les eaux de piscines, après les AHA et les THM (OMS, 2006b; DE LAAT et al., 2009). Ils représentent entre 15 % et 20 % des composés organohalogénés adsorbables (AOX) dans les eaux de piscine (BRUNET et al., 2010). Selon une étude française (ANSES, 2010), l'hydrate de chloral (ou trichloroacétaldéhyde) est le principal haloaldéhyde trouvé à des concentrations élevées dans les piscines. Mais en ce qui concerne l'homologue bromé, l'hydrate de bromal, il existe peu de données bibliographiques. Néanmoins, une étude a montré la présence d’hydrate de bromal dans un bassin de natation alimenté par de l’eau de mer (230 μg∙L-1) (BAUDISCH et al., 1997).
3.4 Le bromate
Quant au bromate (BrO3-), HAAG (1981) a montré que sa formation se produisait en présence de lumière et lors de la chloration d’eau de mer suivant un rapport Cl2/Br- > 1. La présence des deux ions ClO- et BrO- et un pH élevé favorisent sa formation. HUANG et al. (2008) décrivent la réaction à pH élevé de l’acide hypochloreux sur l’acide hypobromeux (lui-même généré par l’oxydation des bromures présents dans l’eau de mer) selon l’équation 10 :
Cependant, ces acides réagissent aussi avec la matière organique présente dans l’eau, ces réactions compétitives limitent alors la formation de bromate.
D’autre part, il est rapporté par l’ANSES (2010) que l’ion bromate soluble dans l’eau est difficilement éliminé par les procédés de traitement d’eau et que sa présence dans les eaux de piscine viendrait de l’utilisation d’hypochlorite de sodium de mauvaise qualité. L’ANSES cite l’exemple d’une eau traitée par 2 mg∙L-1 de chlore (à partir d’une solution d’hypochlorite de sodium concentrée à 700 mg∙L-1 et contenant entre 100 et 120 µg∙L-1 de bromate) qui a conduit à l’apport de 10 µg∙L-1 en bromate. Cette concentration correspond exactement à la valeur guide établie par l’OMS et qui est également la limite de qualité autorisée pour l’eau destinée à la consommation humaine (OMS, 2006a).
3.5 La NDMA
La N-nitrosodiméthylamine (NDMA) est un sous-produit azoté non bromé susceptible d’être présent dans les eaux de piscines. Cette nitrosamine peut être formée en deux étapes :
par réaction de la dichloramine sur la diméthylamine présente dans l'urine et la sueur selon l’équation 11 :
puis par oxydation de l’intermédiaire 1,1- diméthylhydrazine asymétrique (UDMH-Cl) avec l’oxygène dissous dans l’eau pour former la NDMA selon l’équation 12 :
LUO et CLEVENGER (2005) ont montré que les ions bromures présents dans l'eau de piscine accélèrent la formation de la NDMA. En effet, lors de la chloration de l’eau et en présence de bromures, il se forme du brome qui réagit sur la monochloramine présente pour générer rapidement de la bromochloramine qui sera en compétition avec la dichloramine bien plus lente à se former (kNHCl2 à 25 °C = 2,3 x 102 M-1∙s-1; kNHBrCl à 25 °C = 2,86 x 105 M-1∙s-1). La NDMA peut aussi se former par nitrosation de la diméthylamine (SCHREIBER et MITCH, 2006; WALSE et MITCH, 2008). Cependant, la NDMA n’a pas été mise en évidence dans l'eau de mer.
4. Toxicité des sous-produits bromés et azotés prépondérants
La présence des sous-produits bromés peut conduire à un risque pour la santé des baigneurs et du personnel technique. En effet, de nombreuses études montrent que les composés bromés sont plus toxiques pour la santé que leurs homologues chlorés (HSU et al., 2001; ERDINGER et al., 2004; LEE et al., 2009), du fait d'un caractère génotoxique et mutagène plus important (KOGEVINAS et al., 2010). La toxicité des principaux sous-produits bromés et azotés présents dans l'eau de piscine a été abordée et concerne plus particulièrement les THM, les AHA, les HAN et les HAD bromés (Tableau 3). La toxicité des bromamines n'est pas rapportée en raison de leur instabilité importante.
Tableau 3
Recommandations pour quelques sous- produits trouvés dans les piscines
Recommendations for some by-products found in swimming pools
4.1 Toxicité des THM
La mutagénicité des THM peut être classée par ordre décroissant : TBM = DBCM > BDCM (PEGRAM et al., 1997). De plus, les THM bromés semblent être plus cancérigènes que leurs homologues chlorés (CANTOR et al., 2010).
Une étude toxicologique a été réalisée par BOWMAN et al. (1978) sur le bromoforme (TBM) administré par voie orale (en solution aqueuse) à des souris mâles et femelles; la DL50 (dose létale médiane) a été évaluée respectivement à 1 400 et 1 550 mg∙kg-1 de poids corporel. Dans une deuxième étude réalisée par CHU et al. (1980) sur des rats mâles et femelles ayant ingéré du bromoforme mélangé à de l'huile de maïs, la DL50 a été évaluée respectivement à 1 388 et 1 147 mg∙kg-1 de poids corporel. Selon le mode d'administration, l'Agence américaine de protection de l’environnement (US EPA) a fixé en 1987, pour le bromoforme, une valeur toxicologique de référence (VTR) de 7,9 x 10-3 mg∙kg-1∙j-1 par voie orale et de 0,001 ng∙m-3 pour la voie respiratoire. En 1994, Santé Canada a classé le bromoforme dans le groupe III D des substances potentiellement cancérigènes pour l'homme. D'autre part, l’US EPA a classé ce sous-produit comme cancérigène probable pour l’homme (RICHARDSON et al., 2007; US EPA, 1999).
Concernant la cancérogénicité du DBCM, en l'absence de données sur l'animal et sur l'homme, ce sous-produit a été également classé dans le groupe III D des substances potentiellement cancérogènes pour l'homme (SANTÉ CANADA, 1994). L'US EPA a fixé une VTR de 0,02 mg∙kg-1∙j-1 par voie orale.
Des études menées par PEGRAM et al. (1997) sur la génotoxicité du BDCM ont prouvé qu'il est faiblement mutagène. Les études de cancérogénicité menées par le National Toxicology Program (NTP) en 1987 ont montré que le BDCM, mélangé à de l'huile de maïs et administré à des rats et des souris sur une durée de 102 semaines, provoque une augmentation des adénomes et des adénocarcinomes au niveau des reins ainsi qu'une augmentation des tumeurs de l'intestin. D'autre part, les études épidémiologiques de CRAGLE et al. (1985) et HILDESHEIM et al. (1998) ont révélé un lien entre les THM et le cancer colorectal humain. Compte tenu de ces données suffisantes sur l'animal, mais insuffisantes sur l'homme, le BDCM a été classé un peu plus tard dans le groupe II des substances probablement cancérogènes pour l'homme (SANTÉ CANADA, 1994).
4.2 Toxicité des AHA bromés
Les acides bromoacétiques sont moins étudiés que leurs homologues chlorés sur le plan de la cancérogénicité et de la mutagénicité.
LINDER et al. (1994) ont montré, que l'acide monobromoacétique (AMBA) présente une toxicité aiguë par voie orale. D’autres études ont montré par le test d’Ames que cet acide serait plus mutagène que l'acide dibromoacétique (KARGALIOGLU et al., 2002). Aucune étude sur la mutagénicité, la génotoxicité, la toxicité chronique ou la cancérogénicité de l'acide monobromoacétique n'a été validée. Par conséquent, SANTÉ CANADA (1994) a classé cet acide dans le groupe IV des substances inclassables quant à sa cancérogénicité pour l'homme. Par ailleurs, l'US EPA (2005) a également classé les données sur l'acide monobromoacétique comme « inadéquates pour l'évaluation du potentiel cancérogène pour l'homme » et n'a pas fixé de VTR.
Concernant l'acide dibromoacétique (ADBA), des études ont montré qu'il est cancérigène et mutagène chez le rat et le hamster (PLEWA et al., 2002; MELNICK et al., 2007). Une étude toxicologique réalisée par MELNICK, en 2007, par voie orale (acide dilué dans l'eau potable et administré à des souris et des rats), a démontré un effet cancérigène de ce composé. Les tumeurs ont augmenté dans le foie et les poumons des souris, dans la cavité abdominale des rats mâles et dans le système hématopoïétique des rats femelles. Dès 1994, Santé Canada classe l'acide dibromoacétique dans le groupe II des substances probablement cancérogènes pour l'homme et, en 2008, il fixe une VTR de 4,26 ng∙kg-1∙j-1 par voie orale. Une étude récente sur des cellules mammaliennes a comparé la cytotoxicité chronique de six acides haloacétiques et a classé ces composés par ordre de cytotoxicité décroissante : AMBA > ATBA > ADBCA > ADBA > ABDCA > ABCA (PLEWA et al., 2002). De même, la cytotoxicité de ces sous-produits a été comparée cette fois sur des cellules ovariennes de hamster chinois, donnant par ordre décroissant AMBA > ADBA > ATBA > ABCA > ADBCA (PLEWA et al., 2011).
4.3 Toxicité des HAN bromés
Les dérivés bromés et chlorés contenant de l’azote (HAN) seraient beaucoup plus nocifs pour la santé que ceux n’en contenant pas (WEAVER et al., 2009).
Le BCAN pourrait être mutagène (OMS, 2011), mais il n'a pas été classé cancérigène pour l'homme par l'Agence internationale de la recherche sur le cancer (IARC).
Par contre, une étude réalisée par DANIEL et al. (1986) sur le DBAN a montré que ce sous-produit est potentiellement cancérigène et mutagène. BULL et al. (1985) a également montré l'apparition de tumeurs chez les souris. Néanmoins, le DBAN n'a pas été classé comme cancérigène pour l’Homme selon l’IARC (OMS, 2011). À ce jour, il n'existe pas de VTR pour le DBAN.
4.4 Toxicité des HAD bromés
Concernant l'hydrate de chloral (HAD), il est connu pour ses effets sédatifs et hypnotiques. L'ANSES (2011) a fixé une VTR de 28 μg∙kg-1∙j-1 par voie orale pour ses effets hépatotoxiques et génotoxiques.
Par analogie, son homologue bromé, l'hydrate de bromal (Br3CCH(OH)2) possède également des propriétés hypnotiques et sédatives. Cependant, sa grande solubilité dans l’eau minimise le risque de contamination par voie respiratoire (KARCHER et DEVILLERS, 1990). Les données toxicologiques de ce sous-produit ne sont pas récentes, mais il est connu pour être plus toxique que l'hydrate de chloral (FLAHAUT, 1977; BUTLER, 1948). Une étude toxicologique de l'hydrate de bromal sur des rats a permis de fixer la DL50 à 40 mg∙kg-1 par voie orale et à 30 mg∙kg-1 par voie intraveineuse (LEHMAN et KNOFFEL, 1938). Des doses plus faibles peuvent causer une dyspnée. L'OMS (1970) a classé ce composé dans le groupe C des substances constituant un risque faible, mais non négligeable pour la santé publique.
4.5 Toxicité du bromate
Quant au bromate (BrO3-), des tests effectués sur des rats de hamster et des souris, après ingestion par voie orale, ont montré qu'il est cancérigène (KUROKAWA et al., 1990; DE ANGELO et al., 1998; WOLF et al., 1998). De plus, des tests in vitro et in vivo ont prouvé que le bromate est mutagène (SPEIT et al., 1999; HARRINGTON-BROCK et al., 2003). Plus tard, BALLMAIER et EPE (2006) ont démontré sur des cellules de mammifères qu’il est beaucoup moins cytotoxique que l’ion hypochlorite. En 2010, l'US EPA a fixé une VTR de 0,7 mg∙kg-1∙j-1 dans le cas d'ingestion par voie orale (US EPA, 2010).
4.6 Toxicité de la NDMA
Enfin, l'US EPA a classé la NDMA comme substance probablement cancérogène pour l'homme, avec un risque de 10-6 pour une concentration en NDMA égale à 0,7 ng∙L-1 dans l'eau potable (US EPA, 1987). Suite à l'étude récente réalisée par WAGNER et al. (2012) sur les espèces de Salmonella typhimurium et sur les cellules ovariennes de hamsters chinois, la NDMA a été classée comme mutagène et génotoxique. Une autre étude toxicologique plus ancienne réalisée par AUBERT et al. (1981), sur des moules, a montré que ce sous-produit azoté détruit les cellules de ces mollusques. La dose journalière admissible est de 4 à 9,3 mg∙kg-1∙j-1 d'après les travaux de FITZGERALD et ROBINSON en 2007. Enfin, l'US EPA a fixé une VTR, en 2010, de 51 mg∙kg-1∙j-1 par voie orale (US EPA, 2010).
5. Recommandations et réglementation
La toxicité révélée des sous-produits bromés, les plus fréquemment trouvés dans les piscines, a conduit les organismes internationaux, comme l'OMS et l'US EPA à préconiser des recommandations sanitaires, afin de garantir la sécurité sanitaire des baigneurs et du personnel technique (Tableau 4). Actuellement, il existe plusieurs textes règlementaires sur l'utilisation de brome dans la désinfection des piscines, au niveau européen et international.
Tableau 4
Données toxicologiques des sous-produits bromés et azotés
Toxicological data for brominated and nitrogenous by-products
En Europe, conformément à la directive 98/8/CE du Parlement européen et du Conseil du 16 février 1998 (dite directive sur les produits biocides), l'utilisation de brome liquide pour la désinfection des piscines publiques ou privées est interdite depuis 2006 (MINISTÈRE DE LA TRANSITION ÉCOLOGIQUE ET SOLIDAIRE, 2017).
En France, l'utilisation du bromure de sodium requiert l'autorisation de la Délégation générale de la Santé (DGS) après avis de l'Agence Nationale de Sécurité sanitaire, de l'Alimentation, de l'Environnement et du Travail (ANSES). En ce qui concerne l'utilisation de BCDMH, une même autorisation est également appliquée. Néanmoins, ce biocide est approuvé dans certains pays de l'Union européenne, comme l'Espagne.
Au niveau international, les halohydantoïnes (y compris le BCDMH) ont été évaluées pour le traitement des piscines privées et des bains à remous par les États-Unis, membre de l'Organisation de coopération et de développement économique (OCDE). L'US EPA a publié les résultats de cette analyse dans une décision d'admissibilité d'inscription en 2007, concluant que le BCDMH ne produit pas d'effets nocifs inacceptables sur la santé humaine ou l'environnement. Le Canada, également membre de l'OCDE, a réévalué le BCDMH sur la base des conclusions de l'US EPA. L'Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada a publié le 06/10/2011 un document référencé RVD2011-08, indiquant la décision de réévaluer l'approbation du BCDMH pour un usage domestique (ARLA, 2011). Ce biocide est également approuvé pour le même usage en Australie. Au Québec, le BCDMH est autorisé par le décret D. 1087 du 29/11/2006, qui réglemente la qualité de l'eau pour les piscines et autres bassins artificiels accessibles au public. La loi sur la qualité de l'environnement (chapitre Q-2, articles 46, 87, 109.1 et 124.1) spécifie, en particulier, la teneur en brome total à observer dans le cas d'une désinfection au brome (de 2 à 5 mg∙L-1) pour une eau ne dépassant pas 35 °C; la valeur de brome doit être comprise entre 3 à 5 mg∙L-1 si la température dépasse 35 °C.
6. Discussion et conclusion
Cette étude bibliographique a mis en évidence les avantages et les inconvénients de l'utilisation du brome dans la désinfection des eaux de piscines. Quel que soit le dérivé bromé utilisé (brome liquide, NaBr/NaOCl, BCDMH), la substance active en jeu est l'acide hypobromeux, qui a des propriétés oxydantes et désinfectantes comparables à celles de l'acide hypochloreux. Parmi les sous-produits bromés générés par l'oxydation de la matière organique azotée introduite par les baigneurs, il est rapporté que les bromamines sont inodores, instables, non irritantes et désinfectantes à l’inverse des chloramines, stables, nocives malodorantes et très irritantes. De ce fait, l’absence de formation de chloramines lors du traitement par le brome améliore sensiblement le confort des baigneurs.
Du point de vue microbiologique, le brome est un biocide efficace contre quatre bactéries pathogènes (E. coli, P. aeruginosa, S. aureus et Enterococcus) détectées dans les eaux de baignade. Il a également été démontré que l'ordre de la sensibilité de l'espèce bactérienne E. coli, P. aeruginosa et Enterococcus dépend de la nature du biocide utilisé (BCDMH, ATIC) tout en observant en particulier la résistance de P. aeruginosa vis-à-vis du brome sous forme BCDMH. Néanmoins, ce biocide présente une plus grande activité bactéricide que le chlore dans l'eau minérale naturelle légèrement alcaline et chaude. Le brome offre donc une réelle alternative au chlore, avec une spécificité appropriée pour les traitements des piscines d'eau minérale naturelle chauffées.
Il demeure que l'innocuité du brome est contestée au regard de cas de dermatites de contact irritantes observées chez des patients utilisant des piscines bromées à des doses de 5 mg∙L-1. D'autre part, les données de génotoxicité et de cytotoxicité recueillies sur les sous-produits bromés trouvés dans les eaux de piscine traitées au brome démontrent que leur surveillance est nécessaire, étant donné leur toxicité supérieure à celle de leurs analogues chlorés. Par conséquent, afin de protéger la santé des baigneurs, les connaissances sur leur toxicité doivent être approfondies, sachant que certains sous-produits peuvent présenter des risques toxicologiques à faibles doses (acide dibromoacétique, bromate, N-nitrosodiméthylamine, etc.). Il est à noter que les VTR par voie orale et par voie respiratoire ne reflètent pas tout à fait la réalité de la baignade en piscine, car la voie topique n'est pas explorée. Il serait logique de considérer cette voie dans les études de toxicité puisque l'eau contaminée est en contact direct avec la peau même si celle-ci représente, dans des conditions saines, une très bonne barrière de protection contre les agressions chimiques et bactériologiques.
Enfin, force est de constater qu'il n'existe pas, à ce jour, une réglementation homogène sur le brome. Ainsi le brome liquide est interdit pour la désinfection des piscines publiques ou privées en Europe, le brome sous forme solide (BCDMH, NaBr) est, quant à lui, autorisé pour un usage privé en France, en Australie, au Canada et aux États-Unis malgré les risques toxicologiques spécifiés dans cette étude. Il est toutefois autorisé pour un usage public en Espagne et au Québec. Dans le cas des piscines françaises recevant du public, il est cependant soumis à l'autorisation de la DGS après consultation de l'ANSES.
Parties annexes
Références bibliographiques
- AGENCE NATIONALE DE SÉCURITÉ SANITAIRE DE L'ALIMENTATION, DE L'ENVIRONNEMENT ET DU TRAVAIL (ANSES) (2010). Évaluation des risques sanitaires liés aux piscines. Partie 1 : piscines règlementées. Avis AFSSET, Saisine No. 2007-SA-0409, Maisons-Alfort, France, 252 p.
- AGENCE NATIONALE DE SÉCURITÉ SANITAIRE DE L'ALIMENTATION, DE L'ENVIRONNEMENT ET DU TRAVAIL (ANSES) (2011). Élaboration d’une valeur toxicologique de référence chronique par voie orale de l’hydrate de chloral. Avis ANSES, Saisine No. 2010-SA-0227, Maisons-Alfort, France, 50 p.
- AGENCE NATIONALE DE SÉCURITÉ SANITAIRE DE L'ALIMENTATION, DE L'ENVIRONNEMENT ET DU TRAVAIL (ANSES) (2013). Évaluation des risques sanitaires liés aux piscines. Partie 2 : bains à remous. Avis ANSES, Saisine No. 2007-SA-0409, Maisons-Alfort, France, 206 p.
- AGUS E. et D. SEDLAK (2010). Formation and fate of chlorination by-products in reverse osmosis desalination systems. Water Res., 44, 1616-1626.
- ALLONIER A.S., M. KHALANSKI et V. CAMEL (1999). Determination of dihaloacetonitriles and halophenols in chlorinated seawater. Talanta, 50, 227-236.
- AUBERT J., L. PETIT et E. GUTTIERREZ-GALINDO (1981). Study of the toxicity of nitrosamines to marine organisms. Rev. Int. Océanogr. Méd., 62, 23-31.
- AGENCE DE RÉGLEMENTATION DE LA LUTTE ANTIPARASITAIRE (ARLA) (2011). Réévaluation du 1-bromo-3-chloro-5,5- dimethylhydantoin, du 1,3-dichloro-5,5-dimethylhydantoin et du 1,3-dichloro-5-ethyl-5-methylhydantoin. Décision de réévaluation ARLA, Santé Canada, RVD2011-08, Ottawa, Ontario, Canada, 15 p.
- BALLMAIER D. et B. EPE (2006). DNA damage by bromate: Mechanism and consequences. Toxicology, 221, 166-171.
- BAUDISCH C., G. PANSCH et J. PRÖSCH (1997). Determination of volatile halogenated hydrocarbons in chlorinated swimming pool water. Research report. Außenstelle Schwerin, Landeshygieneinstitut Mecklenburg – Vorpommern (en allemand).
- BENOIT F. et R. JACKSON (1987). Trihalomethane formation in whirlpool spas. Water Res., 21 (3), 353-357.
- BERNARD A., S. CARBONNELLE, O. MICHEL, S.HIGUET, C. DE BURBURE, J.P. BUCHET et I. DOYLE (2003). Lung hyperpermeability and asthma prevalence in schoolchildren: Unexpected associations with the attendance at indoor chlorinated swimming pools. Occup. Environ. Med., 60 (6), 385-394.
- BOWMAN F.J., J.F. BORZELLECA et A.E. MUNSON (1978). The toxicity of some halomethanes in mice. Toxicol. Appl. Pharm., 44, 213-215.
- BROWN J.R., D.M. McLEAN et M.C. NIXON (1963). Bromine disinfection of swimming pools. Can. J. Public Health, 54, 267-270.
- BROWN J.R., D.M. McLEAN et M.C. NIXON (1964). Bromine disinfection of a large swimming pool. Can. J. Public Health, 55, 251-256.
- BRUNET R., F. BERNE et J. DE LAAT (2010). Sous-produits de chloration dans les eaux de piscines publiques. Revue l'Eau l'Industrie, les Nuisances, 333, 83-88.
- BULL R.J., J.R. MEIER, M. ROBINSON, H.P. RINGHAND, R.D. LAURIE et J.A. STOBER (1985). Evaluation of mutagenic and carcinogenic properties of chlorinated acetonitriles: by-products of chlorimeter. Fundam. Appl. Toxicol., 5, 1065-1074.
- BUTLER T.C. (1948). Bromal hydrate and chloral hydrate; a pharmacological contrast and its chemical basis. J. Pharmacol. Exp. Ther., 94 (4), 401-411.
- CANTOR K.P., C.M. VILLANUEVA, D. SILVERMAN, J.D. FIGUEROA, F.X. REAL, M. GARCIA-CLOSAS, N. MALATS, S. CHANOCK, M. YEAGER, A. ARDON, R. GARCIA-CLOSAS, C. SERRA, A. CARRATO, G. CASTAÑO-VINYALS, C. SAMANIC, N. ROTHMAN et M. KOGEVINAS (2010). Polymorphisms in GSTT1, GSTZ1, and CYP2E1, disinfection by-products, and risk of bladder cancer in Spain. Environ. Health Perspect., 118 (11), 1545-1550.
- CHAMBON P., M. TAVEAU, M. MORIN, R. CHAMBON, J. VIAL (1983). Survey of trihalomethane levels in Rhône-Alps water supplies. Estimates on the formation of chloroform in wastewater treatment plants and swimming pools. Water Res., 17 (1), 65-69.
- CHU I., V. SECOURS, I. MARINO et D.C. VILLENEUVE (1980).The acute toxicity of four trihalomethanes in male and female rats. Toxicol. Appl. Pharm., 52, 351-353.
- CRAGLE D.L., C.M. SHY, R.J. STRUBA et E.J. SIFF (1985). A case-control study of colon cancer and water chlorination in North Carolina. Dans : Water Chlorination: Chemistry, Environmental Impact and Health Effects. JOLLEY R.L., R.J. BULL, W.P. DAVIS, S. KATZ, M.H. ROBERTS, Jr., et V.A. JACOBS (Éditeurs), Lewis Publishers, Chelsea, MI, États-Unis, Vol. 5, pp. 153-159.
- DALMAU G., M.E. MARTINEZ-ESCALA, V. GAZQUEZ, J.A. PUJOL-MONTCUSI, L. CANADELL, M.E. QUER, R.M. PUJOL, J. VILAPLANA, P. GAIG et A. GIMENEZ-ARNAU (2012). Swimming pool contact dermatitis caused by 1-bromo-3-chloro-5,5-dimethylhydantoïn. Contact Dermatitis, 66 (6), 335-339.
- DANIEL F.B., K.M. SCHENCK, J.K. MATTOX, E.L. LIN, D.L. HAAS et M.A. PEREIRA (1986). Genotoxic properties of haloacetonitriles: Drinking water by-products of chlorine disinfection. Fundam. Appl. Toxicol., 6 (3), 447-453.
- DE ANGELO A.B., M.H. GEORGE, S.R. KILBURN, T.M. MOORE et D.C. WOLF (1998). Carcinogenicity of potassium bromate administered in drinking water to male B6C3F1 mice and F344/N rats. Toxicol. Pathol., 26, 587-594.
- DE LAAT J., F. BERNE, R. BRUNET et C. HUE (2009). By-products of chlorination formed during the disinfection of swimming pool waters. Bibliographical study. Eur. J. Water, 40, 109-128.
- DERREUMAUX A. et M. LAMBERT (1973). Procédé et installation de traitement des eaux d'une piscine. Brevet canadien, No. CA 935099.
- DORÉ M., N. MERLET et J. DE LAAT (1979). Réactivité de quelques précurseurs de la réaction haloforme. Influence de l'ammoniaque. J. Fr. Hydrol., 10 (2), 131-140.
- DORÉ M. et J. GOICHON (1980). Étude d'une méthode d'évaluation globale des précurseurs de la réaction haloforme. Water Res., 14, 657-663.
- DORÉ M. (1989). Chimie des oxydants et traitement des eaux. Éditions Lavoisier, Paris, France, 528 p.
- ERDINGER L., K.P. KÜHN, F. KIRSH, R. FELDHUES, T. FRÖBEL, B. NOHYNEK et T. GABRIO (2004). Pathways of trihalomethane uptake in swimming pools. Int. J. Hyg. Environ. Health, 207, 571-575.
- FITZGERALD D.J. et N.I. ROBINSON (2007). Development of a tolerable daily intake for N-nitrosodimethylamine using a modified benchmark dose methodology. J. Toxicol. Environ. Health A, 70 (19), 1670-1678.
- FENG Y., D.W. SMITH et J.R. BOLTON (2007). Photolysis of aqueous free chlorine species HOCl and CLO- with 254 nm ultraviolet lamp. J. Environ. Eng. Sci., 6, 277-284.
- FLAHAUT J. (1977). Applications modernes du brome et de ses dérivés. Rev. Hist. Pharm., 232, 34-62.
- GOULD D.J. (1983). Dermatosis associated with brominated swimming pools. Br. Med. J., 287, 913.
- GREAT LAKES CHEMICAL CORPORATION (2005). Aqueous suspensions of compounds with low solubility in water. Brevet européen, No. EP 1202624.
- HAAG W.R. (1981). On the disappearance of chlorine in sea-water. Water Res., 15 (7), 937-940.
- HARRINGTON-BROCK K., D.D. COLLARD et T. CHEN (2003). Bromate induces loss of heterozygosity in the thymidine kinase gene of L5178Y/Tk(+/-)-3.7.2C mouse lymphoma cells. Mutat. Res., 537 (1), 21-28.
- HILDESHEIM M.E., K.P. CANTOR, C.F. LYNCH, M. DOSEMECI, J. LUBIN, M. ALAVANJA et G. CRAUN (1998). Drinking water source and chlorination by-products. II. Risk of colon and rectal cancers. Epidemiology, 9 (1), 29-35.
- HOFFMAN R. et R.C. ANDREWS (2001). Ammoniacal bromamines: A review of their influence on bromate formation during ozonation. Water Res., 35, 599-604.
- HSU C.H., W.L. JENG, R.M. CHANG, L.C. CHIEN et B.C. HAN (2001). Estimation of potential lifetime cancer risks for trihalomethanes from consuming chlorinated drinking water in Taiwan. Environ. Res., 85, 77-82.
- HUANG X., N. GAO et Y. DENG (2008). Bromate ion formation in dark chlorination and ultraviolet/chlorination for bromide-containing water. J. Environ. Sci., 20, 246-51.
- JENNER H.A., C.J.L. TAYLOR, M. VAN DONCK et M. KHALANSKIC (1997). Chlorination by-products in chlorinated cooling water of some European coastal power stations. Mar. Environ. Res., 43 (4), 279-293.
- JOHANNESSON J.K. (1960). The bromination of swimming pools. Am. J. Public Health Nations Health, 50, 1731-1736.
- JOHNSON J.D. et R. OVERBY (1971). Bromine and bromamine disinfection chemistry. J. San. Eng. Div. Proc. ASCE, 97, 617-628.
- JUDD S.J. et J.A. JEFFREY (1995). Trihalomethane formation during swimming pool water disinfection using hypobromous and hypochlorous acids. Water Res., 29 (4), 1203-1206.
- KANAN A. et T. KARANFIL (2011). Formation of disinfection by-products in indoor swimming pool water: the contribution from filling water natural organic matter and swimmer body fluids. Water Res., 45 (2), 926-932.
- KARCHER W. et J. DEVILLERS (1990). Practical applications of Quantitative Structure-Activity Relationships (QSAR) in environmental chemistry and toxicology. Kluwer Academic Publishers Group, Dordrecht, Pays-Bas, 476 p.
- KRASNER S.W., H.S. WEINBERG, S.D. RICHARDSON, S.J. PASTOR, R. CHINN, M.J. SCLIMENTI, G.D. ONSTAD et A.D. THRUSTON, Jr. (2006). Occurrence of a new generation of disinfection byproducts. Environ. Sci. Technol., 40 (23), 7175-7185.
- KARGALIOGLU Y., B.J. McMILLAN, R.A. MINEAR et M.J. PLEWA (2002). Analysis of the cytotoxicity and mutagenicity of drinking water disinfection by-products in Salmonella typhimurium. Teratog. Carcinog. Mutagen., 22 (2), 113-128.
- KETTWICH S.C., L.O. PAULSON, P.L. RASTON et D.T. ANDERSON (2008). Photodissociation of molecular bromine in solid H2 and D2: Spectroscopy of the atomic bromine spin-orbit transition. J. Phys. Chem. A, 112 (44), 11153-11158.
- KOGEVINAS M., C.M. VILLANUEVA, L. FONT-RIBERA, D. LIVIAC, M. BUSTAMANTE, F. ESPINOZA, M.J. NIEUWENHUIJSEN, A. ESPINOSA, P. FERNANDEZ, D.M. DEMARINI, J.O. GRIMALT, T. GRUMMT et R. MARCOS (2010). Genotoxic effects in swimmers exposed to disinfection by-products in indoor swimming pools. Environ. Health. Perspect., 118 (11), 1531-1537.
- KOSKI T.A., L.S. STUART et L.F. ORTENZIO (1966). Comparison of chlorine, bromine, and iodine as disinfectants for swimming pool water. J. Appl. Microbiol., 14 (2), 276-279.
- KRISTIANSEN N.K., M. FROESHAUG et K.T. AUNE (1994). Identification of halogenated compounds in chlorinated seawater and drinking water produced offshore using n-pentane extraction and open-loop stripping technique. Environ. Sci. Technol., 28 (9), 1669-1673.
- KUROKAWA Y., A. MAEKAWA, M. TAKAHASHI et Y. HAYASH (1990). Toxicity and carcinogenicity of potassium bromate - a new renal carcinogen. Environ. Health Perspect., 87, 309-335.
- LAGADEC G. (2005). État des lieux des pratiques d’utilisation de l’eau à des fins ludiques et de remise en forme. Mémoire de l'École Nationale de la Santé Publique, Rennes, France, 142 p.
- LAGIERE J., C. DEYTIEUX-BELLEAU, S. BIASUTTI et K. DUBOURG (2009). Étude comparative du brome et du chlore dans la désinfection des eaux thermales de Dax. Presse Therm. Clim., 146, 31-39.
- LAKIND J.S., S.D. RICHARDSON et B.C. BLOUNT (2010). The good, the bad, and the volatile: can we have both healthy pools and healthy people? Environ. Sci. Technol., 44, 3205-3210.
- LEE J., K.T. HA et K.D. ZOH (2009). Characteristics of trihalomethane (THM) production and associated heal.th risk assessment in swimming pool waters treated with different disinfection methods. Sci. Total. Environ., 407, 1990-1997.
- LEHMAN G. et P.K. KNOFFEL (1938). Trichlorethanol, tribromoethanol, chloral hydrate and bromal hydrate. J. Pharmacol. Exp. Ther., 63, 453-465.
- LEI H., B.J. MARIÑAS et R.A., MINEAR (2004). Bromamine decomposition kinetics in aqueous solutions. Environ. Sci. Technol., 38, 2111-2119.
- LI J. et E.R. BLATCHLEY (2007). Volatile disinfection byproduct formation resulting from chlorination of organic-nitrogen precursors in swimming pools. Environ. Sci. Technol., 41, 6732-6739.
- LINDER R.E., G.R. KLINEFELTER, L.F. STRADER, J.D. SUAREZ et C.J. DYER (1994). Acute spermatogenic effects of bromoacetic acids. Fundam. Appl. Toxicol., 22 (3), 422-430.
- LOUGHNEY E. et J. HARRISON (1998). Irritant contact dermatitis due to l-bromo-3-chloro-5,5-dimethythydantoin in a hydrotherapy pool. Occup. Med., 48, 461-463.
- LOURENCETTI C., J.O. GRIMALT, E. MARCO, P. FERNANDEZ, L. FONT-RIBERA, C.M. VILLANUEVA et M. KOGEVINAS (2012). Trihalomethanes in chlorine and bromine disinfected swimming pools: Air-water distributions and human exposure. Environ. Int., 45, 59-67.
- LUO X.H. et T.E. CLEVENGER (2005). Role of NOM in the formation of N-nitrosodimethylamine (NDMA) in surface waters. DENG B.L. Conference: 229th National Meeting of the American Chemical Society, San Diego, CA, États-Unis.
- MASSIN N., A. BOHADANA, P. WILD, M. HÉRY, J.P. TOAMAIN et G. HUBERT (1998). Respiratory symptoms and bronchial responsiveness in lifeguards exposed to nitrogen trichloride in indoor swimming pools. Occup. Environ. Med., 55, 258-263.
- MELNICK R.L., A. NYSKA, P.M. FOSTER, J.H. ROYCROFT et G.E. KISSLING (2007). Toxicity and carcinogenicity of the water disinfection by-product, dibromoacetic acid, in rats and mice. Toxicology, 230, 126-136.
- MINISTÈRE DE LA TRANSITION ÉCOLOGIQUE ET SOLIDAIRE (2017). Produits biocides. https://www.ecologique-solidaire.gouv.fr/produits-biocides (consultation le 25 novembre 2016).
- MORGAN M.J. (1983). Dermatosis associated with brominated swimming pools. Br. Med. J., 287, 913.
- MORRIS J.C. (1966). The acid ionization constant of HOCl from 5 to 35°C. J. Phys. Chem., 70, 3798-3805.
- MORRIS J.C., R.A. ISAAC, R.L. JOLLEY, W.A. BRUNGS, J.A. COTRUVO, R.B. CUMMING, J.S. MATTICE et V.A. JACOBS (1981). A critical review of kinetic and thermodynamic constants for the aqueous chlorine-amonia system. Dans : Water Chlorination: Environmental Impact and Health Effects. JOLLEY R.L., W.A. BRUNGS, J.A. COTRUVO, R.B. CUMMING, J.S. MATTICE et V.A. JACOBS (Éditeurs), Ann Arbor Science Publishers, Ann Arbor, MI, États-Unis, Vol. 4 (1), pp. 49-62.
- NORIN H. et L. RENBERG (1980). Determination of trihalomethanes (THM) in water using high efficiency solvent extraction. Water Res., 14 (10), 1397-1402.
- OH S.H., H.D. YOO, H.N. LEE et E.S. KIM (2007). Comparative characterization on bacterial disinfection using trichloroisocyanuric acid, bromochlorodimethylhydantoin and calcium hypochlorite. Korean J. Microbiol. Biotechnol., 35, 334-338.
- ORGANISATION MONDIALE DE LA SANTÉ (OMS) (1970). Dix-septième rapport du Comité OMS d'experts. Comité OMS d'experts de la pharmacodépendance, OMS, série de rapports techniques, No. 437, Genève, Suisse, 32 p.
- ORGANISATION MONDIALE DE LA SANTÉ (OMS) (1993). Guidelines for Drinking Water Quality. Volume 1: Recommendations. 2e édition, Genève, Suisse, 11 p.
- ORGANISATION MONDIALE DE LA SANTÉ (OMS) (2000). Guidelines for safe recreational water environments. Volume 2. Swimming pools, spas and similar recreational-water environments. Final draft, Genève, Suisse, 15 p.
- ORGANISATION MONDIALE DE LA SANTÉ (OMS) (2006a). Guidelines for drinking-water quality, third edition, incorporating first and second addenda. Volume 1. Recommandations. Genève, Suisse, 516 p.
- ORGANISATION MONDIALE DE LA SANTÉ (OMS) (2006b). Guidelines for safe recreational waters. Volume 2. Swimming pools and similar recreational water environments. Genève, Suisse, 118 p.
- ORGANISATION MONDIALE DE LA SANTÉ (OMS) (2011). Guidelines for drinking-water quality. 4e édition, Genève, Suisse, 564 p.
- PARINET J., S. TABARIES, B. COULOMB, L. VASSALO et J.L. BOUDENNE (2011). Exposure levels to brominated compounds in seawater swimming pools treated with chlorine. Water Res., 46 (3), 828-836.
- PEGRAM R.A., M.E. ANDERSEN, S.H. WARREN, T.M. ROSS et L.D. CLAXTON (1997). Glutathione S-transferase-mediated mutagenicity of trihalomethanes in Salmonella typhimurium: contrasting results with bromodichloromethane and chloroform. Toxicol. Appl. Pharmacol., 144, 183-188.
- PENNY P.T. (1991). Hydrotherapy pools of the future - the avoidance of health problems. J. Hosp. Infect., 18 (Suppl. A), 535-542.
- PETERS R.J.B., E.W.B DELEER et L. DEGALAN (1990). Chlorination of cyanoethanoic acid in aqueous medium. Environ. Sci. Technol., 24, 81-86.
- PLEWA M.J., Y. KARGALIOGLU, D. VANKERK, R.A. MINEAR et E.D. WAGNER (2002). Mammalian cell cytotoxicity and genotoxicity analysis of drinking water disinfection by-products. Environ. Mol. Mutagen., 40, 134-142.
- PLEWA M.J., E.D. WAGNER et W.A. MITCH (2011). Comparative mammalian cell cytotoxicity of water concentrates from disinfected recreational pools. Environ. Sci. Technol., 45, 4139-4165.
- PRICE D. et D.G. AHEARN (1988). Incidence and persistence of Pseudomonas aeruginosa in whirlpools. J. Clin. Microbiol., 26 (9), 1650-1654.
- RECKHOW D.A., P.C. SINGER et R.L. MALCOLM (1990). Chlorination of humic materials: By-product formation and chemical interpretations. Environ. Sci. Technol., 24 (11), 1655-1664.
- RICHARDSON S.D., M.J. PLEWA, E.D. WAGNER, R. SCHOENY et D.M. DEMARINI (2007). Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: a review and roadmap for research. Mutat. Res., 636 (1-3), 178-242.
- RICHARDSON S.D., D.M. DE MARINI, M. KOGEVINAS, P. FERNANDEZ, E. MARCO, C. LOURENCETTI, C.BALLESTÉ, D. HEEDERIK, K. MELIEFSTE, A.B. MCKAGUE, R. MARCOS, L. FONT-RIBERA, J.O. GRIMAL.T et C.M. VILLANUEVA (2010). What’s in the pool? A comprehensive identification of disinfection by-products and assessment of mutagenicity of chlorinated and brominated swimming pool water. Environ. Health Perspect., 118 (11), 1523-1530.
- RODIER J., B. LEGUBE, N. MERLET et J. BRUNET (2009). L’analyse de l’eau. 9e édition, Dunod, Paris, France, 1600 p.
- ROOK J.J. (1974). Formation of haloforms during chlorination of natural waters. J. Water Treat. Exam., 23, 234-243.
- RYCROFT R.J.G. et P.T. PENNY (1983). Dermatosis associated with brominated swimming pools. Br. Med. J., 287, 462.
- SANTÉ CANADA (1994). Recommandations pour la qualité de l'eau potable au Canada. Document technique : Les trihalométhanes. Ottawa, Ont, Canada, 76 p.
- SANTÉ CANADA (2008). Recommandations pour la qualité de l'eau potable au Canada. Document technique : Les acides haloacétiques. Ottawa, Ont, Canada, 92 p.
- SAVARY B., R. LEVILLY, A. LAPLANCHE, D. WOLBERT, M. LEMASLE (2000). Formation des ions bromate dans une colonne à bulles : effet du peroxyde d’hydrogène lors de l’ozonation. Rev. Sci. Eau, 13 (2), 139-154.
- SCHREIBER I.M. et W.A. MITCH (2006). Nitrosamine formation pathway revisited: The importance of chloramine speciation and dissolved oxygen. Environ. Sci. Technol., 40 (19), 6007-6014.
- SHAW J.W. (1984). A retrospective comparison of the effectiveness of bromination and chlorination in controlling Pseudomonas aeruginosa in spas (whirlpools) in Alberta. Can. J. Public Health, 75, 61-68.
- SOULARD M., F. BLOC et A. HATTERER (1983). Comparaison du comportement chimique du chlore et du brome en épuration d'eau. Caractérisation, pouvoir oxydant et évolution des halogènes et des halogénamines. Rev. Fr. Sci. Eau, 2, l -23.
- SPEIT G., S. HAUPTER, P. SCHUTZ et P. KREIS (1999). Comparative evaluation of the genotoxic properties of potassium bromate and potassium superoxide in V79 Chinese hamster cells. Mutat. Res., 439, 213-221.
- TEO T.L.L., H.M. COLEMAN et S.J. KHAN (2015). Chemical contaminants in swimming pools: Occurrence, implications and control. Environ. Int., 76, 16-31.
- UENO H., T. MOTO, Y. SAYATO et K. NAKAMURO (1996). Disinfection by-products in the chlorination of organic nitrogen compounds: By-products from kynurenine. Chemosphere, 33, 1425-1433.
- UNATED STATES ENVIRONMENTAL PROTECTION AGENCY (US EPA) (1987). Integrated Risk Information System (IRIS), N-nitrosodimethylamine. National Center for Environmental Assessment, Office of Research and Development, Washington, DC, États-Unis.
- UNITED STATES ENVIRONMENTAL PROTECTION AGENCY (US EPA) (1998). National primary drinking water regulations. Disinfectants and disinfection by-products. Final Rule. Federal Register, Washington, DC, États-Unis, 88 p.
- UNATED STATES ENVIRONMENTAL PROTECTION AGENCY (US EPA) (1999). Integrated Risk Information System (IRIS) on bromoform. National Center for Environmental Assessment, Office of Research and Development, Washington, DC, États-Unis.
- UNITED STATES ENVIRONMENTAL PROTECTION AGENCY (US EPA) (2005). Guidelines for carcinogen risk assessment. EPA/630/P-03/001B, Washington, DC, États-Unis.
- UNITED STATES ENVIRONMENTAL PROTECTION AGENCY (US EPA) (2010). Integrated Risk Information System. https://www.epa.gov/iris/ (consultation le 6 juillet 2015).
- VIDON D. (1970). Étude de l'activité bactéricide du brome sur la microflore de l'eau. Bull. Assoc. Pharm. Fr. Hydrol., 2, 21-36.
- WAGNER E.D., K.-M. HSU, A. LAGUNAS, W.A. MITCH et M.J. PLEWA (2012). Comparative genotoxicity of nitrosamine drinking water disinfection byproducts in Salmonella and mammalian cells. Mutat. Res. Genet. Toxicol. Environ. Mutagen., 741, 109-115.
- WAJON J.E. et J.C. MORRIS (1980). Bromamination chemistry: Rates of formation of NH2Br and some N-bromoamino acids. Dans : Water chlorination: Environmental impact and health effects. JOLLEY R.L., W.A. BRUNGS, et R.B. CUMING (Éditeurs), Ann Arbor Science Publishers, Ann Arbor, MI, Éatst-Unis, Vol. 3, pp. 171-181.
- WALSE S.S. et W.A. MITCH (2008). Nitrosamine carcinogens also swim in chlorinated pools. Environ. Sci. Technol., 38 (42), 1032-1037.
- WEAVER W.A., J. LI, Y. WEN, J. JOHNSTON, M.R. BLATCHLEY et E.R. BLATCHLEY (2009). Volatile disinfection by-product analysis form chlorinated indoor swimming pools. Water Res., 43 (13), 3308-3318.
- WESTERHOFF P., P. CHAO et H. MASH (2004). Reactivity of natural organic matter with aqueous chlorine and bromine. Water Res., 38 (6), 1502-1513.
- WOJTOWICZ J.A. (1993). Chloramines and bromamines. Kirk-Othmer encyclopedia of chemical technology. John Wiley and Sons, New York, NY, États-Unis, Vol. 5, pp. 932-968.
- WOLF D.C., L.M. CROSBY, M.H. GEORGE, S.R. KILBURN, T.M. MOORE, R.T. MILLER et A.B. DEANGELO (1998). Time and dose-dependent development of potassium bromate-induced tumors in male Fischer 344 rats. Toxicol. Pathol., 26, 724-729.
- WOLFE R.L., N.R. WARD et B.H. OLSON (1984). Inorganic chloramines as drinking water disinfectant: A Review. J. Am. Water Works Assoc., 76 (5), 74-88.
- WORLEY S.D. et J.A. WOJTOWICZ (2004). N-halamines. Kirk-Othmer encyclopedia of chemical technology. John Wiley and Sons, New York, NY, États-Unis, pp. 98-122.
Liste des figures
Figure 1
Distribution des différentes formes de systèmes halogène-eau en fonction du pH (T = 25 °C; [halogénure] = 5 x 10-3 M) : a) système chlore-eau et b) système brome-eau (SOULARD et al., 1983)
Distribution of different forms of halogen-water systems according to pH (T = 25°C; [halide] = 5 x 10-3 M): a) chlorine-water system and b) bromine-water system
Figure 2
Évolution du brome total dans l’eau minérale naturelle de Dax en fonction du brome ajouté (LAGIERE et al., 2009). 0 à B : formation des bromamines minérales; B à C : destruction des bromamines minérales; C à D : formation du brome libre
Evolution of the total bromine in Dax natural mineral water as a function of the added bromine. 0 to B: formation of mineral bromamines; B to C: destruction of mineral bromamines; C to D: formation of free bromine
Figure 3
Diagramme de prédominance des principales espèces de brome et bromamines en fonction du pH et du rapport N/Br (JOHNSON et OVERBY, 1971)
Main species of bromine and bromamine predominating at various pH and ratio N/Br
Figure 4
Mécanisme réactionnel de la réaction haloforme (DORÉ et al., 1979; DORÉ et GOICHON, 1980; ROOK, 1974)
Reaction mechanism of the haloform reaction
Figure 5
Mécanisme réactionnel de la chloration d’un composé phénolique type résorcinol (ROOK, 1974). Composé I : chloration rapide de l’atome de carbone en ortho, activé par une substitution hydroxyle; composé II : forme intermédiaire; composé III : forme intermédiaire protonée; composé IV : forme intermédiaire rapidement halogénée. Les composés III et IV sont ensuite clivés au niveau des repères a, b et c pour donner différents sous-produits : les THM (clivage a du composé IV), les AHA (clivage b), les halocétones (clivage c)
Reaction mechanism of the chlorination of a phenolic compound resorcinol type. Compound I: rapid chlorination of the carbon atom in ortho, activated by a hydroxyl substitution; compound II: intermediate form; compound III: protonated intermediate form; compound IV: rapidly halogenated intermediate form. Compounds III and IV are then cleaved at marks a, b and c to give various by-products: THM (cleavage a of compound IV), AHA (cleavage b), haloketones (cleavage c)
Liste des tableaux
Tableau 1
Principaux sous-produits bromés et azotés retrouvés dans les piscines
Main brominated and nitrogen by-products found in swimming pools
Tableau 2
Concentrations moyennes des principaux sous-produits bromés dans les piscines
Average concentrations of major brominated by-products in swimming pools
Tableau 3
Recommandations pour quelques sous- produits trouvés dans les piscines
Recommendations for some by-products found in swimming pools
Tableau 4
Données toxicologiques des sous-produits bromés et azotés
Toxicological data for brominated and nitrogenous by-products



![Distribution des différentes formes de systèmes halogène-eau en fonction du pH (T = 25 °C; [halogénure] = 5 x 10-3 M) : a) système chlore-eau et b) système brome-eau (SOULARD et al., 1983)](/fr/revues/rseau/2017-v30-n3-rseau03551/1044249ar/media/5039074n.jpg)






 10.7202/705386ar
10.7202/705386ar