Résumés
Résumé
Certains procédés d’épuration extensive des eaux usées utilisent les lentilles d’eau. Les rejets des eaux usées sont de plus en plus sujets à des pollutions de natures diverses, notamment les métaux lourds. Dans ce travail, on procède à une évaluation comparée de la tolérance et de l’accumulation de deux métaux lourds, le cuivre et le chrome, par deux espèces de lentilles d’eau Lemna minor et Lemna gibba. Bien que sous climat de type méditerranéen, L. gibba soit plus utilisée que L. minor, les données disponibles dans la littérature concernent plutôt L. minor. L’évaluation des paramètres toxicologiques montre chez L. gibba une tolérance nettement supérieure aux effets toxiques des deux métaux expérimentés. Le chrome est moins toxique que le cuivre et s’accumule à des taux supérieurs à ceux du cuivre dans les tissus des plantes. Pour les deux métaux, l’accumulation est plus importante chez L. minor. Cependant, on pense que L. gibba serait plus indiquée dans des applications en phytoremédiation que L. minor, vu sa tolérance et sa productivité en biomasse. Les potentialités de ces deux espèces pour des applications de ce type se justifient par des taux d’accumulation fort élevés, spécialement pour le chrome où ils dépassent largement les 1000 µg g‑1 de poids sec. En effet, les concentrations des plantes en Cr obtenues dans ce travail atteignent 2140 µg g‑1 chez L. minor et 1710 µg g‑1 chez L. gibba. Ces performances montrent un potentiel fort intéressant en comparaison à d’autres macrophytes comme la jacinthe d’eau par exemple.
Mots clés:
- Lemna minor,
- Lemna gibba,
- chrome,
- cuivre,
- tolérance,
- accumulation,
- phytoremediation
Summary
Natural wastewater treatment technologies are common practice in many regions of the world. Although these technologies are normally meant for domestic wastewater treatment, they can have broader applications such as the treatment of water contaminated by heavy metals.
Among various existing technologies, systems that use duckweed are exploited for wastewater treatment in various regions of the world. In Morocco, this type of system has been tested on an experimental scale and a pilot scale. The most common duckweeds species are Lemna minor L. and Lemna gibba L. L. gibba is used in Mediterranean climates more often than L. minor, but literature data on the tolerance and accumulation of heavy metals are mostly available for L. minor.
In the current study, we compared the tolerance and accumulation of two heavy metals, copper (Cu) and chromium (Cr), for these two duckweed species. Thus, this study compares the potential of these two duckweed species to be used as a method of decontaminanting Cu‑ and Cr‑contaminated water. The experimental design used hydroponic crops of the two species. Forty fronds of each species were sown in plastic pots containing 100 mL of White nutritive solution with a pH adjusted to 6.8. As experimental treatments, we used exposures corresponding to the following concentrations: 0.5; 1; 2; 3; 4; 5 mg Cu/L and 3; 5; 10; 20; 30; 35 mg Cr/L. Each treatment was repeated five times. In order to compensate for water loss by evapotranspiration, we added 15 mL of the corresponding solution to each treatment daily.
Generally, the results obtained confirm that Cu is more toxic than Cr and that the two species of duckweed have different tolerance levels; L. minor is more sensitive than L. gibba for both metals. For Cu, we observed a highly significant inhibition of growth in response to the gradient of Cu concentrations used, the growth of L. minor being more affected than that of L. gibba. For example, the time required for L. minor colonies to double was more than four days for 1 mg Cu/L, whereas for L. gibba this was observed only at 3 mg Cu/L. The toxicological parameters reflect this observation as L. minor had both a lower NOEC (No Observed Effect Concentration) and a lower IC50 (50% Inhibition Concentration) than those reported for L. gibba. Comparatively, these results show a higher tolerance of Cu contamination for L. gibba.
For Cr, L. minor was more sensitive than L. gibba, but in much less marked way than for Cu. Indeed, the time required to double the colony size and the NOEC value were similar for the two species, whereas the IC50 of L. minor was lower than that of L. gibba. The comparison of the rate of inhibition confirms a slightly greater sensitivity of L. minor to Cr exposure.
The Cu and Cr concentrations in the biomass increased with the concentration of metal; the highest contents were observed in the treatments with the highest concentrations used: 5 mg Cu/L and 10 mg Cr/L. However, the BCF (Bioconcentration Factor) decreased with the concentration of the treatment; the highest values were observed for the treatments with the lowest concentrations (1 mg Cu/l and 3 mg Cr/L). With respect to possible applications in phytoremediation, the potential use of these two species would be more efficient for low levels of contamination.
The two species accumulate the two metals at different rates; the accumulation of Cr is greater than that of Cu and L. minor shows higher rates of accumulation. Copper concentrations of approximately 800 µg/g were obtained in L. minor exposed to 5 mg Cu/L. For Cr, concentrations were approximately 2140 µg/g obtained in L. minor exposed to 10 mg Cr/L. For L. gibba, the maximum concentrations obtained were 745 µg/g and 1710 µg/g respectively for the treatments of 5 mg Cu/L and 10 mg Cr/L. Similarly, the BCF estimated at L. minor was higher than that of L. gibba.
Compared with other macrophyte species, the duckweeds show a very interesting potential for metal accumulation. Indeed, for Cu, accumulation was definitely higher than that for other species such as Eichhornia crassipes and Polygonum hydropiperoides. The BCF obtained was higher than those observed for species of Typha and Spartina. These results confirm that L. minor and L. gibba could be good Cu accumulating species compared to other macrophytes. For Cr, other species of macrophytes accumulate this metal to a greater or lesser extent: E. crassipes (slower rate than that of the duckweeds), Nymphea alba (similar rate to that of the duckweeds) or Azolla pinnata (higher rate than the duckweeds). The Cr contents accumulated by the two duckweed species would justify their classification as hyperaccumulator species.
With respect to tolerance, accumulation potential and biomass productivity, L. gibba shows potential as a species that could be used in phytoremediation and in particular the rhizofiltration of wastewater contaminated by Cu and Cr.
Keywords:
- Lemna minor,
- Lemna gibba,
- chromium,
- copper,
- tolerance,
- accumulation,
- phytoremediation
Corps de l’article
1. Introduction
Les techniques extensives d’épuration des eaux usées par leur rusticité présentent des atouts importants comme le faible coût de construction et de maintenance, l’adaptation aux variations de charges et la faible demande d’énergie (Brix, 1993; Verhoeven et Meuleman, 1999). Ces caractéristiques associées à des conditions climatiques favorables et des besoins pressants pour combler les manques en matière d’assainissement, expliquent l’intérêt et les espoirs suscités par ce type de technologie dans les pays en développement (Kivaisi, 2001).
Bien que cette technologie soit normalement conçue pour le traitement des eaux usées domestiques, elle peut avoir des applications plus larges, comme la restauration des cours d’eaux pollués (Helfield et Diamond, 1997), le traitement des drainages des routes (Munguret al., 1995) ou encore des rejets particuliers, comme le drainage des mines (Demchik et Garbutt, 1999) ou les rejets industriels (DUNBABIN et BOWMER, 1992). Pour ces différentes utilisations, elles doivent faire face à des pollutions de natures multiples, mais dont les métaux lourds constituent l’une des principales sources (Elliset al., 1994). Il s’agit d’une application faisant partie d’un domaine particulier de l’ingénierie environnementale, la phytoremédiation. Elle est basée sur l’utilisation des plantes pour la décontamination des eaux et des sols contaminés par des polluants organiques et inorganiques y compris les métaux lourds (Raskinet al., 1997; Meagher, 2000).
Les technologies extensives sont fondées sur le principe de la reconstitution d’écosystèmes artificiels des zones humides dont les macrophytes sont l’élément de base (Vymazalet al., 1998), d’où l’attention particulière qu’on doit accorder à l’évaluation de la tolérance et l’accumulation des polluants courants comme les métaux lourds par les macrophytes. Il s’agit d’un facteur déterminant pour le choix des espèces de macrophytes à utiliser dans les stations d’épuration, et cela en fonction de la nature des eaux usées, du type et de la quantité des métaux lourds.
Parmi le large éventail des systèmes apparentés aux technologies extensives, il y a les systèmes à lentilles d’eau (Braun, 1995; Oronet al., 1987). Ces systèmes sont exploités pour le traitement des eaux usées dans différentes régions du monde comme l’asie (Gijzen et VEENSTRA, 1998), Israel et les Etats‑Unis (Oron et Porath, 1987). Au Maroc, ce type de système a été essayé aussi bien à l’échelle expérimentale (Mandi, 1994; Ezzahriet al., 2001) que pilote (ONEP, 1988). Dans la région méditerranéenne, en général, et particulièrement au Maroc, les espèces de lentilles d’eau les plus communes sont: Lemna minor L. et Lemna gibba L. (Ennabili et Ater, 1996).
Différentes études ont montré chez L. minor une accumulation élevée d’éléments traces (Dirilgen et Inel, 1994; Jenner et Janssen-Mommen, 1993; Moet al., 1989; Bassiet al., 1990; Zayedet al., 1998; Mathiset al., 1980). Par contre, les études consacrées à L. gibba sont plus rares et les connaissances à ce sujet sont plus limitées.
C’est dans cette perspective que s’inscrit l’objectif de ce travail qui est l’évaluation de la tolérance et de l’accumulation du cuivre (Cu) et du chrome (Cr) chez L. minor et L. gibba. Ainsi, on pense apporter une contribution originale sous forme d’une étude comparative des potentialités des deux espèces de lentilles d’eau, vis‑à‑vis de deux métaux lourds. Le choix de ces deux métaux a été guidé par l’importance de la pollution par ces deux métaux, et particulièrement dans la région de Tétouan (Nord‑Ouest du Maroc) (BRYLER-ISKANE-SHELADIA, 1992).
D’autre part, les lentilles d’eau constituent un bon modèle expérimental vu leur croissance rapide et la facilité de culture et de récolte. En effet, elles ont été très utilisées pour l’évaluation de la toxicité des polluants, comme les huiles industrielles (Tkalecet al., 1998), les métaux lourds (Mohan et Hosetti, 1997; Wang, 1986), les hydrocarbures (Huanget al., 1995) et les pesticides (Hartman et Martin, 1985). Chez les lentilles d’eau, l’effet des substance toxiques peut être estimé par différents paramètres comme le nombre des frondes, la biomasse et la surface foliaire (Tkalecet al., 1998; Wang, 1986), le taux des enzymes respiratoires comme la catalase et la peroxydase (Mohan et Hosetti, 1997) et la teneur en chlorophylle et en azote (Strother, 1981). Le nombre de frondes (NF) et la biomasse (PF), en plus de leur large utilisation, présentent l’avantage d’être simples et compatibles avec un grand dispositif expérimental.
2. Matériels et méthodes
Les écotypes de L. minor et L. gibba utilisés dans cette étude ont été récoltés dans les marais de Smir (Région de Tétouan, Maroc; 5°21’-23’W 35°41’-44’N). Les frondes récoltées sont lavées plusieurs fois à l’eau distillée avant d’être ensemencées dans des bacs contenant la solution nutritive de White (Hewitt, 1966). Les cultures sont conduites en serre.
Le CuCl2 a été utilisé comme source de cuivre (Cu) et le K2Cr2O7 comme source de chrome (Cr). Quarante frondes de chaque espèce ont été ensemencées dans des pots en plastique contenant 100 mL de solution nutritive, dont le pH a été ajusté à 6,8. En plus des témoins, on a utilisé des traitements correspondant aux gradients de concentration suivants : 0,5; 1; 2; 3; 4 et 5 mg Cu/L et 3; 5; 10; 20; 30 et 35 mg Cr/L. Chaque traitement a été répété cinq fois. Afin de compenser les pertes en eau par évapotranspiration, on ajoute quotidiennement 15 mL de la solution correspondante pour chaque traitement.
Après quatre jours, on compte le nombre de frondes (NF) avant de les peser pour déterminer le poids frais (PF). La cinétique de la croissance est suivie par le comptage journalier du nombre de frondes permettant d’estimer le temps de doublement des colonies. Le taux d’accroissement (DNF) est estimé par la différence entre le nombre de frondes initiales et finales (Wang, 1986). L’analyse de la variance (ANOVA) et la comparaison multiple des moyennes permettent d’estimer la concentration sans effet observé (CSEO). La concentration inhibant 50 % de la croissance (CI50) est estimée graphiquement (Wang, 1986). Le pourcentage d’inhibition du NF et du PF par rapport au témoin est estimé par :
100 x NF ou PF (témoin-traitement)/NF ou PF du témoin.
Pour évaluer l’accumulation du Cu et du Cr, les plantes ont été exposées aux traitements : 0; 1; 3 et 5 mg/L du Cu et 0; 3; 5 et 10 mg/L du Cr pendant quatre jours. Ensuite, elles ont été lavées trois fois avec de l’eau distillée acidifiée avant d’être séchées dans l’étuve à 80 °C durant 48 heures et broyées en poudre fine. 0,25 g de cette poudre a été minéralisé avec un mélange d’acide nitrique et perchlorique (3/1, v/v) (Cottenieet al., 1982). La minéralisation par voie humide utilise le pouvoir oxydant des acides forts. La matière sèche est attaquée à froid par un mélange acide perchlorique-acide nitrique, puis digérée par chauffage jusqu’à décomposition de la matière organique qui se dégage sous forme de gaz CO2 et vapeurs nitreuses brunes. La minéralisation est considérée comme terminée quand le mélange devient clair. Les concentrations en Cr et en Cu sont déterminées par un spectrophotomètre d’absorption atomique à flamme (SpectreAA200, VARIAN). L’appareil est étalonné par des solutions étalons AATrinitron (Prolabo) 1000 ± 5ppm, dans l’acide nitrique, prête à l’emploi. Ces solutions sont diluées pour préparer des étalons selon la longueur d’onde et la gamme d’analyse choisies. Après l’étalonnage de l’appareil, des standards sont analysés pour tester sa fiabilité. L’appareil est étalonné avant chaque usage et des standards sont analysés avant et après les analyses des échantillons.
Le facteur de bioaccumulation (FBC) est estimé par :
FBC = [Cu ou Cr dans la plante µg g‑1]/[Cu ou Cr dans la solution nutritive initiale mg/L].
Les analyses statistiques (test de comparaison multiples de Bonferroni et analyse de la variance) ont été réalisées avec le logiciel SPSS12.0 pour Windows.
3. Résultats et discussion
3.1 Toxicité et tolérance
Les résultats obtenus montrent une sensibilité différente vis‑à‑vis du Cu et du Cr sous les mêmes conditions expérimentales. D’une manière générale, L. minor est plus sensible que L. gibba et le Cu est plus toxique que le Cr chez les deux espèces. Zayedet al. (1998) sont arrivés aux mêmes conclusions chez L. minor, pour des concentrations comprises entre 0,1 et 10 mg/L.
3.2 Effet du Cuivre
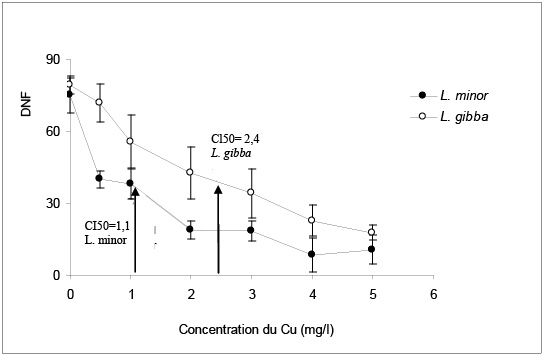
Les deux espèces sont sensibles au cuivre. En effet, on observe une inhibition hautement significative de la croissance exprimée aussi bien par la multiplication des frondes (NF) que par la biomasse (PF), en réponse au gradient de concentration utilisé (Tableau 1). Cependant, L. minor est nettement plus sensible que L. gibba. La croissance chez L. minor est affectée d’une manière plus importante. Par exemple, le temps de dédoublement des colonies est supérieur à quatre jours pour la concentration de 1 mg Cu/L, alors que pour L. gibba ceci n’est observé qu’à partir de 3 mg Cu/L (Tableau 2). Les paramètres toxicologiques reflètent cette observation : L. minor présente à la fois une CSEO et une CI50 inférieures à celles de L. gibba (Tableau 3, Figure 1). En effet, la CI50 estimée à partir de l’accroissement du nombre de frondes (DNF) est de 1,1 chez L. minor, alors qu’elle est égale à 2,4 mg/L chez L. gibba. L’ordre de grandeur de ce paramètre chez L. minor est tout à fait compatible avec les valeurs existantes dans la littérature. En effet, la CI50 a été estimée chez cette espèce à 0,1 mg/L (Nasuet al., 1984), 1,1 mg Cu/L (Wang, 1990) et 0,25‑0,29 mg/L (Buckley, 1994).
L’effet du Cu sur le NF est tel que, pour L. minor, toutes les concentrations testées sont phytotoxiques. En absence de Cu, le NF est d’environ 115 frondes, alors qu’en présence de 1 mg Cu/L, il chute à moins 80 de frondes. À la différence de L. minor, chez L. gibba, l’effet de la concentration 0,5 mg Cu/L sur le NF est non significatif (p > 0,05). En comparant la réponse des deux espèces en matière de pourcentage d’inhibition par rapport au témoin, à 0,5 mg Cu/L, L. minor présente 31 %, contre 6 % seulement chez L. gibba. Toutefois, à forte concentration (5 mg Cu/L), l’écart est moins important entre les deux espèces et le NF est réduit à 56 et 52 % respectivement chez L. minor et L. gibba.
L’effet du Cu sur le PF est similaire à celui observé au niveau du NF. Chez L. minor, toutes les concentrations testées (p < 0,05, Tableau 1) ont un effet significatif. Le taux d’inhibition avoisine les 60 % à 0,5 mg Cu/L, alors que, chez L. gibba, l’effet du même traitement est non significatif (p > 0,05). À forte concentration (5 mg Cu/L), le PF est réduit à 73 et 56 % respectivement chez L. minor et L. gibba.
Comparativement à L. minor, ces résultats montrent une tolérance plus élevée à la contamination par le Cu chez L. gibba.
Tableau 1
Nombre de frondes et poids frais de L. minor et L. gibba après 4 jours de traitement au cuivre et au chrome, suivi du pourcentage d’inhibition. Les valeurs représentées sont les moyennes ± erreur standard (n = 5). Les moyennes suivies de la même lettre ne sont pas significativement différentes selon le test de Bonferroni (p < 0,05). ANOVA : analyse de la variance à un seul facteur; *** montre des différences significatives à p < 0,001.
Number of fronds and fresh weight of L. minor and L. gibba after 4 days of growth in Cu and Cr treatments, followed by the percent of inhibition. Values represented are means ± standard error (n = 5). Mean values followed by the same letter are not significantly different according to the Bonferroni test (p < 0.05). A one-way ANOVA shows significant difference at: *** p < 0.001.
Tableau 2
Temps de doublement des frondes exprimé en jours chez L. minor et L. gibba en fonction des différents traitements en cuivre (Cu) et en chrome (Cr). #, signifie que le temps est supérieur à quatre jours.
Doubling time for frond growth in L. minor and L. gibba expressed in days as function of Cu and Cr treatments. The symbol # means that the doubling time is greater than 4 days.
Tableau 3
Paramètres toxicologiques estimés à partir de la multiplication des frondes. CSEO : concentrations sans effet observé. CI50 : concentration causant 50 % d’inhibition de la croissance. Les valeurs sont exprimées en mg/L.
Toxicological parameters estimated from frond multiplication. NOED (no observed effect concentration) and IC50 (estimated concentrations that inhibit plant growth by 50%). Values are expressed in mg/L.
Figure 1
Effet du cuivre (Cu) sur la multiplication des frondes estimée par le DNF chez L. minor et L. gibba et estimation de l’IC50.
Effect of copper (Cu) on frond multiplication in L. minor and L. gibba and estimation of the IC50.
3.3 Effet du Chrome
De même que pour le cuivre, les deux espèces sont sensibles au gradient de concentrations utilisé (Tableau 1) et l’analyse de la variance montre une réduction très significative (p < 0,001) aussi bien du NF que du PF, chez les deux espèces (Tableau 1).
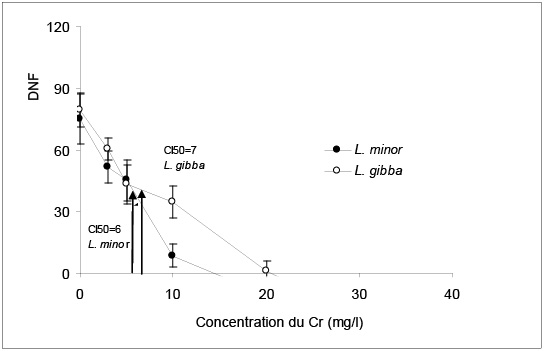
Figure 2
Effet du chrome (Cr) sur la multiplication des frondes (NF) estimée par le DNF chez L. minor et L. gibba et estimation de l’IC50.
Effect of chromium (Cr) on frond multiplication in L. minor and L. gibba and estimation of the IC50.
L. minor est plus sensible au Cr que L. gibba, mais d’une façon moins marquée que pour le Cu (Figure 2). En effet, le temps de dédoublement des colonies (Tableau 2) et la valeur de la CSEO (Tableau 3) sont similaires pour les deux espèces, alors que l’CI50 de L. minor est inférieure à celle de L. gibba.
La comparaison du taux d’inhibition confirme une légère sensibilité de L. minor. En effet, pour le NF, en présence de 3 mg Cr/L, on observe une inhibition de l’ordre de 20 % chez L. minor alors que chez L. gibba elle est seulement de l’ordre de 16 % (Tableau 1). De même, au niveau du PF et pour le même traitement de Cr, le taux d’inhibition est de 49 et 36 % respectivement chez L. minor et L. gibba. Le CI50 correspond à 6 mg/L chez L. minor et à 7 mg/L chez L. gibba. Ces valeurs sont plus faibles que celle présentée par WANG (1990) et qui est égale à 35 mg Cr/L chez L. minor.
Cependant, il faut noter que les comparaisons avec les données bibliographiques sont à relativiser, car la mesure de la sensibilité aux métaux peut être influencée par plusieurs facteurs liés directement à la nature des dispositifs expérimentaux utilisés. Par exemple, il a été démontré chez une autre espèce de lentille d’eau, Lemna paucicostata, que le pH, la composition de la solution nutritive et la température peuvent affecter la sensibilité (NASU et KUGIMOTO, 1981). La durée du traitement est également un paramètre important dans ce type d’expérimentation et peut influencer la mesure de la sensibilité des plantes aux métaux. Ainsi, chez Lemna valdiviana, le traitement d’une semaine au Cd engendre 50 % d’inhibition de la croissance à 0,2 mg Cd/L, mais, à deux semaines, on obtient le même résultat à seulement 0,03 mg Cd/L (HUTCHINSON et CZYRSKA, 1975).
3.4 La bioaccumulation
Nos résultats (Tableaux 4 et 5) montrent que l’accumulation du Cr est plus importante que celle du Cu, les deux espèces accumulant les deux métaux à des taux différents. Pour une même concentration de Cu et de Cr (3 et 5 mg/L), le Cr est accumulé beaucoup plus que le Cu. Par exemple, à 5 mg/L, L. minor et L. gibba, accumulent des teneurs de l’ordre de 1 340 et 1 060 µg Cr g‑1, alors qu’au même traitement du Cu, elles ne contiennent que 800 et 745 µg Cu g‑1 respectivement.
Tableau 4
Concentration du cuivre (Cu) dans les tissus et facteur de bioconcentration (FBC) chez L. minor et L. gibba. Les moyennes suivies de la même lettre ne sont pas significativement différentes selon le test de Bonferroni (p < 0,05). ANOVA : analyse de la variance à un seul facteur; *** montre des différences significatives à p < 0,001.
Tissue Cu concentrations and bioconcentration factor (BCF) in L. minor and L. gibba. Mean values followed by the same letter are not significantly different according to the Bonferroni test (p < 0,05). A one-way ANOVA shows significant difference at: *** p < 0.001.
Tableau 5
Concentration du chrome (Cr) dans les tissus et facteur de bioconcentration (FBC) chez L. minor et L. gibba. Les moyennes suivies de la même lettre ne sont pas significativement différentes selon le test de Bonferroni (p < 0,05). ANOVA : analyse de la variance à un seul facteur; *** montre des différences significatives à p < 0,001.
Tissue Cr concentrations and bioconcentration factors (BCF) in L. minor and L. gibba. Mean values followed by the same letter are not significantly different according to the Bonferroni test (p < 0.05). A one-way ANOVA shows significant difference at: *** p < 0.001.
Il faut rappeler que le Cu diffère du Cr par le fait qu’il s’agit d’un élément essentiel de la nutrition minérale des plantes (PUNZ et SIEGHARD, 1993; RASKIN et al., 1994). L’interaction du Cu avec des processus vitaux comme les réactions redox dans les mitochondries et les chloroplastes (UAUY et al., 1998) pourrait expliquer cette différence de toxicité. Les teneurs des tissus en métaux atteignent des valeurs maximales au niveau des traitements à concentrations élevées : 5 mg/L pour le Cu et 10 mg/L pour le Cr (Tableaux 4 et 5).
Les teneurs les plus élevées en Cu sont de l’ordre de 800 µg g‑1 chez L. minor et 745 µg g‑1 chez L. gibba. Ces valeurs sont inférieures à celles obtenues pour l’accumulation du Cu chez L. minor dans des travaux antérieurs. En effet, suivant les traitements, elles peuvent être d’environ 15 000 µg g‑1 (BASSI et SHARMA, 1993), 5 230 µg g‑1 après un traitement de 10 jours avec 8 mg Cu/L (JAIN et al.,1989) ou 3 360 µg g‑1 à 10 mg Cu/L (ZAYED et al., 1998), ainsi que des concentrations variant entre 250 et 4500 µg g‑1 à 0,2‑10 mg Cu/L (DIRILGEN et INEL, 1994; JAIN et al., 1988; 1989). Par contre, d’autres espèces de macrophytes montrent un potentiel d’accumulation nettement inférieur à celui des lentilles d’eau. Par exemple, Eichhornia crassipes exposée au même type de traitement accumule dans ses tissus foliaires seulement 100 µg Cu g-1 (ZHU et al., 1999). Polygonum hydropiperoides accumule une teneur maximale égale à 95 µg Cu g‑1, après 10 jours d’exposition à 1 mg Cu/L (QIAN et al., 1999).
Pour le Cu, le FBC obtenu varie suivant le traitement de 160 à 380 chez L. minor et de 149 à 323 chez L. gibba. D’autres auteurs ont donné des estimations variables du FBC pour le Cu chez L. minor : 200‑800 (ZAYED et al., 1998), 3 000 (BASSI et SHARMA, 1993) et variant entre 696 et 1 655 (JAIN et al., 1988; 1989). Par comparaison aux autres espèces, les FBC obtenus dans ce travail sont supérieurs à ceux observés chez Typha spp. et Spartina spp. (ALBERTS et al., 1990; TAYLOR et CROWDER, 1983). Ces résultats confirment que L. minor et L. gibba pourraient être de bonnes accumulatrices de Cu comparativement aux autres espèces de macrophytes, comme Eichhornia crassipes, Polygonum hydropiperoides, Typha spp. et Spartina spp.
Les concentrations des plantes en Cr obtenues dans ce travail varient entre 808‑2 140 µg mg‑1 chez L. minor et entre 761-1 710 µg g‑1 chez L. gibba. ZAYED et al. (1998) ont obtenu des résultats similaires chez L. minor, avec des teneurs de l’ordre de 40-2 870 µg g‑1 à 0,1‑10 mg Cr/L. D’autres espèces de macrophytes peuvent accumuler le Cr à des taux variables, moins importants, comme le cas de E. crassipes avec seulement 120 µg g‑1 à 10 mg Cr/L (ZHU et al., 1999), ou au contraire de même niveau, avec 2 092 µg g‑1 chez Nymphea alba, après quatre jours de traitement à 10 mg Cr/L (VAJPAYEE et al., 2000).
Les FBC obtenus pour le chrome varient entre 214 et 269 chez L. minor et entre 171 et 254 chez L. gibba. Ils sont comparables à ceux estimés chez L. minor et variant entre 280 et 660 par ZAYED et al. (1998). MALLICK et al. (1996) ont conclu que L. minor est plus efficace pour l’accumulation du Zn et du Cr que Azolla pinnata. On constate ainsi que L. minor et L. gibba pourraient être de bonnes accumulatrices de Cr comparativement à certaines espèces de macrophytes aquatiques.
Les teneurs accumulées en Cr et en Cu par L. minor sont supérieures à celles accumulées par L. gibba. Cependant, si on tient compte de la production potentielle de biomasse chez les deux espèces, les potentialités de L. gibba seraient largement supérieures. En effet, la production de biomasse est plus importante chez cette espèce. Elle a été estimée à 160,95 ± 8,35 et 44,49 ± 3,30 g de PS m‑2 respectivement chez L. gibba et L. minor (ENNABILI et ATER, 1997). Si on considère le cas purement théorique d’un effluent dont les concentrations en Cr et en Cu seraient : 1 mg/L de Cu et 3 mg/L de Cr, les taux de rétention espérés seraient d’environ 8,99 mg Cr m‑2 j‑1 pour L. minor contre 30,62 mg Cr m‑2 j‑1 pour L. gibba et de l’ordre de 4,23 mg de Cu m‑2 j‑1 pour L. minor contre 12,95 mg de Cu m‑2 j‑1 chez L. gibba. Ainsi, nous pouvons dire que L. gibba serait plus efficace que L. minor pour la phytoreméditaion du Cu et du Cr. Dans une étude similaire, le taux d’accumulation du Cu et du Cr chez L. minor a été estimé respectivement à environ 250‑667 et 80‑333 mg j‑1 m‑2 (WAHAAB et al., 1995), donc des teneurs largement supérieures à celles estimées dans ce travail.
On constate ainsi, que L. minor et L. gibba pourraient être de bonnes accumulatrices de Cr comparativement à certaines espèces de macrophytes aquatiques. D’autant plus que les espèces accumulant les métaux à des teneurs supérieures à 1 000 µg mg‑1, peuvent être considérées comme hyper-accumulatrices (BAKER et al., 1989; REEVES et al., 1996).
4. Conclusions
D’une manière générale, les résultats obtenus confirment que le Cu est plus toxique que le Cr et que les deux espèces de lentilles d’eau ont des seuils de tolérance différents, L. minor étant plus sensible que L. gibba pour les deux métaux.
Les teneurs en Cu et en Cr dans les tissus augmentent avec la concentration du métal. Les teneurs les plus élevées sont observées dans les traitements avec les plus fortes concentrations utilisées : 5 mg Cu/L et 10 mg Cr/L. Par contre, le FBC diminue avec la concentration du traitement; les valeurs les plus élevées sont observées pour les plus faibles traitements (1 mg Cu/L et 3 mg Cr/L). Ceci signifie que pour des applications éventuelles en phytoremédiation, l’utilisation potentielle de ces deux espèces serait plus efficiente pour de faibles niveaux de contamination.
Les deux espèces accumulent les deux métaux à des taux différents. L’accumulation du Cr est plus importante que celle du Cu et L. minor montre des taux d’accumulation supérieurs. Pour le cuivre, elles sont de l’ordre de 800 µg g‑1 obtenues avec le traitement à 5 mg Cu/L. Pour le Cr, elles sont d’environ 2 140 µg g‑1 obtenues à 10 mg Cr/L. Par contre, chez L. gibba, les concentrations maximales obtenues sont 745 µg g‑1 et 1 710 µg g‑1 respectivement pour les traitements de 5 mg Cu/L et de 10 mg Cr/L. De même, les FBC estimés chez L. minor sont supérieurs à ceux de L. gibba.
Comparées à d’autres espèces de macrophytes, les lentilles d’eau montrent un potentiel d’accumulation fort intéressant. En effet, pour le cuivre, il est nettement supérieur à celui d’autres espèces comme Eichhornia crassipes et Polygonum hydropiperoides. De même, les FBC obtenus sont supérieurs à ceux observés chez Typha spp. et Spartina spp. Ces résultats confirment que L. minor et L. gibba pourraient être de bonnes accumulatrices de Cu comparativement à d’autres espèces de macrophytes. Pour le chrome, les autres espèces de macrophytes peuvent l’accumuler à des taux variables : moins important que les lentilles d’eau, comme le cas de E. crassipes, similaire comme le cas de Nymphea alba ou au contraire supérieur comme c’est le cas de Azolla pinnata. Les teneurs en Cr accumulées par les deux espèces justifieraient alors leur classement comme espèces hyperaccumulatrices.
Tenant compte de la tolérance, de la capacité d’accumulation et de la productivité en biomasse, L. gibba montre des potentialités réelles pour d’éventuelles applications dans les technologies de phytoremédiation, et spécialement la rhizofiltration des eaux usées contaminées par du cuivre et du chrome.
Parties annexes
Références
- ALBERTS J.J., PRICE M.T., KANIA M., 1990. Metal concentrations in tissues of Spartina alterniflora (Loisel.) and sediments of Georgia salt marshes. Estuar. Coast. Shelf Sci., 30, 47-58.
- BAKER A.J.M., BROOKS R., REEVES R., 1989. Growing for gold and copper and zinc. New Sci., 1603, 44‑48.
- BASSI M., CORRADI M.G., REALINI M., 1990. Effects of chromium (VI) on two freshwater plants, Lemna minor and Pistia stratiotes, I. Morphological observations. Cytobios, 62, 27-38.
- BASSI R., SHARMA S.S., 1993. Changes in proline content accompanying the uptake of zinc and copper by Lemna minor. Ann. Bot., 72, 151-154.
- BRAUN M., 1995. L’épuration des eaux usées par lagune à Lemna. N.S.T., 13, 261-267. (à compléter)
- BRIX H., 1993. Wastewater treatment in constructed wetlands: system design, removal processes, and treatment performance. Dans : Constructed Wetlands for Water Quality Improvement, MOSHIRI G.A. (Éditeur), Lewis Publishers, 9-22.
- BRYLER-ISKANE-SHELADIA (groupement d’étude), 1992. Étude du schéma directeur d‘assainissement liquide de la ville de Tétouan, synthèse de la mission A. Municipalité de Tétouan. Maroc.
- BUCKLEY J.A., 1994. Bioavailability of copper in wastewater to Lemna minor with biological and electrochemical measures of complexation. Water Res., 28, 2457‑2467.
- COTTENIE A., VERLOO M., KIEKENS L., VELGHE G., CAMERLYNCK R., 1982. Chemical analysis of plants and soils. Lab. Analytical and Agrochemistry State University, Ghent. Belgium.
- DEMCHIK M., GARBUTT K., 1999. Growth of woolgrass in acid mine drainage. J. Environ. Qual., 28, 243-249.
- DIRILGEN N., INEL Y., 1994. Effects of zinc and cooper on growth and metal accumulation in duckweed Lemna minor L. Bull. Environ. Contam. Tox., 35, 442-447.
- DUNBABIN Y.S., BOWMER K.H., 1992. Potential use of constructed wetlands for treatment of industrial wastewaters containing metals. Sci. Total Environ., 111, 151-168.
- ELLIS J.B., SHUTES R.B, REVITT D.M., ZHANG T.T., 1994. Use of macrophytes for pollution treatment in urban wetlands. Resour. Conserv. Recy., 11, 1-12.
- ENNABILI A., ATER M. 1997. Phytoécologie et productivité de quelques macrophytes du marais Smir. Dans : Les marais de Smir‑Restinga, écologie et propositions d’aménagement, ATER M. et DAKKI M. (Éditeurs). Trav. Inst. Sci., Mém. hors série, Rabat, Maroc, 27-37.
- ENNABILI A., ATER M., 1996. Flore (Pteridophyta et Spermatophyta) des zones humides du Maroc méditerranéen : Inventaire et Écologie. Acta Bot. Malacita., 21, 221-239.
- EZZAHRI J., ENNABILI A., ATER M., RADOUX M., 2001. Épuration extensive des eaux usées urbaines : expérimentation sous‑climat méditerranéen (M’diq, Nord-Ouest du Maroc). Ann. Chim-Sci. Mat., 26, S297-S311.
- Gijzen, H.J. et Veenstra, S., 2000. Duckweed-based wastewater treatment for rational resource recovery and reuse. Dans : Environmental Biotechnology and Cleaner Bioprocesses, Part II: Recycling and Treatment of Organic Wastes. Taylor and Francis, Philadelphie, 83‑100.
- HARTMAN W.A., MARTIN D.B., 1985. Effect of four agricultural pesticides on Daphnia pulex, Lemna minor and Potamogeton pectinatus. Bull. Environ. Contam. Tox., 35, 646‑651.
- HELFIELD J.M., DIAMOND M.L., 1997. Use of constructed wetlands for urban stream restoration: a critical analysis. Environ. Manage., 21, 329-341.
- HEWITT E.J., 1966. Sand and water culture methods used in the study of plant nutrition, 2nd edition, Commonwealth Agricultural Bureaux, Farnham, Buckhimhamshire, UK. Technical communication, No 22, 477.
- HUANG X.D., DIXON D.G., GREENBERG B.M., 1995. Increased polycyclic aromatic hydrocarbon toxicity following their photomodification in natural sunlight. Dans : Impacts on Duckweed Lemna gibba L. G3. Ecotox. Environ. Saf., 32, 194-200.
- HUTCHINSON T.C., CZYRSKA H., 1975. Heavy metals toxicity and synergism to floating aquatic weeds. Verh. Int. Verein. Limnol., 19, 2101-2111.
- JAIN S.K., GUJRAL G.S., JHA N.K., VASUDEVAN P., 1988. Heavy metal uptake by Pleurotus sajor-caju from metal-enriched duckweed substrate. Biol. Waste, 24, 275-282.
- JAIN S.K., VASUDEVAN P., JHA N.K., 1989. Removal of some heavy metals from polluted water by aquatic plants, studies on duckweed and water velvet. Biol. Waste, 28, 115‑126.
- JENNER H.A., JANSSEN MOMMEN J.P.M., 1993. Duckweed Lemna minor as a tool for testing toxicity of coal residues and polluted sediments. Arch. Environ. Contam. Tox., 25, 3-11.
- KIVAISI A.K., 2001. The potential for constructed wetlands for wastewater treatment and reuse in developing countries: a review. Ecol. Eng., 16, 545-560.
- MALLICK N., SHARDEN D.U., RAIL C., 1996. Removal of heavy metals by two free floating aquatic macrophytes. Biomed. Environ. Sci., 9, 399-407.
- MANDI L., 1994. Marrakesh waste water purification experiment using aquatic plants Echornia crassipes and Lemna gibba. Water Sci. Technol., 283-287.
- MATHIS B.J., CUMMINGS T.F., GOWER M., TAYLOR M., KING C., 1980. Dynamics of manganese cadmium and lead. Dans : Experimental power plant ponds. Hydrobiologia., 67, 197-206.
- MEAGHER R.B., 2000. Phytoremediation of toxic elemental and organic pollutants. Curr. Opin. Plant Biol., 3, 153-162.
- MO S.C., CHOI D.S., ROBINSON J.W., 1989. Uptake of mercury from aqueous solution by duckweed, the effects of pH, copper and humic acid. J. Environ. Sci. Health A, 24, 135‑146.
- MOHAN B.S., HOSETTI B.B., 1997. Potential phytotoxicity of lead and cadmium to Lemna minor grown in sewage stabilisation ponds. Environ. Pollut., 2, 233-238.
- MUNGUR A.S, SHUTES R.B.E., REVITT D.M., HOUSE M.A., 1995. An assessment of metal removal from highway runoff by a natural wetland. Water Sci. Technol., 32, 169-175.
- NASU Y., KUGIMOTO M., 1981. Lemna (Duckweed) as an indicator of water pollution. I The sensivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Tox., 10, 159‑169.
- NASU Y., KUGIMOTO M., TANAKA O., TAKIMOTO A., 1984. Lemna as an indicator of water pollution and the absorption of heavy metals by Lemna. Fresh Water Biological Monitoring, Cardiff, UK, 113-120, QH, 96, A3. F73, compte rendu.
- O.N.E.P., 1988. Contrôle de la pollution des eaux. Rapport, Office National de l’Eau Potable, Maroc.
- ORON G., DE VERGT A., PORATH D., 1987. The role of the operation regime in waste water treatment with duckweed. Water Sci. Technol., 19, 97-105.
- ORON P., PORATH D., 1987. Performance of the duckweed species Lemna gibba on municipal wastewater for effluent renovation and protein production. Biotechnol. Bioeng., XXIX, 258-268.
- PUNZ W., SIEGHARDT H., 1993. The responce of roots of herbacous plant species to heavy metals. Environ. Exp. Bot., 33, 85-98.
- QIAN J.H., ZAYED A., ZHU Y.L., YU M., TERRY N., 1999. Phytoaccumulation of trace elements by wetland plants: III. Uptake and accumulation of ten trace elements by twelve plant species. J. Environ. Qual., 28, 1448-1455.
- RASKIN I., SMITH R.D., SALT D.E., 1997. Phytoremediation of metals: using plants to remove pollutants from the environment. Curr. Opin. Plant Biol., 8, 221-226.
- RASKIN I., KUMAR P.N., DUSHENKOV S., ESALT D., 1994. Bioconcentration of heavy metals by plants. Curr. Opin. Plant Biol., 5, 285-290.
- REEVES R.D., BAKER A.J.M., BROOKS R.R., 1996. Abnormal accumulation of trace metals by plants. Mining Environ. Manage., 3 , 4-8.
- STROTHER S., 1981. Toxic effects of exogenous sorbose on Lemna minor and some other angiosperm. Ann. Bot.‑London, 47, 531-533.
- TAYLOR G.J., CROWDER A.A., 1983. Uptake and accumulation of heavy metals by Typha latifolia in wetlands of Sudbury, Ontario region. Can. J. Botany, 61, 63-73.
- TKALEC M., VIDAKOVIC CIFREK Z., REGULA I., 1998. The effect of oil industry «high density brines» on duckweed Lemna minor L. Chemosphere., 13, 2703-2715.
- UAUY R., OIVARES M., GONZALES M., 1998. Essentiality of copper in humans. Am. J. Clin. Nutr., 67 (Suppl.), 952S-960S.
- VAJPAYEE P., TRIPATHI R.D., RAI U.N., ALI M.B., SINGH S.N., 2000. Chromium (VI) accumulation reduces chlorophyll biosynthesis, nitrate reductase activity and protein content in Nymphaea alba L. Chemosphere, 41, 1075-1082.
- VERHOEVEN J.T.A., MEULEMAN A.F.M., 1999. Wetlands for wastewater treatment: Opportunities and limitations. Ecolog. Eng., 12, 5-12.
- VYMAZAL J., BRIX H., COOPER P.F., HABERL R., PERFLER R., LABER J., 1998. Removal mechanisms and types of constructed wetlands. Dans : Constructed Wetlands for Wastewater Treatment in Europe, VYMAZAL J., BRIX H., COOPER P.F., GREEN M.B. and HABERL R. (Éditeurs), 17-66.
- WAHAAB R.A., LUBBERDING H.J., ALAERTS G.J., 1995. Copper and chromium (III) uptake by duckweed. Water Sci. Technol., 11, 105-110.
- WANG W., 1986. Toxicity tests of aquatic pollutants by using common Duckweed. Environ. Pollut. B, 11, 1-14.
- WANG W., 1990. Literature review on higher plants for toxicity testing. Water Air Soil Pollut., 59, 381-400.
- ZAYED A., GOWTHAMAN S., TERRY N., 1998. Phytoaccumulation of trace elements by wetland plants: I. Duckweed. J. Environ. Qual., 27, 715-721.
- ZHU Y.L., ZAYED A.M., QIAN J.H., DE SOUZA M., TERRY N., 1999. Phytoaccumulation of trace elements by wetland plants: II Water hyacinth. J. Environ. Qual., 28, 339-344.
Liste des figures
Figure 1
Effet du cuivre (Cu) sur la multiplication des frondes estimée par le DNF chez L. minor et L. gibba et estimation de l’IC50.
Effect of copper (Cu) on frond multiplication in L. minor and L. gibba and estimation of the IC50.
Figure 2
Effet du chrome (Cr) sur la multiplication des frondes (NF) estimée par le DNF chez L. minor et L. gibba et estimation de l’IC50.
Effect of chromium (Cr) on frond multiplication in L. minor and L. gibba and estimation of the IC50.
Liste des tableaux
Tableau 1
Nombre de frondes et poids frais de L. minor et L. gibba après 4 jours de traitement au cuivre et au chrome, suivi du pourcentage d’inhibition. Les valeurs représentées sont les moyennes ± erreur standard (n = 5). Les moyennes suivies de la même lettre ne sont pas significativement différentes selon le test de Bonferroni (p < 0,05). ANOVA : analyse de la variance à un seul facteur; *** montre des différences significatives à p < 0,001.
Number of fronds and fresh weight of L. minor and L. gibba after 4 days of growth in Cu and Cr treatments, followed by the percent of inhibition. Values represented are means ± standard error (n = 5). Mean values followed by the same letter are not significantly different according to the Bonferroni test (p < 0.05). A one-way ANOVA shows significant difference at: *** p < 0.001.
Tableau 2
Temps de doublement des frondes exprimé en jours chez L. minor et L. gibba en fonction des différents traitements en cuivre (Cu) et en chrome (Cr). #, signifie que le temps est supérieur à quatre jours.
Doubling time for frond growth in L. minor and L. gibba expressed in days as function of Cu and Cr treatments. The symbol # means that the doubling time is greater than 4 days.
Tableau 3
Paramètres toxicologiques estimés à partir de la multiplication des frondes. CSEO : concentrations sans effet observé. CI50 : concentration causant 50 % d’inhibition de la croissance. Les valeurs sont exprimées en mg/L.
Toxicological parameters estimated from frond multiplication. NOED (no observed effect concentration) and IC50 (estimated concentrations that inhibit plant growth by 50%). Values are expressed in mg/L.
Tableau 4
Concentration du cuivre (Cu) dans les tissus et facteur de bioconcentration (FBC) chez L. minor et L. gibba. Les moyennes suivies de la même lettre ne sont pas significativement différentes selon le test de Bonferroni (p < 0,05). ANOVA : analyse de la variance à un seul facteur; *** montre des différences significatives à p < 0,001.
Tissue Cu concentrations and bioconcentration factor (BCF) in L. minor and L. gibba. Mean values followed by the same letter are not significantly different according to the Bonferroni test (p < 0,05). A one-way ANOVA shows significant difference at: *** p < 0.001.
Tableau 5
Concentration du chrome (Cr) dans les tissus et facteur de bioconcentration (FBC) chez L. minor et L. gibba. Les moyennes suivies de la même lettre ne sont pas significativement différentes selon le test de Bonferroni (p < 0,05). ANOVA : analyse de la variance à un seul facteur; *** montre des différences significatives à p < 0,001.
Tissue Cr concentrations and bioconcentration factors (BCF) in L. minor and L. gibba. Mean values followed by the same letter are not significantly different according to the Bonferroni test (p < 0.05). A one-way ANOVA shows significant difference at: *** p < 0.001.