Résumés
Résumé
En vue d’améliorer le processus de désinfection des eaux (usées et potables) par irradiation UV-C, une lampe UV-C à vapeur de mercure à basse pression est mise en fonctionnement en utilisant deux types d’alimentation électronique : une alimentation électronique traditionnelle de 50 Hz, et une alimentation électronique modifiée à haute fréquence de 64 KHz. L’exploitation des résultats de la cinétique d’inactivation bactérienne par un modèle de simulation mathématique, le modèle de « Series-Events », a permis de mettre en relief l’amélioration du processus de traitement par irradiation UV, en utilisant une lampe UV à basse pression, alimentée à haute fréquence. Cette amélioration est traduite par l’augmentation de l’abattement bactérien avec une réduction notable du temps d’exposition UV par rapport à celui déterminé après une irradiation par une lampe UV-C classique. En plus, la détermination du coefficient de réactivation bactérienne (Cr), après la mise en repos des bactéries postirradiées en présence et ou en absence de la lumière visible, montre une inactivation irréversible des bactéries testées par les mécanismes de réactivation photodépendants et photoindépendants, dans le cas d’irradiation par une lampe UV-C alimentée à haute fréquence. L’augmentation de l’abattement irréversible des bactéries testées à un temps d’exposition réduit est en rapport direct avec l’augmentation du flux spectral UV monochromatique de la raie 253,7 nm fourni par la lampe UV à basse pression, alimentée à haute fréquence (64 KHz). Cette augmentation de flux UV de germicide permet de surmonter les inconvénients liés à l’utilisation d’une lampe UV conventionnelle, à savoir la détermination de la dose létale et le problème de réactivation bactérienne après traitement par la lumière ultraviolette.
Mots-clés :
- irradiation UV,
- lampe UV-C à basse pression,
- alimentation électronique,
- cinétique d'inactivation bactérienne,
- réactivation bactérienne
Abstract
In order to improve the process of water disinfection (waste water and drinking water) by UV-C irradiation, a low pressure UV lamp was supplied by two types of electronic power: traditional power at 50 Hz and high frequency power at 64 KHz. The simulation of bacterial inactivation kinetics using a mathematical model of « series-events » demonstrated the ability of the high frequency UV lamp to provide an effective UV dose capable of inactivating bacteria over a shorter exposure time than that determined for a conventional UV-C lamp. Moreover, the determination of bacterial reactivation factor (Cr) after a rest time in the presence and or in absence of visible light showed an irreversible inactivation in the tested bacteria of the photo-dependent and photo-independent reactivation mechanisms in the case of irradiation by the high frequency UV-C lamp. The increase in the bacterial inactivation without subsequent reactivation, for a reduced time of UV exposure, is consistent with the increase of the monochromatic UV spectral radiant flux at 253,7 nm provided by the high frequency power supply UV-C lamp (64 KHz). The increase of germicidal UV flux overcomes the disadvantages related to the use of a conventional UV lamp, namely the determination of a lethal dose and problems related to bacterial reactivation after treatment by ultraviolet light.
Keywords:
- UV irradiation,
- UV low pressure lamp,
- eletronic power,
- bacterial inactivation kinetics,
- bacterial reactivation
Corps de l’article
1. Introduction
Dans cette étude, nous nous intéresserons en particulier à la qualité bactériologique de l’eau et aux moyens qui nous permettent de minimiser tout risque de contamination des eaux par les microorganismes pathogènes.
Pour des raisons sanitaires, économiques et environnementales, il s'avère donc nécessaire de réduire la contamination microbienne des eaux. La désinfection des eaux de sources ponctuelles est une façon efficace d’y parvenir.
La désinfection de l’eau est considérée comme une étape primordiale ayant pour but de minimiser tout risque d’infection par les microorganismes pathogènes et d’empêcher ainsi la diffusion de maladies d’origine hydrique (Gerbaet al., 2003; LeChevallier et au, 2004).
Il existe actuellement différentes méthodes de désinfection de l’eau, à savoir des techniques qui se basent sur des processus chimiques, à savoir l’utilisation de substances oxydantes à haut pouvoir désinfectant comme le chlore, le dioxyde de chlore, l’ozone et le brome (Bakeret al., 2002). Il existe aussi des méthodes de traitement physiques, comme la désinfection de l’eau par irradiation ultraviolette à une longueur d’onde germicide.
Chaque technique de désinfection de l’eau présente ses avantages et ses inconvénients. Généralement, le choix d’une technique de désinfection de l’eau est établi en considérant de nombreuses contraintes d’ordres technique, économique et environnemental. En ce sens, le mode de désinfection idéal est celui qui regroupe les caractéristiques suivantes : (i) efficacité de traitement pour la plupart des microorganismes pathogènes indépendamment du pH et de la température de l’eau à traiter; (ii) absence de sous-produits indésirables formés à la suite de son utilisation; (iii) produit non dangereux pour les opérateurs (comme l’exposition ou l’inhalation de produits chimiques); (iv) pas de modification de l’homéostasie de l’écosystème aquatique (en cas de rejet de l’eau); (v) facilité d'utilisation; et (vi) faibles coûts d'investissement et d'exploitation.
Le procédé de désinfection le plus connu est la chloration. En effet, le chlore est un oxydant très fort qui réagit principalement avec la plupart des constituants des microorganismes, finissant par perturber l’intégrité cellulaire (ADEPADO et al., 2005). Malgré son efficacité germicide, ce désinfectant chimique peut avoir un impact significatif sur le milieu naturel ainsi que sur la santé publique. En effet, l’utilisation du chlore comme agent désinfectant peut générer, en réaction avec la matière organique de l’eau, des sous-produits organochlorés dont certains sont potentiellement dangereux (Oliveret al., 2005). Ainsi, le recours à un traitement physique par irradiation ultraviolette C (UV-C), à une longueur d’onde germicide de 253,7 nm, permet d’éliminer les inconvénients liés aux désinfectants chimiques.
La désinfection des eaux par les rayonnements UV-C est un procédé de désinfection physique très répandu et employé avec succès dans plusieurs pays du monde.
En plus de l’action germicide des rayonnements UV et l’absence des résiduels toxiques dans l’eau post-traitée, ce désinfectant physique ne modifie par les qualités organoleptiques de l’eau et ne pose pas de problème de dosage, puisque l’irradiation est presque constante dans le temps (Bolton et Henke, 1999).
La source d’irradiation UV-C est la lampe à vapeur de mercure. Il s’agit de lampes à arc électrique provoquant l’excitation des atomes de mercure, puis l’émission de radiations par retour à leur état fondamental. Le spectre d’émission dépend de la pression de mercure dans ces lampes germicides (Bolton et Henke, 1999). On distingue ainsi trois types de lampes : les lampes à basse, moyenne et haute pression. La plus utilisée est la lampe à basse pression, qui émet à une longueur d’onde monochromatique à 253,7 nm, et qui représente le maximum d’effet germicide (Bolton et Henke, 1999).
Lors de l'exposition à l’irradiation UV-C, l’inactivation des microorganismes est attribuée à des réactions photochimiques induites sous l’effet d’une radiation lumineuse dont le spectre d’émission se situe à une longueur d’onde germicide (253,7 nm). L’action directe de l’irradiation UV-C s’exerce sur l’ADN des microorganismes. Ainsi, l’absorption des radiations UV va produire une liaison croisée entre les bases de pyrimidines adjacentes (thymine et cytosine) sur le même brin de l’ADN, générant ainsi les cyclopyrimidines dimères (CPD) (Zimmer et Slawson, 2002). La création de ces photoproduits rend impossible la réplication des microorganismes. Il en résulte la mort cellulaire ou l’apparition d’une génération de mutants non viables ou incapables de se reproduire (Kaoet al., 2005).
La bactérie est parmi les microorganismes vulnérables aux dégâts induits par les UV-C, car outre sa petite taille et sa nature unicellulaire, cette cellule haploïde occupe une place importante et primordiale sur la réplication du génome qui doit être couronnée de succès pour assurer le maintien de l'intégrité cellulaire. Ainsi, la possession de mécanismes de réparation de l’ADN postendommagé par ces rayonnements germicides est un déposant essentiel pour restaurer les processus vitaux, comme la transcription et la réplication du matériel génétique, ce qui limitera, par conséquent, l’efficacité de cette étape de désinfection de l’eau par irradiation UV.
Pour contrecarrer les inconvénients liés à la désinfection des eaux par irradiation UV, à savoir la réactivation et la phototolérance de certaines espèces bactériennes, une actualisation du système d’épuration est proposée. Nous suggérons dans ce travail : (i) de soumettre successivement la lampe UV-C à basse pression à deux types d'alimentation électrique : une alimentation électrique classique à fréquence industrielle de 50 Hz et une alimentation électrique à haute fréquence de 64 KHz; (ii) d’étudier l’influence du mode d’alimentation électrique d’une lampe germicide sur la cinétique d’inactivation bactérienne et les mécanismes de la réactivation photodépendants et photoindépendants.
2. Matériel et méthodes
2.1 Bactéries
En vue de comparer le pouvoir désinfectant de la lampe UV à basse pression alimentée respectivement par une alimentation électronique traditionnelle à 50 Hz et une alimentation électrique à haute fréquence de 64 KHz, on a choisi, comme matériel biologique, deux espèces bactériennes indicatrices d’une pollution fécale des eaux, à savoir la souche d’Enterococcus faecalis (Ent. faecalis) ATCC 19433 et la souche d’Escherichia coli (E. coli) ATCC 25922.
De plus, nous avons choisi de travailler sur deux souches bactériennes, l’une est une bactérie pathogène opportuniste connue pour sa grande tolérance aux radiations UV-C, il s'agit de la souche de Pseudomonas aeruginosa (P. aeruginosa) ATCC 15422, et une bactérie pathogène présentée par la souche de Salmonemlla typhi (S. typhi) ATCC 14028 (ATCC : American Type Culture Collection).
2.2 Description du photoréacteur de laboratoire
Les essais ont été réalisés sur un réacteur conçu dans le cadre du projet Avicenne 093AVI054 au Laboratoire de Traitement et Recyclage des Eaux au Centre de Recherches et des Technologies des Eaux (CERTE). Ce dernier est muni d’un casier coulissant possédant une paillasse pouvant recevoir six boîtes de Pétri à la fois (Figure 1).
Figure 1
Présentation schématique du photoréacteur UV-C.
Figure 1. Schematic presentation of UV-C photo-reactor.
À une hauteur réglable de cette paillasse, une lampe à vapeur de mercure à basse pression est accrochée et insérée dans un réflecteur pour assurer une irradiation homogène sur toute la surface des boîtes. La lampe est alimentée via un ballast électrique.
2.3 Détermination de la dose UV-C
La dose UV absorbée par les microorganismes au cours du processus de désinfection est définie par le produit de l’intensité UV253,7, qui est exprimé en mW•cm-2 par le temps d’exposition des microorganismes au rayonnement exprimé en seconde(s).
Dose UV-C (DUV-C) = Intensité x Temps d’exposition
Au cours de chaque manipulation, l’intensité UV émise par la lampe du photoréacteur a été mesurée à l’aide d’un détecteur spécifique des UV, relié à un radiomètre de type Vilbert Lourmat.
Le flux spectral de la raie 253,7 nm, pour les deux alimentations électroniques traditionnelle et à haute fréquence, est effectué à l’aide d’un spectro-radiomètre.
2.4 Étude de la cinétique d’inactivation bactérienne
La cinétique d’inactivation bactérienne a pour objectif d’estimer le nombre des bactéries viables cultivables avant et après chaque exposition à une dose UV-C (ou flux UV-C). Les souches bactériennes testées sont cultivées dans le milieu de culture Luria-Bertoni (LB). Après une incubation de 18 heures à 37 °C, les suspensions bactériennes sont ensuite centrifugées (Heraeus christ) pendant 5 minutes à 4 500 g. Le culot bactérien est ensuite suspendu dans un volume de 20 mL d’eau physiologique (0,85 % NaCl) stérile et transvasé dans une boîte de Pétri stérile de 90 mm de diamètre et sera exposé à l’irradiation UV-C à des intervalles de temps fractionnés. Après chaque temps d’exposition, la suspension bactérienne est diluée de 10 en 10. Ensuite, un volume fixe de 500 µL de chaque dilution est étalé à la surface d’un milieu gélosé (LB Agar). Un test témoin est envisagé; il s’agit d’un dénombrement des bactéries juste avant exposition à l’irradiation UV. Après une incubation pendant 24 heures à 37 °C, le nombre de colonies apparues, multiplié par le facteur de dilution, correspond au nombre de cellules microbiennes présentes dans le volume analysé de la suspension.
2.5 Étude des mécanismes de reviviscence bactérienne
Chaque suspension bactérienne irradiée par le rayonnement UV-C généré par une lampe UV traditionnelle et/ou alimentée à haute fréquence est répartie dans deux boîtes de Pétri stériles. Ces suspensions bactériennes postirradiées sont au repos à la lumière visible et/ou à l’obscurité pendant deux, quatre, huit et 24 heures. Le dénombrement bactérien s'effectue de la même façon que pour la cinétique d’inactivation.
2.6 Caractéristiques de la lampe UV
La lampe étudiée est d'une puissance de 55 Watt, sa tension d'arc est Uarc = 110 V, son courant d'arc est Iarc = 0,67 A, sa longueur est L = 85 cm, et son diamètre est de 2,5 cm. Les caractéristiques de remplissage sont : gaz tampon (argon) et gaz de travail (mercure).
2.7 Alimentation électronique de la lampe à basse pression
L’alimentation de la lampe à décharge basse pression a permis d’étudier l’évolution des grandeurs électriques. Nous avons alimenté la lampe selon deux modes d’alimentation, soit à l'aide d'un dispositif électrique traditionnel de 50 Hz et par une alimentation électrique à haute fréquence de 64 KHz. Dans les deux cas, nous avons conservé la puissance de la lampe à une valeur de 55 W.
3. Résultats et discussion
3.1 Étude de la cinétique d’inactivation bactérienne irradiée par UV-C
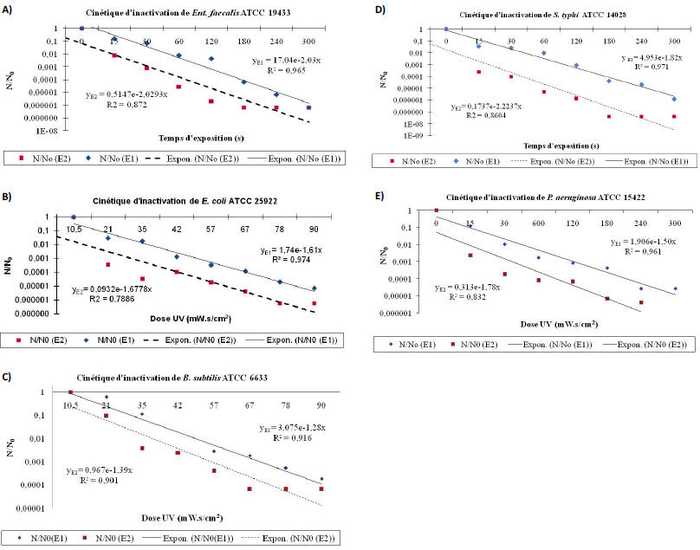
L’étude de la cinétique d’inactivation bactérienne par irradiation UV-C est réalisée par un dénombrement standard des bactéries viables cultivables sur un milieu de culture solide (LB agar) et exprimé en Unité Formant Colonie (UFC)•mL-1 (Figure 2). Cette méthode de dénombrement standard peut nous renseigner sur le nombre de bactéries demeurées viables et cultivables sur milieu de culture solide après exposition à une dose UV-C déterminée dans les conditions de manipulation.
Figure 2
Cinétique d’inactivation de différentes souches bactériennes irradiées par le rayonnement UV-C en utilisant deux alimentations électroniques : 50 Hz (E1) et 64 KHz (E2).
Figure 2. Inactivation kinetics of different strains of bacteria irradiated by UV-C light using two electronic power supplies at 50 Hz (E1) and 64 KHz (E2).
Les résultats d’inactivation ont été décrits selon le modèle mathématique de « Series-Events ». Ce modèle mathématique permet de rapporter la réponse de chaque espèce bactérienne au stress UV-C, ce qu’on appelle la relation dose/réponse (Labaset al., 2007). De plus, l’utilisation de ce modèle de simulation a permis de mettre en relief les séries d’événements subies par la bactérie au cours de son passage sous UV-C. En effet, au moment de son exposition à une dose cumulée d’irradiation UV-C, la bactérie collecte ou accumule les dégâts engendrés par le rayonnement UV-C qui sont, en général, les cyclopyrimidines dimères (CPD) (Milleret al., 1999). Cette accumulation des photoproduits a un seuil qui n’est pas pris en compte dans d’autres modèles, comme le modèle mathématique de premier ordre de Chick-Watson. Ce seuil est présenté par le facteur (n) dans le modèle de « Series-Events » (Chiuet al., 1999; Labaset al., 2007). En se référant à ce modèle cinétique, la bactérie qui a accumulé des photoproduits au cours de son exposition à l’irradiation UV-C, à un degré supérieur à n, est une bactérie inactivée par effet dose. Par contre, la bactérie qui a accumulé des dégâts à un niveau (n-1), est une bactérie qui continue à collecter les dégâts tout en conservant une certaine viabilité.
L’inactivation bactérienne est définie comme suit, selon Chiuet al. (1999) :
Ce modèle a été modifié en tenant compte de la conservation de la viabilité et de la cultivabilité de la bactérie après exposition à l’irradiation UV :
avec : A : le taux de bactéries qui ont retenu la viabilité et la cultivabilité après irradiation UV-C au cours de la première phase d’inactivation bactérienne; N : le nombre de bactéries viables cultivables après irradiation UV-C; N0 : le nombre de bactéries viables cultivables avant irradiation par les UV-C; t : le temps d’exposition aux UV-C exprimé en seconde (s); I : intensité UV-C exprimée en mW•cm-2 ou en mJ•cm-2; k : le coefficient d’inactivation traduisant le pouvoir désinfectant potentiel ou coefficient de létalité, exprimé en cm2•mJ-1; n : le seuil des dommages subis par la bactérie après une irradiation par une dose UV (DUV) ou le seuil des séries d’événements subis par la bactérie après une irradiation germicide. Le facteur (n) est déterminé en se basant sur la plus grande valeur du coefficient de détermination R2 et la plus faible valeur de σy, la déviation standard du Log10 (N/N0).
Ce modèle mathématique rapporte la cinétique d’inactivation bactérienne d’un niveau initial i=0 (N0), jusqu'à un niveau seuil (n-1) (N) et lorsque (n = i) : la population bactérienne est présumée morte par effet UV germicide.
Les résultats d’inactivation bactérienne en fonction du mode d’alimentation électronique de la lampe UV-C à basse pression (50 Hz et alimentation électronique à haute fréquence) ont été simulés par le modèle cinétique de « Series-Events ». Dans cette étude, ce modèle mathématique de simulation permet à la fois d’établir la relation dose/réponse relative à l’espèce bactérienne testée et de déterminer les paramètres cinétiques nécessaires pour comparer l’efficacité de deux modes d’alimentation électronique appliqués au cours de cette étude.
L’analyse des courbes d’inactivation bactérienne par l’irradiation germicide, indépendamment du mode d’alimentation électrique de la lampe UV à basse pression utilisé (Figure 2), on observe une augmentation de l’abattement bactérien en fonction de la dose UV-C appliquée. Cette augmentation de l’inactivation bactérienne est probablement corrélée à une augmentation des dégâts incités par ce facteur de stress, à savoir l’accumulation des photoproduits au niveau de l’ADN bactérien. Ce résultat met en évidence le rôle clé de la dose UV-C qui va moduler l’efficacité de cette étape de traitement tertiaire de l’eau par irradiation UV.
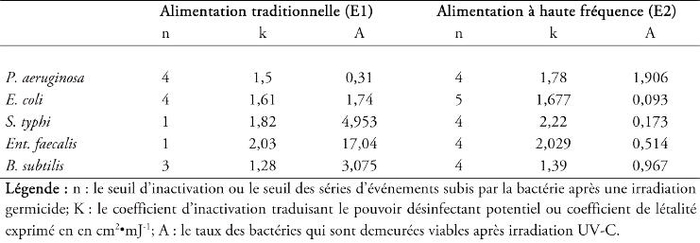
Concernant l’impact du mode d’alimentation électronique de la source germicide, la simulation des résultats de la cinétique d’inactivation bactérienne, par le modèle de « Series-Events », a permis de déterminer les deux constantes cinétiques suivantes : le coefficient de désinfection (k) et le taux de bactéries ayant retenu la viabilité après irradiation UV-C (A) pour les deux modes d'alimentation électronique : traditionnel de 50 Hz (E1) et à haute fréquence de 64 KHz (E2) (Tableau 1).
Tableau 1
Détermination des paramètres d’inactivation bactérienne en utilisant deux alimentations électroniques : 50 Hz (E1) et 64 KHz (E2).
Table 1. Determination of bacterial inactivation parameters using two electronic power supplies: conventional power supply (E1) and High frequency one (E2).
Selon Hassenet al. (2000), plus la valeur du coefficient de létalité k est grande, plus la souche bactérienne est vulnérable à l’action des UV-C et plus la valeur du coefficient k est petite, plus le microorganisme est tolérant à l’action de ces rayonnements germicides. En se basant sur cet argument, nous pouvons déduire l’efficacité de la lampe UV à basse pression alimentée à haute fréquence (E2). En effet, nous avons noté une petite augmentation du coefficient k qui est corrélé avec l’utilisation de la lampe UV à basse pression alimentée à haute fréquence. C’est ainsi que pour la souche bactérienne P. aeruginosa, k est égal à 1,5 en cm2•mJ-1 pour l’alimentation traditionnelle contre 1,78 en cm2•mJ-1 pour l’alimentation à haute fréquence. Ce résultat traduit une augmentation du pouvoir désinfectant de lampe UV modifiée, et par la suite, l’augmentation de l’efficacité du traitement UV.
L’analyse de la deuxième constante cinétique (A) déterminée par le modèle de « Series-Events », pour les deux alimentations électroniques de la lampe UV à basse pression testées, montre que la bactérie irradiée par une lampe UV alimentée à haute fréquence de 64 KHz a perdu viabilité et cultivabilité plus rapidement qu’une bactérie irradiée par une lampe UV-C traditionnelle (alimentation électronique de 50 Hz). C’est ainsi que pour la souche d’Ent. faecalis, les valeurs de (A), pour les deux alimentations électroniques, traditionnelle et à haute fréquence, sont respectivement de 17,04 et de 0,514. Ces résultats permettent de mettre en évidence l’efficacité de la lampe UV à haute fréquence à réduire la cultivabilité bactérienne à un taux plus important, comparativement à celui obtenu pour une lampe UV à alimentation traditionnelle de 50 Hz.
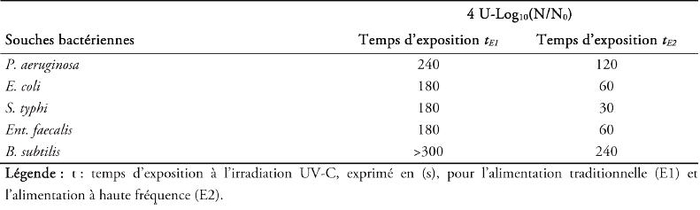
Le tableau 2 montre que le temps d’exposition aux rayonnements UV nécessaire pour inactiver 99,99 % des bactéries diffère selon l’espèce bactérienne étudiée et selon le mode d’alimentation électronique de la source UV germicide. En effet, la réponse de la bactérie à l’irradiation UV est largement dépendante de plusieurs facteurs, à savoir : (i) les caractères phénotypiques de la bactérie testée (bactérie à Gram positive ou bactérie à Gram négative); (ii) la capacité que possède la bactérie à sécréter des substances bioprotectrices contre l’irradiation UV, comme l’exo-polysaccharide (EPS), les rhamnolipides, les alginates, etc.; et (iii) les caractères génétiques de la bactérie, à savoir la distribution des bases pyrimidiques adjacentes sur le même brin d’ADN bactérien.
Tableau 2
Détermination du temps d’exposition à l’irradiation UV-C permettant l’inactivation de 99,99 % des bactéries viables et cultivables.
Table 2. Determination of UV-C exposure time allowing the inactivation of 99.99 % of viable and cultivable bacteria.
De plus, nous pouvons déduire que le temps d’exposition requis pour inactiver 99,99 % de la densité bactérienne, soit 4 U-log10(N/N0), diminue en cas d’utilisation d’une lampe UV alimentée à haute fréquence (Tableau 2). C’est ainsi que le temps d’exposition est réduit d’un facteur 2 pour la souche bactérienne de S. typhi, d'un facteur 3 pour les souches d’Ent. faecalis et E. coli, et d’un facteur 6 pour la souche de P. aeruginosa.
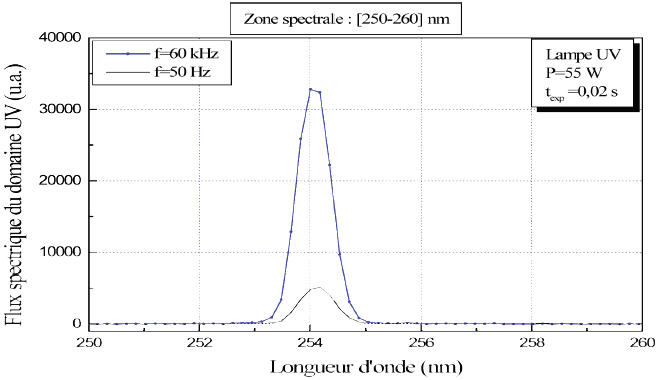
La diminution du temps d’exposition nécessaire pour inactiver 4 U-log de la biomasse bactérienne est due probablement à une augmentation du flux UV fourni par la lampe UV à basse pression alimentée à haute fréquence (64 KHz). Cette probabilité est vérifiée par la mesure flux spectral de la raie 253,7 nm à l’aide d’un spectroradiomètre (Figure 3).
Figure 3
Flux spectral de la raie 253,7 nm pour les deux alimentations électroniques, traditionnelle (50 Hz) et à haute fréquence (64 KHz).
Figure 3. Spectral flux of the 253,7 nm line for two electronic power supply at 50 Hz and at 64 KHz.
En conclusion, pour cette partie de travail, l’application de l'alimentation électronique à haute fréquence de 64 KHz pour une lampe UV à basse pression permet de garantir une amélioration de l’efficacité du traitement de l’eau par irradiation UV-C avec un gain du temps d’exposition et, par la suite, un gain énergétique et économique.
3.2 Étude de la photoréactivation et de la réparation obscure des bactéries postirradiées
Dans le but de vérifier la capacité de différentes espèces bactériennes testées à réparer les dégâts incités par l’irradiation UV-C, à savoir la réparation photodépendante par monomérisation des dimères de pyrimidines à l’aide d’une enzyme, la photolyase (Sinha et Häder, 2002) et les mécanismes de réparation à l'obscurité tels que le mécanisme d'excision-resynthèse, la réparation postréplication et le système SOS (Kim et Sundin, 2001), il semble qu’il serait indispensable d’utiliser l’équation logarithmique définie selon la formule de Lindauer et Darby (1994), modifiée :
avec : N0 : le nombre de bactéries viables cultivables avant irradiation UV-C; N : le nombre de bactéries viables cultivables après irradiation UV-C et Nr : le nombre de bactéries régénérées après des temps de repos en présence et/ou en absence de la lumière visible.
Ce rapport logarithmique permet de quantifier le phénomène de réactivation bactérienne en présence de la lumière visible et/ou à l’obscurité. D’après Lindauer et Darby (1994), ce rapport varie entre 1 et 3,4 : lorsqu’il est inferieur à 1, dans ce cas la souche bactérienne est estimée comme non réactivable. Lorsque ce rapport se situe entre 1 et 3,4; la bactérie est réactivante à la lumière visible et/ou à l’obscurité. Toutefois, lorsqu’il est supérieur à 3,4 : la bactérie se développe normalement après une irradiation aux UV-C; subséquemment à ce résultat, on peut conclure qu’il n’y a pas d'effet UV-C sur la souche bactérienne.
La reviviscence des bactéries testées après une exposition aux UV-C est le résultat d’une photoadaptation. Ce phénomène est à même d’augmenter la tolérance aux rayonnements germicides par diminution de l’accumulation des photoproduits générés au niveau du support génétique et préserver, par la suite, la pérennité cellulaire.
La réactivation est traduite par le retour à la cultivabilité bactérienne sur milieu usuel après des temps de repos à la lumière visible et/ou à l’obscurité. De plus, la régénération bactérienne, après un traitement par la lumière ultraviolette, constitue également un paramètre biologique très important qui s’ajoute aux paramètres de fonctionnement et qui nous permet de révéler l’efficacité d’un système de traitement donné par irradiation UV-C.
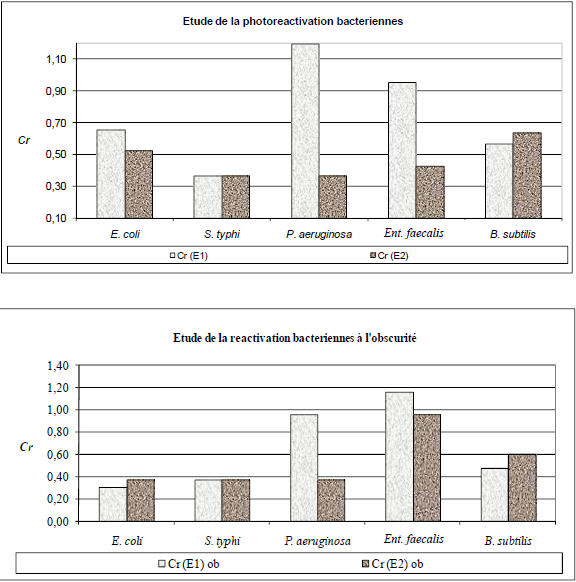
D’après les résultats présentés dans la figure 4, lorsque nous avons irradié les différentes souches bactériennes avec une lampe UV alimentée à haute fréquence, nous n’avons pas noté de réactivation des différentes souches bactériennes postirradiées par la lumière ultraviolette en présence et/ou en l’absence de lumière visible. En effet, le coefficient de réactivation (Cr=Nr/N) est inferieur à 1. Par contre, quand nous avons exposé les souches bactériennes sous une lampe UV usuelle (alimentée à 50 Hz), nous avons noté une réviviscence de la souche de P. aeruginosa en présence de la lumière visible. De plus, la souche d’Ent. faecalis postirradiée à la lumière UV fournie par une lampe UV traditionnelle s’est réactivée à l’obscurité (Figure 4). Ainsi, ces deux souches bactériennes ont pu surmonter les dégâts induits par l’UV, par le biais du mécanisme de photoréactivation pour la souche de P. aeruginosa et la réparation obscure pour la souche testée d’Ent. faecalis.
Figure 4
Coefficient de réactivation (Cr) déterminé pour les souches bactériennes testées après des temps de repos à la lumière visible et/ou à l’obscurité pour les deux alimentations électroniques 50 Hz (E1) et 64 KHz (E2).
Figure 4. Determination of bacterial reactivation factor (Cr) for tested bacterial strains after a rest time in presence and/or in absence of visible light for two electronic power supply at 50 Hz (E1) and at 64 KHz (E2).
Ces résultats permettent de mettre en relief l’efficacité de l’irradiation UV-C générée par l’utilisation d’une lampe UV à alimentation électronique à haute fréquence à inactiver irréversiblement les différentes espèces bactériennes testées. En effet, l’intensité UV libérée par cette lampe a permis une inactivation bactérienne efficace, rapide et irréversible par les systèmes de réparation photo-dépendants et photo-indépendants.
L’étude de la relation dose/réponse et l’exploitation des mécanismes de réactivation bactérienne en présence de la lumière visible et/ou à l’obscurité, pour les deux types d’alimentation électronique de la lampe UV-C à basse pression, ont permis d’optimiser les paramètres de fonctionnement d’un réacteur UV pour une désinfection de l’eau plus efficace, et de garantir la production d’une eau saine.
4. Conclusion
La réalisation d’une alimentation électronique sinusoïdale auto-oscillante et régulée à haute fréquence, pour une lampe à vapeur de mercure à basse pression, s’est révélée avoir plusieurs avantages comparativement à une alimentation traditionnelle de 50 Hz.
Ces avantages se résument comme suit : (i) la préservation des avantages fournis par la lampe à basse pression, à savoir l’irradiation à une longueur d’onde monochromatique à 253,7 nm qui représente le maximum du pouvoir germicide, tout en augmentant l’efficacité du traitement UV; (ii) un gain dans le temps d’exposition qui peut servir à augmenter le débit de l’effluent à l’entrée du réacteur UV en cas d’application de cette alimentation électronique à l’échelle industrielle; et (iii) la diminution du risque de réactivation bactérienne après une désinfection de l’eau par irradiation UV-C.
5. Perspectives
Notre objectif est de garantir la production d’une eau saine et contrôlée. Pour atteindre cet objectif, et en se basant sur les résultats obtenus, une actualisation du système de désinfection est demandée, par exemple, par la modification de la géométrie du réacteur UV, permettant ainsi une propagation plus homogène de la dose UV à l’intérieur du réacteur, ce qui permettra de surmonter les limites de cette technologie prometteuse et propre.
Parties annexes
Remerciements
Ce travail a été supporté financièrement par le ministère de l'Enseignement supérieur, Recherches scientifiques et Technologie de Tunisie, dans le cadre d'un projet de Valorisation des Résultats de la Recherche (VRR).
Je tiens à remercier vivement M. Mongi Stambouli, professeur à l'École Supérieure des Sciences et Techniques de Tunis (ESSTT) pour ses pertinents conseils tout au long de ce travail.
J'exprime également ma gratitude à M. Hechmi Zairi, pour son aide précieuse concernant l’entretien et la mise en marche du photoréacteur UV.
Références bibliographiques
- ADEDAPO R.Y. (2005). Disinfection by-product formation in drinking water treated with chlorine following UV photolysis and UV/H2O2. Mémoire de maîtrise, Sciences appliquées, génie civil, Université de Waterloo, Ontario, Canada, 216 p.
- Baker K.H., j.p. Hgarty, b. Redmond, n.a. Reed et D.S. Herson (2002). Effect of oxidizing disinfectants (chlorine, monochloramine, and ozone) on Helicobacter pylori. Appl. Environ. Microb., 67, 4096-1101.
- BOLTON J.R. et L. HENKE (1999). Ultraviolet disinfection: a basic primer. Water Cond. Purif., 41, 34-38.
- CHIU K., D.A. LYN, P. SAVOYE et E.R. BLATCHLEY (1999). Integrated UV disinfection model based on particle tracking. J. Environ. Eng.-ASCE, 125, 7-16.
- Gerba C.P., N. Nwachuku et K.R. Riley (2003). Disinfection resistence of waterborne pathogens on the United States Environmental Protection Agency’s Contaminant Candidate List (CCL). J. Water Suppl. Res. Technol. – Aqua, 52, 81-94.
- Hassen A., M Mahrouk, H. Ouzari, A Boudabous et J.J. Damelincourt (2000). UV disinfection of treated waste water in a large scale pilot plant and inactivation of selected bacteria in a laboratory UV device. Bioresour. Technol., 74, 141-150.
- Kao Y.T., C. Saxena, L. Wang, A. Sancar et D. Zhong (2005). Direct observation of thymine dimer repair in DNA by photolyase. Proc. Natl. Acad. Sci. USA, 102, 16128-16132.
- Kim J.J. et G.W. Sundin (2001). Construction and analysis of photolyase mutants of Pseudomonas aeruginosa and Pseudomonas syringae: contribution of photoreactivation, nucleotide excision repair, and mutagenic DNA repair to cell survival and mutability following exposure to UV-B radiation. Appl. Environ. Microb., 67, 1405-1411.
- Labas M.D., C.S. Zalaza, R.J. Brandi et A.E. Cassano (2007). Reaction kinetics of bacteria disinfection employing hydrogenperoxide. Biochem. Eng. J., 38, 78-87.
- LeChevallier M.W. et K.-K. AU (2004). Water treatment and pathogen control: process efficiency in achieving safe drinking water. London, IWA Publishing, ISBN 1843390698. 122p.
- Lindauer K.G. et J. Darby (1994). Ultraviolet disinfection of waste water: effect of dose on subsequent photoreactivation, Water Res., 28, 805-817.
- Miller R., W. Jeffrey, D. Mitchell et M. Elasri (1999). Bacterial responses to ultraviolet light. Appl. Environ. Microb., 65, 535-541.
- OLIVER J.D., M. DAGHER et K. LINDEN (2005). Induction of Escherichia coli and Salmonella typhimurium into the viable but nonculturable state following chlorination of wastewater. J. Water Health, 3, 249-257.
- Sinha R.P. et D.P. Häder (2002). UV-induced DNA damage and repair: a review. Photochem. Photobiol., 1, 225-236.
- Zimmer J.L., et R.M. Slawson (2002). Potential repair of Escherichia coli DNA following exposure to UV radiation from both medium and low-pressure UV sources used in drinking water treatment. Appl. Environ. Microbiol., 68, 3293-3299.
Liste des figures
Figure 1
Présentation schématique du photoréacteur UV-C.
Figure 1. Schematic presentation of UV-C photo-reactor.
Figure 2
Cinétique d’inactivation de différentes souches bactériennes irradiées par le rayonnement UV-C en utilisant deux alimentations électroniques : 50 Hz (E1) et 64 KHz (E2).
Figure 2. Inactivation kinetics of different strains of bacteria irradiated by UV-C light using two electronic power supplies at 50 Hz (E1) and 64 KHz (E2).
Figure 3
Flux spectral de la raie 253,7 nm pour les deux alimentations électroniques, traditionnelle (50 Hz) et à haute fréquence (64 KHz).
Figure 3. Spectral flux of the 253,7 nm line for two electronic power supply at 50 Hz and at 64 KHz.
Figure 4
Coefficient de réactivation (Cr) déterminé pour les souches bactériennes testées après des temps de repos à la lumière visible et/ou à l’obscurité pour les deux alimentations électroniques 50 Hz (E1) et 64 KHz (E2).
Figure 4. Determination of bacterial reactivation factor (Cr) for tested bacterial strains after a rest time in presence and/or in absence of visible light for two electronic power supply at 50 Hz (E1) and at 64 KHz (E2).
Liste des tableaux
Tableau 1
Détermination des paramètres d’inactivation bactérienne en utilisant deux alimentations électroniques : 50 Hz (E1) et 64 KHz (E2).
Table 1. Determination of bacterial inactivation parameters using two electronic power supplies: conventional power supply (E1) and High frequency one (E2).
Tableau 2
Détermination du temps d’exposition à l’irradiation UV-C permettant l’inactivation de 99,99 % des bactéries viables et cultivables.
Table 2. Determination of UV-C exposure time allowing the inactivation of 99.99 % of viable and cultivable bacteria.