Résumés
Résumé
La présence de colorants dans les effluents industriels constitue un problème important dans plusieurs pays. Les industries qui rejettent de tels composés sont principalement les industries textiles et les industries de pâtes et papiers. La décharge de tels effluents dans le milieu récepteur cause une demande excessive en oxygène et ceux-ci doivent par conséquent être traités avant tout rejet dans l’environnement. Cette étude propose une nouvelle option pour le traitement de ce type de pollution, soit la décoloration par utilisation de structures adsorbantes produites préalablement par électrocoagulation avec des électrodes de fer et d’aluminium. Trois structures ont ainsi été synthétisées dans un électrolyte support constitué de 10-2 mol NaCl•L-1. Les trois structures synthétisées ont été analysées par diffraction des rayons X (DRX) et microscopie électronique à balayage (MEB). Ces analyses ont montré la présence dominante de bayerite (Al(OH)3) dans la structure produite à partir d’électrodes d’aluminium et de magnétite (Fe3O4) et lépidocrocite (γ-FeO(OH)) dans la structure générée à partir d’électrodes de fer. Le composé généré en utilisant les deux types d’électrodes contient, pour sa part, de la bayerite et de la goethite (α-FeO(OH)). Un suivi de la décoloration a été réalisé dans des solutions acides (pHi = 4,8) et alcaline (pHi = 9,8) contaminées par un colorant diazoïque ([Trypan bleu]i = 3,75 mg•L-1). Les résultats obtenus ont montré l’efficacité de ces structures, avec des rendements de décoloration compris entre 94 et 99 %, et un rendement d’élimination de la DCO pouvant atteindre 96 %, selon le pH du milieu.
Mots-clés :
- Colorant,
- décoloration,
- électrocoagulation,
- fer,
- aluminium,
- adsorbant,
- eaux usées
Abstract
The presence of dyes in industrial effluents represents a serious issue in many countries. This type of effluent is mainly discharged by textile and pulp and paper mill industries. The discharge of such effluents causes excessive oxygen demand in the receiving water and the effluents need to be treated before any discharge. This study describes a new option for the removal of this type of pollutant, which is the decolourization with adsorbing structures generated by electrocoagulation using aluminum and iron electrodes. Three solid structures have been produced in a 10-2 mol NaCl•L-1 electrolyte solution. X-ray diffraction (XRD) and scanning electron microscope (SEM) analyses have shown that the structures produced using aluminum electrodes are constituted of bayerite (Al(OH)3), whereas the structures produced using iron electrodes are principally composed of magnetite (Fe3O4) and lepidocrocite (γ-FeO(OH)). The structures generated with both types of electrodes notably contain bayerite and goethite (α-FeO(OH)). Dye removal assays have been carried out in acid (pHi = 4.8) and alkaline (pHi = 9.8) solutions artifically polluted by diazoic dye ([Blue Trypan]i = 3.75 mg•L-1). The results demonstrated very high dye (94-99%) and COD (≤ 96%) removal yields, these removal percentages being sensitive to the solution pH.
Keywords:
- Dye,
- decolourization,
- electrocoagulation,
- iron,
- aluminum,
- adsorbent,
- wastewater
Corps de l’article
1. Introduction
Plusieurs industries, telles que le textile, le cuir, l’impression, le plastique, et le cosmétique, utilisent des composés chimiques colorés naturels ou synthétiques pour la coloration de leurs produits finis (chiou et Li, 2003). À titre d’exemple, dans la section de teinture d’une industrie textile, environ 1 000 L d’eau sont utilisés pour chaque 1 000 kg de vêtements traités, ce qui engendre des rejets caractérisés par de fortes colorations, de fortes variations de pH et des charges organiques élevées (Garget al., 2004). Le rejet dans les eaux naturelles de ces effluents fortement colorés de ces industries peut causer des dommages sévères à l’environnement (Aksu et Tezer, 2001). Les colorants peuvent notamment causer des dermatites et des irritations de la peau et certains sont cancérigènes et mutagènes pour les organismes aquatiques (Lorenc-Grabowska et Gryglewicz, 2007; Mathuret al., 2006).
Les procédés biologiques usuels utilisés notamment pour le traitement des eaux usées municipales se sont avérés inefficaces pour l’élimination de ces colorants (Lazaridiset al., 2003; Robinsonet al., 2001; Walkeret al., 2003). Plusieurs méthodes spécifiques de décoloration des eaux colorées ont ainsi été proposées, parmi lesquelles figurent l’oxydation chimique par H2O2/Fe2+ (Sevimli et Kinaci, 2002; Shahet al., 2005), la réduction par le Fe0 (Changet al., 2006), l’oxydation électrochimique par O3/UV, O3/H2O2, O3/UV/H2O2, ou H2O2/UV (Al-Kdasiet al., 2004; Arslan-Alaton, 2003), la photodégradation par TiO2/UV, ou par photo-Fenton (El-Ghaziet al., 2004; Torradeset al., 2004), la séparation membranaire telle que la microfiltration, l’ultrafiltration, la nanofiltration (Mutluet al., 2002), l’electro-Fenton (ÖZCAN et al., 2008; ÖZCAN et al., 2009), traitement biologique anaérobie (DOS SANTOS et al., 2007; Frank et al., 2005).
Parmi la panoplie de technologies disponibles, l’adsorption sur différents matériaux demeure une option largement utilisée étant donné sa simplicité et son coût généralement raisonnable. Les adsorbants utilisés comprennent notamment le charbon activé (Ben Taharet al., 2004), les oxydes, oxyhydroxydes et hydroxydes de fer (Cornell et Schwertmann, 1996; Pirillo et al., 2007), les hydroxydes d’aluminium (Liet al., 2009; Marangoniet al., 2009) et une grande variété de matériaux économiques de nature organique (pelures de fruits, feuilles d’arbres, écailles de végétaux, mousse de tourbe, biomasses de moisissures, boues activées, etc.) ou inorganique (silice, cendres volantes, boues rouges d’aluminerie, argiles, hydroxydes de métaux, etc.). Plusieurs revues détaillées portant sur l’utilisation de ces adsorbants pour le traitement des effluents ont été publiées dans les dernières années (BAILEY et al., 1999; HASHEM et al., 2007; Mallet al., 1996).
La coagulation-floculation chimique par des réactifs à base d’aluminium (alun), de fer (sulfate ou chlorure ferrique), en combinaison ou non avec des polymères organiques, est également une technique largement utilisée (Lin et Peng, 1996; Naim et El ABD, 2002).
L’arsenal des procédés de décoloration des effluents comprend également des traitements électrochimiques, tels que l’électro-oxydation (Abdo et Al-Ameeri, 1987; KUPERFELE et al., 2004; Zaviskaet al., 2009), l’électrofloculation (Ciardelli et Ranieri, 2001), ou l’électrocoagulation (Alinsafiet al., 2005; Mollahet al., 2004; Golderet al., 2005).
L’électrocoagulation est une technique électrochimique par laquelle des anodes sacrificielles (électrodes de fer ou d’aluminium) sont progressivement solubilisées dans les eaux à traiter et servent de précurseurs de coagulants (Cenkin et Belevtsev, 1985). Le fer ou l’aluminium libérés produisent des flocs d’hydroxides métalliques, lesquels peuvent éliminer les pollutants par complexation de surface ou attraction électrostatique (Mollahet al., 2001; Rajeshwaret al., 1994).
Les Équations (1) à (4) montrent quatre complexes d’aluminium produits initialement lors de la mise en solution de l’aluminium lors de l’application du procédé d’électrocoagulation.
La prédominance de chacune de ces espèces est fonction du pH de la solution et de la concentration d’aluminium (Holtet al., 2002). Au fur et à mesure que les concentrations de monomères d’aluminium augmentent en solution, des espèces polymériques sont formées selon les réactions suivantes (Amirtharahah et Mills, 1982; Jolivet, 1994) :
La plupart des espèces monomériques (Al(OH)2+, Al(OH)2+ Al(OH)3, et Al(OH)4) et polymériques (Al2(OH)24+, Al3(OH)45+ et Al13O4(OH)247+) sont générées avant la précipitation d’hydroxydes d’aluminium (Exall et Vanloon, 2000).
Plusieurs études ont ainsi montré la possibilité de décolorer efficacement les eaux usées par utilisation de l’électrocoagulation avec des électrodes d’aluminium (Ahlawatet al., 2008; Canet al., 2003; Merzouket al., 2009) ou de fer (Arslan-Alatonet al., 2008; Kabdasli et al., 2009; Palacio et al., 2009).
Une autre approche proposée récemment consiste à produire ex situ des structures adsorbantes par électrocoagulation et d’utiliser ces composés inorganiques, à base de fer ou d’aluminium, comme réactifs pour le traitement d’effluents (Zidaneet al., 2008).
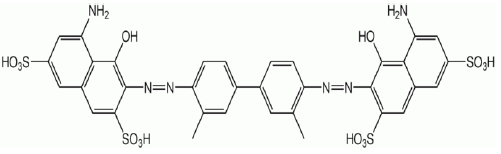
Cette nouvelle approche a été testée dans la présente étude afin de décolorer une eau contaminée par un colorant usuel, le Trypan bleu (C34H24N6Na4O14S4). Ce colorant anionique et toxique, dont la formule chimique détaillée est illustrée à la figure 1, appartient à la famille des diazoïques (C.I. 23850) et présente un maximum d’absorbance à 596 nm. Son nom scientifique est le 2,7-naphtalenedisulfonic acid, 3,3’- ((3,3’- dimethyl (1,1’- dimethyl (1,1’- biphenyl) 4,4’- diyl-) bis (azo), bis (5-amino 4-hydroxy-) tetrasodium et sa structure tridimensionnelle a été étudiée par Skowroneket al. (2000).
Figure 1
Formule chimique du colorant synthétique trypan bleu (C34H28N6O14S4).
Chemical formula of the synthetic dye trypan blue (C34H28N6O14S4).
2. Matériel et méthodes
2.1 Préparation des composés
La préparation des structures adsorbantes a été réalisée dans un montage composé d’une cellule électrolytique en pyrex, en mode monopolaire parallèle, d’un volume de 5 L, muni de quatre électrodes en aluminium et/ou de fer, de dimensions 15 cm × 15 cm × 0,2 cm, et d’une distance inter-électrodes de 4 cm. L’homogénéisation de l’électrolyte support, lequel consistait en une solution à 10-2 mol NaCl•L-1 préparée dans l’eau de robinet, a été effectuée à l’aide d’un agitateur magnétique. La tension aux bornes des électrodes a été fixée par un générateur de courant continu (DC, AL 823 ELC). Un potentiel de 12 V a été maintenu constant durant l’expérience menée à température ambiante (Zidaneet al., 2008).
Trois structures adsorbantes ont été synthétisées en utilisant différents assemblages d’électrodes :
Composé A1 : électrocoagulation avec des électrodes d’aluminium;
Composé F1 : électrocoagulation avec des électrodes de fer;
Composé F4 : électrocoagulation avec deux électrodes d’aluminium et deux de fer mises sous tension suivant l’ordre suivant : anode (Al) - cathode (Fe) - anode (Fe) - cathode (Al).
Les composés synthétisés par électrocoagulation ont été séparés de la phase liquide par filtration, puis laissés à sécher à température inférieure à 50 °C, et ensuite broyés par un mortier, jusqu’à l’obtention d’une granulométrie relativement homogène.
2.2 Caractérisation des composés
Les composés ont été analysés par diffraction aux rayons X (DRX), à l’aide d’un appareil de marque Siemens, modèle D5000. Une étude de morphologie physique a été réalisée par microscopie électronique à balayage (MEB), à l’aide d’un appareil avec un système d’analyse d’images Tracor-Northern TN 8502/S, muni d’un grossissement de 10 à 10 000 x. Une analyse de la taille des composés a aussi été réalisée avec un granulomètre laser de marque Fritsch, modèle analyste 22, avec un intervalle d’analyse entre 0,1 et 600 µm.
Une analyse de la composition élémentaire des composés a été effectuée par spectrophotométrie à émission de plasma induit (ICP-AES) (Méthode EPA 6010 B) sur un appareil Varian (modèle Vista AX CCO Simultaneous ICP-AES, Palo Alto, CA, USA). Des contrôles de qualité ont été effectués en analysant des échantillons liquides certifiés (lot SC0019251, no catalogue 900-Q30-002, multi-elements standard, SCP Science, Lasalle (Québec) Canada). Les composés ont été préalablement digérés en milieu acide selon le protocole 3030 I de l’APHA et al. (1999).
2.3 Essais de décoloration avec les composés
Les essais de décoloration des effluents synthétiques ont été réalisés avec une solution constituée 3,75 mg•L-1 du colorant trypan bleu (Allied Chemical, New Jersey, États-Unis) préparée dans l’eau distillée. Des essais ont été réalisés avec cette solution acide (pH = 4.82), ainsi qu’avec cette solution, préalablement ajustée à pH 9,75 par l’addition d’hydroxyde de sodium concentré. Des volumes de 25 mL d’eau colorée, à pH acide et à pH basique, ont été traités séparément, par différentes masses de chacun des composés ajoutés d’une façon croissante (0, 0,01, 0,05, 0,1, 0,2, 0,4, 0,6 et 1,0 g), puis agités manuellement. Après 24 h, des prélèvements du surnageant ont été effectués afin de déterminer le pH, la conductivité, la demande chimique en oxygène (DCO), et l’absorbance (λ = 596 nm) de la solution.
2.4 Méthodes analytiques
La mesure du pH a été réalisée en utilisant un pH-mètre Accumet Research modèle AR 25 Dual Channel pH/Ion meter de Fisher Scientific (Nepean (Ontario) Canada) équipé d’une double jonction Cole-Parmer avec une électrode de pH Ag/AgCl calibrée chaque jour entre 4 et 9 (Cole Parmer Instrument, Anjou (Québec) Canada) avec une précession de 0,01. La conductivité des eaux a été mesurée à l’aide d’un appareil Oakton (modèle 510, Cole Parmer Instrument, Anjou (Québec) Canada). La DCO a été mesurée selon la méthode 5220D (APHA et al., 1999) avec une courbe standard (0-1 000 mg•L-1) à l’aide d’un spectrophotomètre UV de marque Varian (modèle Cary 50, Varian Canada Inc., Saint-Laurent (Québec) Canada) avec une précession de 0,0001.
3. Résultats et discussion
3.1 Caractérisation microscopique des composés
L’analyse par DRX des trois composés a permis d’identifier les principales phases cristallines présentes dans ces derniers. Le composé à base d’aluminium (Figure 2a), est ainsi constitué en grande partie de bayerite (Al(OH)3) et se trouve majoritairement sous forme de baguettes et de feuillets. Le composé à base du fer (Figure 2b) est présent sous forme de grains ronds agglomérés. Il se compose de deux phases, la magnétite (Fe3O4), et la lépidocrocite (γ-FeO(OH)). Celui généré en utilisant deux types d’électrodes (Figure 2c) contient, pour sa part, de la bayerite et de la goethite (α-FeO(OH)) et existe sous forme de grains compacts. Il faut noter que les hydroxydes de fer (PIRILLO et al., 2007, 2009) et d’aluminium (LI et al., 2009; MARANGONI et al., 2009) sont connus pour leurs propriétés adsorbantes vis-à-vis des colorants. Certains auteurs (VILGE-RITTER, 1997) utilisent des sels de fer ou d’aluminium pour l’élimination des matières organiques.
Figure 2a
Électrodes d’aluminium (A1).
Aluminium electrodes (A1).
Figure 2b
Électrodes de fer (F1).
Iron electrodes (F1).
Figure 2c
Électrodes d’aluminium et de fer (F4).
Aluminium and iron electrodes (F4).
3.2 Caractérisation élémentaire
La composition élémentaire des structures adsorbantes est donnée au tableau 1. Le composé A1 est principalement composé de 30 % d’aluminium, ce qui correspond bien à la structure principale identifiée par DRX, soit Al(OH)3. En supposant que l’aluminium serait uniquement présent sous forme de bayerite, la proportion de celle-ci dans le composé A1 serait alors de 86-87 %. Les éléments minoritaires seraient alors le calcium, le potassium, le magnésium, le sodium et, évidemment, les chlorures, puisque le composé est préparé dans une solution de chlorure de sodium.
Tableau 1
Composition élémentaire (mg•g-1) des différentes structures adsorbantes.
Elemental composition (mg•g-1) of the different adsorbing structures.
Le composé F1 est, quand à lui, formé de 19 % de fer, lequel serait principalement inclus dans des précipités de magnétite et de lépidocrocite. Les éléments mineurs de ce composé sont les mêmes que ceux identifiés pour le composé A1, avec présence d’une faible teneur en aluminium.
Le composé F4 est composé de 7,1 % d’aluminium et de 9,4 % de fer. En considérant l’aluminium présent sous forme de bayerite, la proportion de ce précipité serait d’environ 20 % de la masse du composé F4, alors qu’une proportion avoisinant les 15 % peut être estimée pour la geothite.
3.3 Étude granulométrique
Les trois composés ont été analysés à l’aide d’un granulomètre laser. Le profil granulométrique de ceux-ci est montré sur la figure 3. Plus de 95 % des particules ont une taille comprise entre 1 et 80 μm, et ce, pour tous les composés. Le composé F1, à base de fer, possède une granulométrie plus fine que les deux autres composés avec une proportion de 50 % des particules inférieures à 10 μm, alors que cette proportion est de seulement 32 % et 18 % respectivement pour les composés F4 et A1.
Figure 3
Répartition de la taille des particules des différentes structures adsorbantes obtenues par granulométrie laser.
Particle size distribution of the different adsorbing structures obtained by laser particle sizer.
Dans les cas de F4 et A1, le seuil de 50 % des particules (taille moyenne) est atteint à des granulométries respectives de 20 μm et d’environ 35 μm. Plusieurs études ont montré l’importance de la granulométrie des particules sur la capacité d’adsorption des colorants (Al Ghoutiet al., 2009; Doganet al., 2009; Ponnusami et al., 2009).
À pH neutre de préparation, le coagulant adsorbant A1 (Figure 2a) (formé à partir de quatre plaques d’aluminium) se trouve essentiellement sous forme goethite solide, alors que le coagulant F1 (Figure 2b) (formé à partir de quatre plaques de fer) existe sous forme solide et dissoute (Fe(OH)2+), ce qui peut expliquer la forme moins compacte de celui-ci et sa plus faible granulométrie.
3.4 Décoloration à l’aide des composés
La figure 4 montre la variation des pH finaux des solutions du colorant trypan bleu aux pH acide et basique suite à l’addition de différentes masses des structures adsorbantes dans celui-ci.
Figure 4
Variation du pH de la solution de colorant ([trypan bleu] i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).
Change in pH of the dye solution ([trypan blue] i = 3.75 mg•L-1) during trials with different concentrations of the adsorbing structures: (A) pHi = 4.8; (B) pHi = 9.8. (Contact time = 24 h, T = 20°C).
Une hausse du pH vers une valeur de 7,4 a été constatée suite à l’ajout de 0,4 g•L-1 des composés A1, F1 et F4. Ceci est attribuable à la dissolution partielle des composés en Al3+ et Fe3+ et à la libération des ions OH- dans le surnageant selon les équations 6 et 7 :
Simultanément, les ions d’aluminium et de fer interagissent avec le colorant, laissant les ions OH- libres, ce qui contribue à l’augmentation du pH, vers une valeur proche de 7,4 selon les équations 8 et 9 :
Pour cette valeur (pH 7,4), une réaction d’échange se produit, provoquant une diminution du pH due à l’existence d’hydroxydes d’aluminium et de fer sur lesquels les molécules de colorant vont s’adsorber suivant les équations 10 et 11 :
En milieu basique, pour une concentration de 0,4 g•L-1 pour les composés A1, F1, et F4, le pH diminue, jusqu’à une valeur de 7,2 pour les composés A1 et F4, et une valeur de 6,1 pour le composé F1. On constate une légère augmentation du pH pour une concentration de 4 g•L-1 des composés, suivi par une stabilisation autour de pH 7,0.
Cette diminution du pH est due à la réaction entre Al(OH)3 et Fe(OH)3, avec les ions de OH- déjà présents dans la solution suivant les équations 12 et 13 :
Par la suite, le pH se stabilise vers le pH de l’eau épurée autour de la valeur 7, quelle que soit la concentration des composés à base de fer ou d’aluminium, ceux-ci sont majoritairement sous forme d’hydroxydes, et donc sous forme solide stable à pH neutre (Amirtharahah et al., 1982). Ceci est probablement dû au phénomène d’adsorption du colorant par les hydroxydes métalliques formés.
Le suivi de la décoloration a été réalisé par la mesure de l’absorbance à 596 nm (Figure 5).
Figure 5
Rendements d’élimination de la couleur de la solution de colorant ([trypan bleu]i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).
Colour removal yields of the dye solution ([trypan blue] i = 3.75 mg•L-1) during trials with different concentrations of the adsorbing structures: (A) pHi = 4.8; (B) pHi = 9.8. (Contact time = 24 h, T = 20°C).
Les résultats montrent que lors de l’utilisation d’une solution initiale acide (pHi = 4,8), la décoloration des eaux par les adsorbants atteint un rendement de décoloration de 90 %, avec une concentration de 2 g•L-1 pour A1, 4 g•L-1 pour F1 et 0,4 g•L-1 pour le composé F4.
Globalement, l’allure des courbes d’élimination de la coloration des effluents (Figure 5) est quasiment similaire lorsqu’un pH initial légèrement acide est imposé (pHi = 4,8). Un taux d’élimination supérieur à 95 % est observé quel que soit le type de coagulant utilisé. La structure chimique des agents coagulants (A1, F1 et F4) n’a donc pas d’influence sur l’élimination de la coloration dans ces conditions expérimentales. Cette décoloration des effluents peut être attribuée à l’adsorption de colorant sur la surface des hydroxydes par coprécipitation, ou encore, par attraction électrostatique à la surface des hydroxydes métalliques. Le colorant (L) peut se lier aux hydroxydes de fer ou d’aluminium suivant les réactions :
Lors de l’utilisation de la solution alcaline (pHi = 9,8), un rendement maximal de décoloration de 94 % a été atteint avec 8 g•L-1 du composé A1, suivi d’une diminution progressive de la décoloration avec la hausse de la concentration de ce composé. Un rendement de décoloration de 57 % a ainsi été mesuré avec 40 g•L-1 du composé A1. Cette réduction de la décoloration n’a pas été notée avec les deux autres composés avec des rendements de décoloration progressant avec la hausse de la concentration de composés adsorbants pour atteindre des rendements maximaux de 96 et 95 % avec 40 g•L-1 des composés F1 et F4 respectivement. La différence de comportement entre le composé A1 et les deux autres composés pourrait être attribuable à la baisse du pH plus importante enregistrée lors de l’utilisation de forte concentration du composé A1 (pH = 6,5 à 40 g•L-1) en comparaison avec les deux autres composés (pH 7,1 à 40 g•L-1). Il apparaît ainsi que l’élimination par adsorption est influencée par la valeur du pH qui modifie la charge ionique de la surface de l’adsorbant, ainsi que le degré d’ionisation de l’adsorbat. Lorsque le pH initial du milieu est basique, il y a inversion de charge des hydroxydes à la surface des particules, ce qui diminue l’adsorption du colorant sur les particules d’hydroxydes métalliques (Pirilloet al., 2009). En particulier, pour l’agent coagulant A1 (essentiellement constitué de bayerite Al(OH)3), à pH basique (pH = 9,8), l’hydroxyde d’aluminium réagit avec l’eau pour donner l’ion aluminate (Al(OH)4-) qui est moins adsorbant que la bayerite (Équation 16) :
On remarque que pour une concentration entre 4 et 8 g•L-1, le rendement obtenu pour F4 (deux plaques de fer et deux d’aluminium) diminue par rapport au rendement obtenu pour F1 (fer seul) et A1 (aluminium seul); ceci entraine par ailleurs une saturation des sites. La surface se charge alors négativement, induisant un relargage du colorant et donc une diminution du rendement jusqu’à une certaine valeur où un réarrangement du composé permet une nouvelle réadsorption du colorant et de nouveau une augmentation du rendement jusqu’à 100 %.
Un suivi de dépollution des eaux colorées a également été réalisé par l’analyse de la demande chimique en oxygène (DCO) sur les solutions filtrées, en fonction des concentrations des composés ajoutés et au pH du milieu (Figure 6). Une élimination de la DCO pouvant atteindre une valeur de 90 % a été notée, pour des concentrations différentes des composés adsorbants. Lors de l’utilisation de la solution acide, une concentration optimale de 0,4 g•L-1 des composés A1, F1 et F4 a été nécessaire pour atteindre ce rendement, tandis qu’avec la solution alcaline, une concentration de 4 g•L-1 de composés a été requise dans le cas de A1 et F1. Un rendement d’élimination de la DCO de seulement 62 % a été mesuré à la même concentration pour le composé F4, alors qu’un rendement maximal de 82 % a été obtenu à 40 g•L-1.
Figure 6
Rendements d’élimination de la DCO de la solution de colorant ([trypan bleu]i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).
Removal efficiencies for COD in the dye solution ([trypan blue] i = 3.75 mg•L-1) during trials with different concentrations of the adsorbing structures: (A) pHi = 4.8; (B) pHi = 9.8. (Contact time = 24 h, T = 20°C).
Lors de l’utilisation de la solution acide, la dissolution des composés en Al3+ et Fe3+ favorise les deux équations 8 et 9, ce qui diminue la teneur en DCO dans la solution colorée. Les rendements maximaux d’élimination de la DCO ont été obtenus à faible concentration des structures adsorbantes, soit à 0,4 g•L-1. Une baisse progressive de la réduction de la DCO a été observée avec l’accroissement des teneurs en adsorbants F1 et F4. Ce phénomène pourrait s’expliquer par la présence de fer en solution présent initialement dans ces structures adsorbantes et pouvant contribuer à la variation de la DCO mesurée. D’un autre côté, le rendement d’élimination de la DCO demeure inchangé avec la hausse de la teneur en structure A1, constituée principalement d’hydroxydes d’aluminium.
Des comportements très différents ont été notés avec les trois structures adsorbantes lors de l’utilisation de la solution colorée alcaline. Ainsi, un très bon rendement d’élimination de la DCO (autour de 90 %) a été mesuré avec la structure A1 à partir d’une teneur de 2 g•L-1. Une augmentation beaucoup plus progressive de l’élimination de la DCO a été obtenue avec la hausse de la teneur en structure F4, avec un rendement de seulement 55 % avec 2 g•L-1 et 83 % avec 40 g•L-1.
L’adsorbant F1 s’est donc avéré très performant pour l’élimination de la DCO à faible dose (2 et 4 g•L-1), mais une chute importante a été mesurée aux teneurs plus élevées. Encore une fois, la présence de fer en solution pourrait contribuer significativement à la hausse de la DCO en solution et, par conséquent, à la baisse du rendement d’élimination de la DCO.
En effet, à partir d’une concentration de 10 g•L-1 des composés synthétiques, le rendement de décoloration atteint une valeur maximale, montrant que le colorant n'est plus présent en solution alors que le rendement en DCO présente certaines fluctuations, probablement dues a la présence de fer sous forme dissoute.Ceci a pu être confirmé par d’autres auteurs dans le cas de l’aluminium seul (Zidane et al., 2008).
Les résultats de décoloration et d’élimination de la DCO sont influencés par le pH du milieu, la nature et la concentration des composés adsorbants dans la solution colorée. On peut donc conclure que ces trois paramètres jouent un rôle important sur le rendement de l’élimination des matières oxydables et du colorant.
4. Conclusion
Différentes structures adsorbantes à base d’hydroxydes de fer et d’aluminium ont été produites par électrocoagulation avec des électrodes de fer, d’aluminium ou d’un mélange de ces deux types d’électrodes. L’analyse microscopique et élémentaire de ces structures a révélé que celles-ci étaient constituées principalement d’hydroxydes d’aluminium (bayerite) et d’oxydes (magnétite) et oxy-hydroxydes (geothite et lépidocrocite) de fer.
Des comportements presque similaires sont observés pour les coagulants/adsorbants A1 (98 % pour les solutions acides et 91 % pour les solutions basiques) et F1 (93 % pour les solutions acide et basiques) avec un rendement plus faible pour F4 dans la solution acide (80 %) lors de l’ajout d’une concentration de 4 g•L-1 des coagulants.
Des comportements très différents ont été notés avec les trois coagulants/adsorbants lors de l’utilisation de la solution colorée alcaline. On remarque une bonne élimination de la DCO atteignant une valeur se situant autour de 90 % pour la structure A1 à partir d’une teneur de 2 g•L-1. L’adsorbant F1 est très performant pour l’élimination de la DCO à faible dose (2 et 4 g•L-1), mais beaucoup moins aux teneurs plus élevées. La présence du fer en solution pourrait contribuer significativement à la hausse de la DCO en solution et, par conséquent, à la baisse du rendement d’élimination de la DCO.
Les résultats de décoloration et d’élimination de la DCO sont influencés par le pH du milieu et la nature et la concentration des composés adsorbants dans la solution colorée. Ces trois paramètres jouent un rôle important sur le rendement d’élimination du colorant diazoïque.
Parties annexes
Remerciements
Cette recherche a été réalisée avec l’appui financier du CRSNG, de l’AUPELF-UREF et du programme de Chaires de recherche du Canada.
Références bibliographiques
- Abdo M.S.E. et R.S. Al-Ameeri (1987). Anodic oxidation of a direct dye in an electrochemical reactor. J. Environ. Sci. Health, A22, 27-45.
- Ahlawat R., V.C. Srivastava, I.D. Mall et S. Sinha (2008). Investigation of the electrocoagulation treatment of cotton blue dye solution using aluminium electrodes. Clean, 36, 863-869.
- Aksu Z. et S. Tezer (2001). Equilibrium and kinetic modelling of biosorption of remazol black B by Rhizopus arrhizus in a batch system: effect of temperature. Proc. Biochem., 36, 431-439.
- Al-Ghouti M.A., M.A.M. Khraisheh, M.N.M. Ahmad et S. Allen (2009). Adsorption behaviour of methylene blue onto Jordanian diatomite: A kinetic study. J. Hazard. Mater., 165, 589-598.
- Alinsafi A., M. Khemis, M.N. Pons, J.P. Leclerc, A. Yacoubi, A. Benhammou et A. Nejmeddine (2005). Electro-coagulation of reactive textile dyes and textile wastewater. Chem. Eng. Proc., 44, 461-470.
- Al-Kdasi A., A. Idris, K. Saed et C.T.Guan (2004). Treatment of textile wastewater by advanced oxidation processes: a review. Global Nest Int. J., 6, 222-230.
- Amirtharahah A. et K.M. Mills (1982). Rapid-mix design for mechanisms of alum coagulation. J. Am. Water Works Assoc., 74, 210-216.
- APHA, AWWA et WPCF (1999). Standards methods for examination of water and wastewaters. 20th Edition, American Public Health Association, Washington, DC, États-Unis.
- Arslan-Alaton I. (2003). Review of the effects of dye-assisting chemicals on advanced oxidation of reactive dyes in wastewater. Color. Technol., 119, 345-353.
- Arslan-Alaton I. (2008). Treatability of a simulated spent disperse dyebath by chemical and electrochemical processes. Environ. Eng. Sci., 25, 295-308.
- Bailey S.E., T.J. Olin, R.M. Bricka et D.D.Adrian (1999). A review of potentially low-cost sorbents for heavy metals. Water Res., 33, 2469-2479.
- Ben Tahar F., R. Ben Cheikh et J.F.Blais (2004). Décoloration des eaux usées de levurerie par adsorption sur charbon. J. Environ. Eng. Sci., 3, 269-277.
- Can O.T., M. Bayramoglu et M.Kobya (2003). Decolorization of reactive dye solutions by electrocoagulation using aluminum electrodes. Ind. Eng. Chem. Res., 42, 3391-3396.
- Cenkin V.E. et A.N. Belevtsev (1985). Electrochemical treatment of industrial waste water. Effl. Water Treat. J., July, 243-247.
- Chang M.C., H.Y. Shu, H.H. Yu et Y.C.Sung (2006). Reductive decolourization and total organic carbon reduction of the diazo dye CI Acid Black 24 by zero-valent iron powder. J. Chem. Technol. Biotechnol., 81, 1259-1266.
- Chiou M.S. et H.Y.Li (2003). Adsorption behaviour of reactive dye in aqueous solution on chemical cross-linked chitosan beads. Chemosphere, 50, 1095-1105.
- Ciardelli G. et N.Ranieri (2001). The treatment and reuse of wastewater in the textile industry by means of ozonation and electroflocculation. Water Res., 35, 567-572.
- Cornell R.M. et U.Schwertmann (1996). The iron oxides. Structure, properties, reaction occurrence and uses. WILEY VCH (Éditeur), Weinheim, Allemagne.
- DOS SANTOS A.B., F.J. CERVANTES and J.B. E VAN LIER(2007, A review on current technologies for decolourisation of textile wastewaters: perspectives for anaerobic biotechnology. Bioresour. Technol., 98, 2369-2385.
- Dogan M., H. Abak et M.Alkan (2009). Adsorption of methylene blue onto hazelnut shell: Kinetics mechanism and activation parameters. J. Hazard. Mater., 164, 172-181.
- El-Ghazi I., M.K. Elamrani et M. Mansour (2004). Photocatalytic oxidation of the textile dye basic red 18 with irradiated titanium dioxide. Toxicol. Environ. Chem., 85, 1-6.
- Exall K.N. et G.W.Vanloon (2000). Using coagulants to remove organic matter. J. Am. Water Works Assoc., 92, 93-102.
- FRANK P., V.D. DER ZEE, VILLAVERDE S.(2005). Combined anaerobic–aerobic treatment of azo dyes-A short review of bioreactor studies. Water Res., 39, 1425-1440.
- Garg V.K., M. Amita, R. Kumar et R.Gupta (2004). Basic dye (methylene blue) removal from simulated wastewater by adsorption using Indian Rosewood sawdust: a timber industry waste. Dyes Pigments, 63, 243-250.
- Golder A.K., N. Hridaya, A.N. Samanta et S.Ray (2005). Electrocoagulation of methylene blue and eosin yellowish using mild steel electrodes. J. Hazard. Mater., B127, 134-140.
- Hashem A., R.A. Akasha, A. Ghith et D.A. Hussein (2007). Adsorbent based on agricultural wastes for heavy metal and dye removal: a review. Energy Educ. Sci. Technol., 19, 69-86.
- Holt P.K., G.W. Barton, M. Wark et C.A.Mitchell (2002). A quantitative comparison between chemical dosing and electrocoagulation. Colloids Surf. A: Physicochem. Eng. Aspects, 211, 233-248.
- Jolivet J.P. (1994). De la solution à l’oxyde : Condensation des cations en solution aqueuse. Chimie des surfaces des oxydes. Inter Édition, Paris, France.
- Kabdasli I., B. Vardar, I. Arslan-Alaton et O.Tuenay (2009). Effect of dye auxiliaries on color and COD removal from simulated reactive dyebath effluent by electrocoagulation. Chem. Eng. J., 148, 89-96.
- Kuperferle M.J., A. Galal et P.L. Bishop (2004). Electrolytic treatment of azo dyes containing o’o’-dihydroxyazo complexation sites. J. Environ. Eng. Sci., 3, 223-229.
- Lazaridis N.K., T.D. Karapantsios et D. Georgantas (2003). Kinetic analysis for the removal of a reactive dye from aqueous solution onto hydrotalcite by adsorption. Water Res., 37, 3023-3033.
- Li Y., B. Gao, T. Wu, B. Wang et X. Li (2009). Adsorption properties of aluminum magnesium mixed hydroxide for the model anionic dye Reactive Brilliant Red K-2BP. J. Hazard. Mater., 164, 1098-1104.
- Lin S.H. et C.F.Peng (1996). Continuous treatment of textile wastewater by combined coagulation, electrochemical oxidation and activated sludge. Water Res., 30, 587-592.
- Lorenc-Grabowska E. et G. Gryglewicz (2007). Adsorption characteristics of Congo Red on coal-based mesoporous activated carbon. Dyes Pigments, 74, 34-40.
- Mall I.D., S.N. Upadhyay et Y.C.Sharma (1996). A review on economical treatment of wastewaters and effluents by adsorption. Int. J. Environ. Stud., 51, 77-124.
- Marangoni R., M. Bouhent, C. Taviot-Guého, F. Wypych et F. Leroux (2009). Zn2Al layered double hydroxides intercalated and adsorbed with anionic blue dyes: A physico-chemical characterization. J. Colloid Interface Sci., 333, 120-127.
- Mathur N., P. Bhatnagar et P.Bakre (2006). Assessing mutagenicity of textile dyes from Pali (Rajasthan) using AMES bioassay. Appl. Ecol. Environ. Res., 4, 111-118.
- Merzouk B., B. Gourich, A. Sekki, K. Madani, C.h. Vial et M.Barkaoui (2009). Studies on the decolorization of textile dye wastewater by continuous electrocoagulation process. Chem. Eng. J., 149, 207-214.
- Mollah M.Y.A., S.R. Pathak, P.K. Patil, M. Vayuvegula, T.S. Agrawal, J.A.G. Gomes, M. Kesmez et D.L.Cocke (2004). Treatment of orange II azo-dye by electrocoagulation (EC) technique in a continuous flowcell using sacrificial iron electrodes. J. Hazard. Mater., B109, 165-171.
- Mollah M.Y.A., R. Schennach, J.P. Parga et D.L.Cocke (2001). Electrocoagulation (EC) science and applications. J. Hazard. Mater., B84, 29-41.
- Mutlu S.H., U. Yetis, T. Gurkan et L. Yilmaz (2002). Decolorization of wastewater of a baker’s yeast plant by membrane processes. Water Res., 36, 609-616.
- Naim M.M. et Y.M.El Abd (2002). Removal and recovery of dyestuffs from dyeing wastewaters. Sep. Purif. Methods, 31, 171-228.
- ÖZCAN A., YÜCEL ŞAHIN, A. SAVAŞ KOPARAL, MEHMET A. OTURAN (2008). Carbon sponge as a new cathode material for the electro-Fenton process: Comparison with carbon felt cathode and application to degradation of synthetic dye basic blue 3 in aqueous medium. J. Electroanal. Chem., 616, 71-78.
- ÖZCAN A., A MEHMET , N. OTURAN, YÜCEL ŞAHIN (2009). Removal of acid orange 7 from water by electrochemically generated Fenton’s reagent. J. Hazard.Mater., 163, 1213-1220.
- Palacio S.M., F.R. Espinoza-Quinones, A.N. Modenes, C.C. Oliveira, F.H. Borba et F.G.Silva (2009). Toxicity assessment from electro-coagulation treated-textile dye wastewaters by bioassays. J. Hazard. Mater., 172, 330-337.
- Pirillo S., M.L. Ferreira et E.H.Rueda (2007). Adsorption of alizarin, eriochrome blue black R, and fluorescein using different iron oxides as adsorbents. Ind. Eng. Chem. Res., 46, 8255-8263.
- Pirillo S., M.L. Ferreira et E.H. Rueda (2009). The effect of pH in the adsorption of alizarin and eriochrome blue black R onto iron oxides. J. Hazard. Mater., 168, 168-178.
- Ponnusami V., V. Gunasekar et S.N.Srivastava (2009). Kinetics of methylene blue removal from aqueous solution using gulmohar (Delonix regia) plant leaf powder: Multivariate regression analysis. J. Hazard. Mater., 169, 119-127.
- Rajeshwar K., J.G. Ibanez et G.M. Swain (1994). Electrochemistry and the environment. J. Appl. Electrochem., 24, 1077-1091.
- Robinson T., G. MucMullan, R. Marchant et P.Nigam (2001). Remediation of dyes in textile effluent: A critical review on current treatment technologies with a proposed alternative. Biores. Technol., 77, 247-255.
- Sevimli M.F. et C.Kinaci (2002). Decolorization of textile wastewater by ozonation and Fenton’s process. Water Sci. Technol., 45, 279-286.
- Shah V., M. Bhatt, P. Stopka et F. Nerud (2005). Copper based Fenton’s system for the decolourization of synthetic dyes and dye industry effluents. Asian J. Water Environ. Pollut., 2, 61-64.
- Skowronek M., I. Roterman, L. Konieczny, B. Stopa, J. Rybarska, B. Piekarska, A. Gorecki et M. Krol (2000). The conformational characteristics of Congo Red, Evans blue and Trypan blue. Comput. Chem., 24, 429-450.
- Torrades F., J. Garcia-Montano, J.A. Garcia-Hortal, L. Nunez, X. Dom`enech et J.Peral (2004). Decolorisation and mineralisation of homo-and heterobireactive dyes under Fenton and photo-Fenton conditions. Color. Technol., 120, 188-194.
- VILGE-RITTER A. (1997). Étude des mécanismes de la matière organique des eaux de surface par coagulation-floculation à l’aide de sels d’aluminium ou de fer. Thèse de doctorat, Faculté des Sciences et Techniques de Saint-Jérôme, Université d'Aix-Marseille 3, Aix-en-Provence, France, 178 p.
- Walker G.M., L. Hansen, J.A. Hanna et S.J.Allen (2003). Kinetics of a reactive dye adsorption onto dolomitic sorbents. Water Res., 37, 2081-2089.
- Zaviska F., P. Drogui, J.F. Blais et G. Mercier (2009). In situ active chlorine generation for the treatment of dye-containing effluents. J. Appl. Electrochem., 39, 2397-2408.
- Zidane F., P. Drogui, B. Lekhlif, J. Bensaid, J.F. Blais, S. Belcadi et K.El Kacemi (2007). Decolourization of dye-containing effluent using mineral coagulants produced by electrocoagulation. J. Hazard. Mater., 155, 153-163.
Liste des figures
Figure 1
Formule chimique du colorant synthétique trypan bleu (C34H28N6O14S4).
Chemical formula of the synthetic dye trypan blue (C34H28N6O14S4).
Figure 2a
Électrodes d’aluminium (A1).
Aluminium electrodes (A1).
Figure 2b
Électrodes de fer (F1).
Iron electrodes (F1).
Figure 2c
Électrodes d’aluminium et de fer (F4).
Aluminium and iron electrodes (F4).
Figure 3
Répartition de la taille des particules des différentes structures adsorbantes obtenues par granulométrie laser.
Particle size distribution of the different adsorbing structures obtained by laser particle sizer.
Figure 4
Variation du pH de la solution de colorant ([trypan bleu] i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).
Change in pH of the dye solution ([trypan blue] i = 3.75 mg•L-1) during trials with different concentrations of the adsorbing structures: (A) pHi = 4.8; (B) pHi = 9.8. (Contact time = 24 h, T = 20°C).
Figure 5
Rendements d’élimination de la couleur de la solution de colorant ([trypan bleu]i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).
Colour removal yields of the dye solution ([trypan blue] i = 3.75 mg•L-1) during trials with different concentrations of the adsorbing structures: (A) pHi = 4.8; (B) pHi = 9.8. (Contact time = 24 h, T = 20°C).
Figure 6
Rendements d’élimination de la DCO de la solution de colorant ([trypan bleu]i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).
Removal efficiencies for COD in the dye solution ([trypan blue] i = 3.75 mg•L-1) during trials with different concentrations of the adsorbing structures: (A) pHi = 4.8; (B) pHi = 9.8. (Contact time = 24 h, T = 20°C).
Liste des tableaux
Tableau 1
Composition élémentaire (mg•g-1) des différentes structures adsorbantes.
Elemental composition (mg•g-1) of the different adsorbing structures.







![Variation du pH de la solution de colorant ([trypan bleu] i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).](/fr/revues/rseau/2012-v25-n1-rseau5008468/1008534ar/media/5008573n.jpg)
![Rendements d’élimination de la couleur de la solution de colorant ([trypan bleu]i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).](/fr/revues/rseau/2012-v25-n1-rseau5008468/1008534ar/media/5008582n.jpg)
![Rendements d’élimination de la DCO de la solution de colorant ([trypan bleu]i = 3,75 mg•L-1) lors des essais de décoloration avec différentes concentrations des structures adsorbantes : (A) pHi = 4,8; (B) pHi = 9,8. (Temps de contact = 24 h, T = 20 °C).](/fr/revues/rseau/2012-v25-n1-rseau5008468/1008534ar/media/5008586n.jpg)