Résumés
Résumé
Peu de données sont disponibles sur la distribution des Apicomplexa parasites du tube digestif de l’homme. Ils causent pourtant des maladies diarrhéiques de très grande envergure. Une étude menée de janvier à août 2011, dans le cours d’eau Olézoa à Yaoundé (Cameroun), a visé à rechercher et caractériser les oocystes de Cyclospora cayetanensis. Les échantillonnages ont été effectués en amont et en aval du cours d’eau, sur deux stations localisées en zone fortement anthropisées. L’identification des oocystes de C. cayetanensis isolés à l’aide de l’observation directe après coloration au Lugol et selon la technique de Ziehl-Neelsen, a montré qu’ils sont constitués de deux sporocystes contenant chacun deux sporozoïtes. La dynamique d’abondance de ce microorganisme est significativement corrélée à la turbidité, à la température et au pH de l’eau (p < 0,01). Par ailleurs, les formes non sporulées sont plus abondantes que les formes sporulées dans l’environnement et sont fortement corrélées aux teneurs en oxygène dissous qui est un paramètre très important pour leur sporogénèse. En amont du cours d’eau, l’abondance la plus élevée de C. cayetanensis a été de 407 oocystes•L-1 et la valeur enregistrées en aval été de 250 oocystes•L-1. La population de C. cayetanensis observée a été largement dominée par les formes non sporulées de taille 8 µm. La concentration des oocystes la plus élevée en utilisant la technique directe et celle de Ziehl-Neelsen a été enregistrée respectivement au cours des mois de juin et juillet; ces périodes se situent respectivement à la fin de la petite saison des pluies et au début de la saison sèche.
Mots-clés :
- Cours d’eau,
- Cyclospora cayetanensis,
- oocystes,
- sporocystes,
- sporozoïtes
Abstract
Little information is available on the distribution of enteropathogenic apicomplexa of the human digestive apparatus, these agents being responsible for endemic diarrheic diseases. A study carried out in the Olézoa water course in Yaoundé (Cameroon) revealed that this water contains the oocysts of Cyclospora cayetanensis. Samples for the analysis of biological and physico-chemical characteristics were obtained upstream and downstream with respect to the strongly human polluted zone. The identification of Cyclospora cayetanensis oocysts by direct observation and Ziehl-Neelsen techniques revealed that these oocysts contain two sporocysts, each having two sporozoïtes. Statistically, turbidity, temperature and pH have a significant effect (p<0.01) on the population dynamics of these microorganisms. The highest mean concentration of oocysts identified upstream was 407 oocysts•L-1 in the month of August. The non sporulated forms of oocysts are more abundant than the sporulated forms in the environment and are strongly linked to dissolved oxygen levels, oxygen being a parameter that is very important for the process of sporulation and viability. Non sporulated forms of oocysts, 8 µm in size, are dominant in the ecosystem analyzed in our investigations. These resistant forms of parasites that are present in the surface and wastewater represent a considerable health risk to the inhabitants of the study zone who could easily be exposed to cyclosporiasis.The two methods which have been carried out are complementary in the characterisation of the resistant forms of these enteropathogens.
Keywords:
- Olezoa water course,
- oocysts,
- Cameroon,
- sporocysts,
- sporulated forms,
- non sporulated forms,
- sporozoïtes,
- Cyclospora cayetanensis
Corps de l’article
1. Introduction
L’eau est une ressource naturelle nécessaire à l’homme pour ses besoins alimentaires, ses activités agricoles et industrielles et lui sert de loisir (Neveuet al., 2001). Cependant, les activités humaines sont aujourd’hui la principale cause de la forte dégradation des ressources en eau avec pour conséquence la dissémination de plusieurs agents pathogènes (virus, bactéries, parasites, champignons) dans l’environnement aquatique. Dans les pays en voie de développement, plus des deux tiers de la population n’ont pas accès à l’eau potable. Ce manque d’eau potable est probablement une conséquence de la dégradation accrue de l’environnement, de la contamination constante des cours d’eau et de la nappe phréatique par les effluents industriels et domestiques, et de la diminution des ressources en eau (Pedro et Germano, 2001).
Au Cameroun, en général, la ville de Yaoundé en particulier connaît, comme plusieurs autres agglomérations, des problèmes d’approvisionnement en eau potable. La Camerounaise des Eaux (CDE) et la CAMWATER, structures en charge de la production et de la distribution de l’eau potable au Cameroun, ne couvrent pas les besoins en eau d’une population en pleine croissance démographique, obligeant cette dernière à s’approvisionner dans les cours d’eau, les lacs et les sources, ceci dans l’ignorance totale de la qualité de ces eaux. Très peu de données sont disponibles sur la distribution dans les milieux aquatiques, des formes de résistance des pathogènes flagellés ou des Apicomplexa, parasites du tube digestif de l’homme; ceux-ci causent pourtant des maladies diarrhéiques (Abdel-Hafeezet al., 2012). Selon Nguendo (2011) et Hallet al. (2012), les infections dues aux entéro-pathogènes et les maladies diarrhéiques constituent un problème de santé publique pour la plupart des pays en développement, et le Cameroun n'y fait pas exception.
Des études menées dans certains pays, notamment au Ghana (Kwakye-Nuakoet al., 2007) et en Turquie (Beheraet al., 2008; Ozdamaret al., 2008) ont montré la présence de C. cayetanensis dans les eaux de consommation. Aucune étude dans les milieux aquatiques au Cameroun n’a encore été menée sur C. cayetanensis, parasite en émergence associé aux gastroentérites aiguës responsable des infections diarrhéiques à la fois chez les individus immunodéprimés et immunocompétents. Il est aussi responsable chez l’homme de douleurs abdominales, de nausées et de pertes de poids (Alakpaet al., 2002), aussi bien chez les enfants que chez les adultes (Chacin-Bonilla, 2010). L’épidémiologie, la biologie et la dose infectieuse de l’organisme n’ont pas encore été bien définies, même si la voie féco-orale est privilégiée dans la transmission de cet entéropathogène opportuniste (Ajeagahet al., 2007; Alakpaet al., 2002). De même, il est associé aux troubles intestinaux chez les voyageurs (Pandeyet al., 2011).
Par ailleurs, les mécanismes d’infection, le rôle des paramètres environnementaux dans la sporogénèse et la dynamique des oocystes en milieu aquatique ne sont pas encore bien élucidés (Mtapuri-Zinyowera, 2010). Cette coccidie constitue donc un réel problème de santé publique et devrait faire l’objet d’une attention particulière. La présente étude a pour but d’isoler, de caractériser et d’identifier les oocystes de C. cayetanensis dans le cours d’eau Olézoa à Yaoundé (Cameroun, Afrique Centrale).
2. Matériel et méthodes
2.1 Description des sites d’études
La ville de Yaoundé, capitale du Cameroun, est située sur la bordure ouest du plateau sud-camerounais, entre 3°30’et 3°58’ de latitude Nord et entre 11°20’ et 11°40’ de longitude Est (Suchel, 1988). Ce plateau a une altitude moyenne de 750 m. Plusieurs cours d’eau de la ville de Yaoundé appartiennent au bassin hydrographique du Mfoundi, constitué de nombreux ruisseaux qui sont pour la plupart permanents. Ces affluents se jettent dans la rivière Mfoundi qui porte le nom de ce bassin.
Le cours d’eau Olézoa a été choisi sur la base de l’ampleur des difficultés d’accès à l’eau potable et de l’état avancé de l’insalubrité de l’environnement. Ce ruisseau est situé entre 700 et 745 m d’altitude. Son bassin versant a un périmètre d’environ 8,25 km et une superficie d’environ 2,3 km2. Il traverse une zone d’habitats spontanés. Ce cours d’eau prend sa source au nord-est de la ville de Yaoundé (Figure 1).
Figure 1
Bassin versant de l’Olézoa présentant les stations d’échantillonnage.
Map of the Olézoa watercourse indicating the sampling points.
2.2 Prélèvements des échantillons
Cette étude s’est déroulée de janvier 2010 à août 2011 avec un pas d’échantillonnage mensuel. Au total, deux points de prélèvements ont été choisis : un en amont et un en aval du ruisseau. Les échantillons d’eau ont été prélevés dans des flacons en polyéthylène de 1 000 mL à double bouchage et été transportés à température ambiante au laboratoire pour les analyses physico-chimiques et biologiques.
2.3 Analyses physico-chimiques
Les paramètres physico-chimiques examinés ont été la température, la turbidité, les matières en suspension (MES), la couleur, le potentiel d’hydrogène (pH), l’oxygène dissous (O2), la conductivité électrique, les solides totaux dissous, le gaz carbonique dissous (CO2), l’alcalinité, la dureté calcique et la demande biochimique en oxygène (DBO5). Exceptée la DBO5) qui a été analysée par respirométrie, les autres paramètres ont été analysés par spectrophotométrie et volumétrie, suivant les techniques préconisées par l’American Public Heath Association (APHA, 1995, 2009).
2.4 Recherche, isolement et identification des oocystes de C. cayetanensis
Les échantillons d’eau prélevés ont été laissés pour sédimentation dans les récipients pendant 24 heures à température ambiante. Les dépôts obtenus ont ensuite été homogénéisés et un sous-spécimen a été prélevé et distribué dans les tubes auxquels 0,5 mL de formol a été additionné. Deux méthodes d’identification ont été utilisées pour isoler et dénombrer les oocystes de C. cayetanensis; il s’agit de la méthode directe et de la technique de Ziehl-Neelsen.
La méthode directe a consisté à l’ajout de 5 mL d’eau distillée et les contenus des tubes sont centrifugés à 500 tours•min-1 pendant cinq minutes, pour favoriser la sédimentation. Le culot est prélevé à l’aide d’une micropipette et posé sur des lames porte-objet; l’examen et le dénombrement des oocystes sont réalisés au microscope Olympus aux grossissements 40X et 100X.
La technique de Ziehl-Neelsen quant à elle consiste en l’ajout d’une solution de sulfate de zinc (10 %) au culot qui est ensuite centrifugé à 500 tours•min-1 pendant cinq minutes pour faire flotter les oocystes. Le surnageant qui contient les oocystes est prélevé à l’aide d’une micropipette et posé sur des lames porte-objet. Après fixation au méthanol et coloration à la fuchsine phénolique, la préparation est rincée à l’eau et à l’acide sulfurique (2 %). Une contre-coloration au bleu de méthylène (5 %) est ensuite réalisée. Après rinçage à l’eau et séchage à l’air, l’examen et le dénombrement des oocystes sont réalisés au microscope Olympus aux grandissements 40X et 100X.
2.5 Analyse des données
Le volume intégral (Vx) du culot a été enregistré après homogénéisation du culot, et un volume précis (Vy) a été prélevé et réparti dans différents tubes à essais. Le culot final de chaque tube à essais a été réparti sur des lames, puis le nombre d’oocystes est compté. Le nombre total d’oocystes dans l’échantillon a été calculé en multipliant la valeur obtenue pour toutes les lames par la fraction (Vx/Vy) et le résultat a été enfin ramené au litre (Ajeagahet al., 2007). Les relations entre la distribution des oocystes de C. cayetanensis et les variables physico-chimiques des eaux ont été évaluées par le test de corrélation de Spearman.
3. Résultats
3.1 Variations spatio-temporelles des paramètres physico-chimiques dans les différentes stations
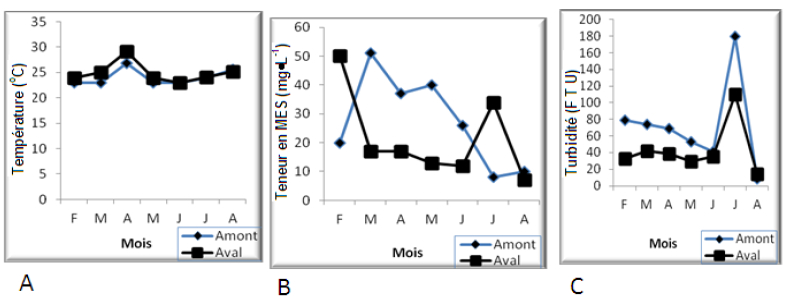
Les valeurs de température ont varié de 23 à 29,2 °C; les plus élevées ont été enregistrées en avril à tous les points de prélèvement alors que les valeurs les plus faibles ont été relevées de février à mars et de mai à juin (Figure 2). Les valeurs de MES relevées pendant la période d’étude ont varié de 8 à 51 mg•L-1 (Figure 2). Les plus faibles valeurs ont été enregistrées en amont et en aval du cours d’eau au cours des campagnes d’échantillonnage du mois de mars et d’août (Figure 2).
Figure 2
Variation spatio-temporelle de la température (A), des teneurs en MES (B) et de la turbidité (C) le long du cours d’eau.
The spatio-temporal variation of temperature (A), suspended solids (B) and turbidity (C) in the water course.
Les plus fortes valeurs de turbidité (notées en février) et de couleur (notées en juillet), ont été respectivement de 180 FTU et 445 Pt-Co; les plus faibles enregistrées en juin et août ont été de 8 FTU et 95 Pt-Co respectivement (Figures 2 et 3). Pendant toute la période d’étude, les valeurs de pH ont fluctué entre 6,94 et 7,92 (Figure 3). Les plus fortes valeurs ont été enregistrées en mai et juillet dans toutes les stations. Ces valeurs se rapprochent presque de la neutralité (pH = 7 UC) et indiquent que les eaux de l’Olézoa sont neutres à légèrement basiques. Quant au CO2 dissous, les teneurs calculées oscillent entre 17,6 et 22,88 mg•L-1 (Figure 4).
Figure 3
Variation spatio-temporelle de la Conductivité (A), de la couleur (B), du pH (C).
Variation of turbidity (A), colour (B) and pH (C) in the water course.
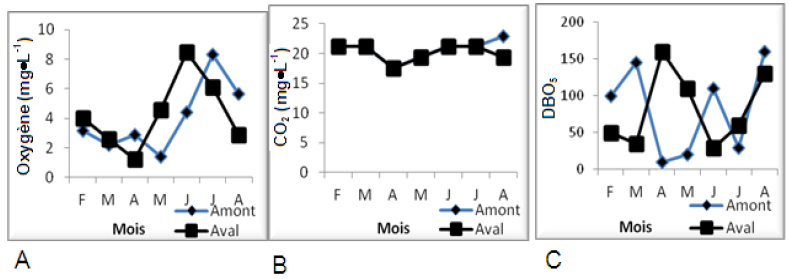
Figure 4
Variation spatio-temporelle de l’Oxygène dissous (A), du CO2 (B) et du DBO5 (C), le long du cours d’eau.
The spatio-temporal variation of dissolved oxygen (A), CO2 (B) and DBO5 (C) in the water course.
Les profils de variation de la conductivité électrique relevés pendant toute la période d’étude présentent un maximum de 660 µS•cm-1 et un minimum de 240 µS•cm-1, enregistrés en mai respectivement en amont et en aval (Figure 3). Globalement, les valeurs de la conductivité électrique témoignent de la très forte minéralisation de ces eaux.
Les courbes illustrant les variations de la teneur en oxygène dissous sont très superposables. Les valeurs de l’oxygène dissous fluctuent entre 1,21 et 8,5 mg•L-1 durant la période d’étude (Figure 4). Les fortes valeurs en oxygène dissous enregistrées de juin à août témoignent de la bonne oxygénation des eaux de ces stations. L’évolution des valeurs de la DBO5 est similaire à toutes les stations (Figure 4). Les valeurs extrêmes, 10 et 160 mg•L-1, sont relevées en amont en avril.
3.2 Variation spatio-temporelle des densités, de forme et de la taille des oocystes de C. cayetanensis
Au cours de l’étude, l’abondance moyenne d’oocystes de C. cayetanensis, évaluée par la méthode directe, a varié de 156 oocystes•L-1 en amont à 183 oocystes•L-1 en aval (Figure 5). La population de C. cayetanensis observée est plus dominée par les formes non sporulées que par celles sporulées, et ce, dans tous les sites, pendant toute la période d’étude et pour les deux méthodes d’étude.
La taille des oocystes quant à elle a varié de 8 à 10 µm, et la taille 8 µm a dominé dans tous les points d’échantillonnage (Figure 5). La densité des oocystes de C. cayetanensis en amont du cours d’eau, évaluée par observation directe, a varié de 37 à 350 oocystes•L-1 respectivement en février et août, alors que par la méthode de Ziehl-Neelsen, elle a varié de 14 à 100 oocystes•L-1 (Figure 5). Les concentrations les plus élevées en oocystes ont été enregistrées au cours des mois de juillet et août par la méthode de Ziehl-Neelsen et la méthode directe (Figure 5), avec dominance en moyenne des formes non sporulées.
Figure 5
Dynamique d’abondance des tailles des oocystes de Cyclospora cayetanensis (A), des formes sporulées et non sporulées a l’amont (B) et aval (C) observée par les deux méthodes.
Changes in the size distribution of oocysts of Cyclospora cayetanensis (A) and of (sporulated and non sporulated) forms of Cyclospora cayetanensis observed by two methods upstream (B) and downstream (C).
En aval du cours d’eau, l’abondance de C. cayetanensis évaluée par la méthode d’observation directe, a varié de 38 à 250 oocystes•L-1 en février et août respectivement, alors que par la méthode de Ziehl-Neelsen, elle a varié de 29 à 100 oocystes•L-1 (Figures 5-6). Les concentrations les plus élevées en oocystes ont été enregistrées au cours des mois de juillet et d’août par les méthode Ziehl-Neelsen et directe, avec la dominance des formes non sporulées durant toute la période d’étude (Figures 5-6). De fortes corrélations ont été observées entre l’abondance des oocystes de C. cayetanensis et certains paramètres physico-chimiques tels que la turbidité, le pH et l’oxygénation (Tableau 1).
Figure 6
Forme de sporozoite (A) et d’oocystes non sporulées (B) et sporulées (C) de Cyclospora cayetanensis identifiées dans le milieu aquatique.
Forms of sporozoite (A), unsporulated oocysts (B) and sporulated oocysts (C) of Cyclospora cayetanensis that are identified in the aquatic system.
Tableau 1
Coefficients de corrélation entre les variables physico-chimiques et la charge des oocystes.
Correlation coefficients between the physico-chemical parameters and the oocystic load.
4. Discussion
La température des eaux de l’Olézoa varie peu de l’amont vers l’aval du cours d’eau. Ceci s’expliquerait par le fait que la température de l’eau épouse l’évolution thermique ambiante qui varie peu pour les zones tropicales. Les valeurs de pH enregistrées au cours de l’étude fluctuent entre 6,94 et 7,92 UC. Globalement, ces valeurs indiquent que les eaux de l’Olézoa sont légèrement acides à légèrement basiques (Figures 2-4). Ceci serait dû aux apports exogènes des effluents, soit directement, soit par l’intermédiaire de tributaires. Néanmoins, ces valeurs restent dans la gamme de pH des eaux naturelles favorables à la vie aquatique (5-9 UC) (Angelier, 2000). Excepté au mois de juin au cours duquel les teneurs en O2 dissous atteignent 8,5 mg•L-1, les autres valeurs varient de 1 m•L-1 a 6 m•L-1, donc insuffisantes pour assurer l’autoépuration de charge polluante de ce milieu aquatique (Figure 4). De plus, une corrélation positive et significative (P<0,01) a été observée entre ces deux variables. Les teneurs moyennes de l’eau en MES relativement faibles seraient dues au fait que ce cours d’eau, dans sa grande majorité, traverse des zones marécageuses qui jouent le rôle de filtre épurateur (Figure 2).
Les valeurs de la conductivité électrique enregistrées durant la période d’étude (en moyenne 660 à 240 µS•cm-1) indiquent une minéralisation moyenne et accentuée de ces eaux. Cette minéralisation est liée aux ions contenus dans les eaux analysées ainsi qu’à la nature équatoriale du sol de la zone de Yaoundé (Nolaet al., 2006). En effet, Rodier (1996) faisait remarquer qu’une conductivité comprise entre 200 et 333 µS•cm-1, et entre 333 et 666 µS•cm-1 indiquerait une minéralisation moyenne et accentuée. Les valeurs de DBO5 relevées durant la période d’étude (10 et 160 mg•L-1) montrent une pollution organique des eaux du cours d’eau et varie en fonction de la qualité de l’eau. En effet, les valeurs moyennes obtenues relativement élevées traduisent la richesse en matières organiques biodégradables dues aux eaux usées non traitées provenant des hôpitaux, du restaurant et de la cité universitaire, du campus et des maisons environnantes (Figures 2-4). Ces résultats montrent une forte pression anthropique. Fotoet al. (2011) ont souligné que l’anthropisation en zone urbaine est l’un des facteurs de la dégradation des milieux aquatiques due à leur enrichissement en matières organiques. Par ailleurs, la dynamique d’abondance de C. cayetanensis est positivement corrélée à la turbidité de l’eau et la température (P<0,05), ainsi qu’au pH (P<0,01) (Tableau 1).
La caractérisation morphologique de C. cayetanensis au microscope montre que les oocystes sont arrondis, mesurent de 8 à 10 µm de diamètre et se présentent sous deux formes (sporulées et non sporulées). Ceci indique les difficultés qui existeraient dans le suivi de l’infection et du cycle de transmission de ce pathogène. Pour toutes les deux méthodes d’obseravtion utilisées, la population de C. cayetanensis observée a été largement dominée par les formes non sporulées, et ce, dans tous les sites, pendant toute la période d’étude (Figures 5-6). Ceci serait dû au rejet des oocystes dans l’environnement à travers les fèces, des formes non sporulées susceptibles de subir par la suite une sporulation (Ortega et Sanchez, 2010). Dans la ville de Yaoundé, certaines populations riveraines des ruisseaux ouvrent leurs toilettes vers ces hydrosystèmes pour évacuer leurs matières fécales.
Par ailleurs, une corrélation positive (P<0,05) a été notée entre la turbidité et la dynamique d’abondance des formes non sporulées et sporulées, d’où l’importance de ce paramètre dans la sporulation des oocystes (Tableau 1). À ce sujet, Sunderlandet al. (2007) soulignent que la diminution de la turbidité d’une eau est très souvent reliée à une diminution d’abondance des oocystes de certaines coccidies telles que Cryptosporidium sp et autres Apicomplexa. De plus, des corrélations positives et significatives ont été obtenues entre l’oxygène dissous, la température, le pH et la dynamique d’abondance des oocystes, montrant que la contamination peut se faire soit par les formes sporulées, soit par les formes non sporulées. Milordet al. (2011) soulignent que l’émission des oocystes par le même hôte peut durer 4 à18 jours avec des symptômes de fatigue.
Dans le cours d’eau Olézoa, les oocystes de taille 8 µm ont été les plus abondants. Les deux méthodes d’identification utilisées sont complémentaires dans la caractérisation des formes de résistances de cet entéropathogène. Selon Baimoyet al. (2010) et Ciçeket al. (2011), le manque de méthode d’analyse et de données épidémiologiques peut augmenter la morbidité et/ou la mortalité chez les sujets dont la qualité de l’eau et de la nourriture constitue une priorité (Chacin-Bonilla et Barrios, 2011).Telle est la situation de Yaoundé et des autres villes urbaines dont les normes de rejets des effluents dans les écosystèmes aquatiques ne sont pas applicables. Sur le plan temporel, la densité des oocystes de C. cayetanensis la plus élevée en utilisant la technique directe et celle de Ziehl-Neelsen, a été notée au cours des mois de juin et juillet qui marquent respectivement la fin de la petite saison des pluies et le début de la petite saison sèche pendant laquelle il y a accumulation des oocystes dans le milieu aquatique. Ces résultats se rapprochent à ceux de Turgayet al. (2007) qui ont noté la forte prévalence de Cyclosporose durant la transition saison sèche - saison pluie.
5. Conclusion
Cette étude a permis l’isolement et la mise en évidence des oocystes de C. cayetanensis dans les eaux de surface de la ville de Yaoundé. Les résultats des analyses physico-chimiques et biologiques de ces eaux montrent que les eaux du cours d’eau sont polysaprobes et contaminées par un grand nombre d’oocystes non sporulés et sporulés de C. cayetanensis. Les resultats obtenus révèlent une prévalence significative de ces oocystes dans le cours d’eau durant la période de saison sèche et de saison des pluies. Les abondances optimales en oocystes de C. cayetanensis ont atteint en amont du cours d’eau une moyenne de 407 oocystes•L-1 en août. La présence de ces oocystes dans le cours d’eau Olézoa de la ville de Yaoundé est donc un potentiel risque de santé des populations. Des mesures environnementales appropriées ainsi que les procédés adéquats de traitement s’imposent pour éviter une transmission prépondérante de la cyclosporose.
Parties annexes
Références bibliographiques
- ABDEL-HAFEEZ E.H., A.K. AHMAD, B.A. ALI et F.A. MOSLAM (2012). Opportunistic parasites among immunosuppresed children in Minia District. Egypt. Korean J. Parasitol., 50, 57-62.
- AJEAGAH G., T. NJINÉ, M. NOLA, S.F. MENBOHAN et M.W. NDAYO (2007). Évaluation de l’abondance des formes de résistance de deux protozoaires pathogènes (Giardia sp et Cryptosporidium sp) dans deux biotopes aquatiques de Yaoundé (Cameroun). Cahiers Santé, 17, 167-172.
- American Public Health Association, American Water Works Association (APHA), (1995). Water Environment Federation. Standard methods for the examination of water and wastewater. New York: American Public Health Association, pp. 9-52.
- A.P.H.A. (America Public Health Agency) (2009). Standard methods for the examination of water and waste-water. APHA-AWWAWPCF (Éditeur), Pennsylvanie, Washington, 1150 p.
- ALAKPA G., A.F. FAGBERRO-BEYIOKU et S.C. CLARKE (2002). Cyclospora cayetanensis in stools submitted to hospitals in Lagos, Nigeria. Inter. J. Infect. Dis., 6, 314-317.
- ANGELIER E. (2000). Écologie des eaux courantes. TECH & DOC (Éditeur), Paris, 199 p.
- BAIMOY A.M., K.A. MOHAMED, S.A. SHAHAT et A.S. AL-SAADAWY (2010). Opportunistic parasitic infections among immunocompromised Egyptian patients. Egypt J. Sci., 3, 797-808.
- BEHERA B., B.R. MIRDHA, G.K.MAKHARIA, S. BHATNAGAR, S. DATTAGUPTA, et J.C. SAMANTARAY (2008). Parasites in patients with malabsorption syndrome: A clinical study in children and adults. Diag. Dis. Sci., 53, 672-679.
- CHACIN-BONILLA L. (2010). Epidemiology of Cyclospora cayetanensis: A review focusing in endemic areas. Acta. Tropica, 115, 181-193.
- CHACIN-BONILLA L. et F. BARRIOS (2011). Cyclospora cayetanensis: Biology, environmental distribution and transfer. Biomedica., 31, 132-44.
- CIÇEK M., F. UÇMAK et T. OZEKINCI (2011). Two diarrhea cases caused by Cyclospora cayetanensis. Microb. Bull., 45, 553-557.
- FOTO M.S., T.H. ZEBAZE, T.N.L. NYAMSI, G. AJEAGAH et T. NJINE (2011). Évolution spatiale de la diversité des peuplements de macroinvertébrés benthiques dans un cours d’eau anthropisé en milieu tropical (Cameroun). Euro. J. Sci. Res., 55, 291-300.
- Hammer H., D.A. Harper et P.D. Ryan (2001). PAST: Paleontological Statistics Software Package for Education and Data Analysis. Paleo. Electronica., 4, 1-9.
- HALL R., J.L. JONES, S. HURD, G. SMITH, B.E. MAHON et B.L. HERWALDT(2012). Population based active surveillance for Cyclospora infection. United States, Foodborne Diseases Active Surveillance Network (FoodNet) 1997-2009. Clin. Infect. Dis., 54, Suppl. 5, S411-7.
- KWAKYE-NUAKO G., P. BORKETEY, I. MENSAH-ATTIPOE, R. ASMAH et P. YEH-KUMI (2007). Sachets drinking water in Accra: the potential threats of transmission of enteric pathogenic protozoan organism. Ghana Med. J., 41, 62-67.
- MILORD F., E. LAMPRON-GOULET, M. ST-AMOUR, E. LEVAC et D. RAMSAY (2011). Cyclospora cayetanensis: a description of clinical aspects of outbreak in Quebec, Canada. Epid. Infect., 27, 1-7.
- MTAPURI-ZINYOWERA S. (2010). Prevalence of intestinal parasites in urban, rural and commercial farming communities in Zimbabwe. Int.J. Infect. Dis., 10, 302.
- NEVEU A., C. RIOU, R. BONHOMME, P. CHASSIN et F. PAPY (2001). L’eau dans l’espace rural, vie et milieux aquatique. INRA, Paris, QUAE (éditeur), 300 p.
- NGUENDO Y.H.B. (2011). Modèle topographique et maladies diarrhéiques à Yaoundé (Cameroun) : un essai de géomorphologie médicale en milieu urbain tropical. Int. J. Adv. Stud. Res. Africa, 1, 83-98.
- NOLA M., T. NJINE, N. KEMKA, A.H. ZEBAZE TOGOUET, P. SERVAIS, M. MESSOULI, C. BOUTIN, A. MONKIEDJE et S. FOTO MENBOHAN (2006). Transfert des bactéries fécales vers une nappe phréatique à travers une colonne de sol en région équatoriale : Influence de la charge en eau appliquée en surface. Rev. Sci. Eau, 19, 101-112.
- ORTEGA Y.R. et R. SANCHEZ (2010). Update on Cyclospora cayetanensis, a food-borne and waterborne parasite. Clin. Microb. Rev., 23, 218-234.
- OZDAMAR, M.T., S. TURKOGLU et E. HAKKO (2008). Outbreak of Cyclosporiasis in Istanbul, Turkey in adults infected with HIV. Clinical manifestations, treatment, and prophylaxis. Ann. Int. Med., 121, 654-657.
- PANDEY P., L. BODHIDATTA, M. LEWIS, D.R. SHLIM, W. CAVE, R. RAJAH, M. SPINGER, T. BATCHELOR, S. SORNSAKRIN et C.J. MASON (2011). Travelers’ diarrhea in Nepal: an update on the pathogens and antibiotic resistance. J. Trav. Med., 18, 102-108.
- PEDRO M.L.G. et M.I.S. GERMANO (2001). Water: A national security problem (Portuguese). Rev. High Aliment., 15, 15-18.
- RODIER J. (1996). L’analyse de l’eau. 8e édition, DUNOD (Éditeur), Paris, 1384 p.
- SUCHEL J.B. (1988). Les climats du Cameroun. Thèse de Doctorat d’État, Université Saint-Étienne, France, 1177 p.
- SUNDERLAND D., T.K. GRACZYK, L. TAMANG et P.N. BREYSSE (2007). Impact of bathers on levels of Cryptosporidium parvum oocysts and Giardia lambliacysts in recreational beach waters. Water Res., 41, 3483-3795.
- TURGAY N., A. YOLASIGMAZ, D.D. ERDOGAN, F.Y. ZEYREK et A. UNER (2007). Incidence of Cyclosporiasis in patients with gastrointestinal symptoms in Western. Turkey. Med. Sci. Monitor., 13, 34-39.
Liste des figures
Figure 1
Bassin versant de l’Olézoa présentant les stations d’échantillonnage.
Map of the Olézoa watercourse indicating the sampling points.
Figure 2
Variation spatio-temporelle de la température (A), des teneurs en MES (B) et de la turbidité (C) le long du cours d’eau.
The spatio-temporal variation of temperature (A), suspended solids (B) and turbidity (C) in the water course.
Figure 3
Variation spatio-temporelle de la Conductivité (A), de la couleur (B), du pH (C).
Variation of turbidity (A), colour (B) and pH (C) in the water course.
Figure 4
Variation spatio-temporelle de l’Oxygène dissous (A), du CO2 (B) et du DBO5 (C), le long du cours d’eau.
The spatio-temporal variation of dissolved oxygen (A), CO2 (B) and DBO5 (C) in the water course.
Figure 5
Dynamique d’abondance des tailles des oocystes de Cyclospora cayetanensis (A), des formes sporulées et non sporulées a l’amont (B) et aval (C) observée par les deux méthodes.
Changes in the size distribution of oocysts of Cyclospora cayetanensis (A) and of (sporulated and non sporulated) forms of Cyclospora cayetanensis observed by two methods upstream (B) and downstream (C).
Figure 6
Forme de sporozoite (A) et d’oocystes non sporulées (B) et sporulées (C) de Cyclospora cayetanensis identifiées dans le milieu aquatique.
Forms of sporozoite (A), unsporulated oocysts (B) and sporulated oocysts (C) of Cyclospora cayetanensis that are identified in the aquatic system.
Liste des tableaux
Tableau 1
Coefficients de corrélation entre les variables physico-chimiques et la charge des oocystes.
Correlation coefficients between the physico-chemical parameters and the oocystic load.







 10.7202/013044ar
10.7202/013044ar