Article body
Le paludisme constitue la première endémie parasitaire dans le monde. Près de 40 % de la population mondiale vit en zone à risque et on enregistre entre 300 et 500 millions de cas cliniques chaque année avec plus de un million de décès, principalement des enfants de moins de cinq ans [1, 2]. Le paludisme est causé par un protozoaire du genre Plasmodium, qui infecte alternativement les hôtes humains et des moustiques du genre Anopheles. Parmi les quatre espèces à l’origine d’infections chez l’homme (Plasmodium falciparum, P. vivax, P. malariae et P. ovale), P. falciparum provoque les infections les plus graves, souvent mortelles.
De nombreux antipaludiques sont actuellement disponibles, mais le parasite a développé des chimiorésistances, notamment aux molécules les plus abordables pour les populations à risque (chloroquine et association sulfadoxine/pyriméthamine) [3]. Seuls les dérivés d’artémisinine et la quinine semblent, pour l’instant, épargnés par les phénomènes de résistance. La mise en place de bithérapies ne paraît plus suffisante pour contenir la maladie ; il est urgent de développer de nouveaux antipaludiques aux mécanismes d’action originaux et de faible coût [4].
Plasmodium entame son développement chez l’homme par une multiplication dans les hépatocytes. Après une dizaine de jours, les parasites sont libérés dans le sang et envahissent les érythrocytes. Cette phase intra-érythrocytaire constitue la phase symptomatique de la maladie avec une destruction massive des hématies et parfois une adhérence aux vaisseaux sanguins des grands organes comme le cerveau, restreignant le flux sanguin, avec de graves conséquences (Figure 1A).
Figure 1
Cycle biologique et structure de Plasmodium chez l’homme.
A. Lors de son repas sanguin, le moustique du genre Anopheles injecte le parasite sous forme sporozoïte. Les parasites se multiplient dans les hépatocytes pendant une dizaine de jours puis sont libérés dans le sang sous forme de mérozoïtes qui envahissent les globules rouges. Cette prolifération intra-érythrocytaire qui passe par trois stades successifs (anneau, trophozoïte et schizonte) conduit à une destruction massive des hématies et constitue la phase symptomatique de la maladie. Au cours de cette phase, certains parasites se différencient en gamétocytes mâles ou femelles, qui seront ingérés par un moustique lors d’un repas sanguin sur un sujet impaludé. Après une multiplication sexuée et une migration vers les glandes salivaires, le moustique est prêt à infecter un nouvel hôte. B.Plasmodium, bien que possédant sa propre membrane plasmique (PPM), se développe à l’intérieur d’une vacuole parasitophore (PV) dont la membrane (PVM) le sépare du cytoplasme érythrocytaire. Il possède les organites habituels d’un eucaryote (noyau, réticulum endoplasmique [RE] et appareil de Golgi rudimentaires, une mitochondrie [Mit]) ainsi que des organites spécifiques. Le complexe apical composé des micronèmes (Mic), des rhoptries (R) et des granules denses (DG) sert à l’invasion de la cellule hôte. La vacuole digestive (FV) permet au parasite de dégrader l’hémoglobine en hème. L’apicoplaste (A) est le vestige d’un plaste qui résulte d’une endosymbiose avec une algue rouge. Au cours de son développement, le parasite met en place dans le cytoplasme de l’érythrocyte un réseau membranaire (TVN : réseau tubulovésiculaire, MC : corpuscules de Maurer) impliqué dans le trafic moléculaire entre le parasite et la membrane de l’érythrocyte (EPM) (d’après [13]).
Nous nous intéressons ici à la biogenèse membranaire de Plasmodium, au cours de sa phase intra-érythrocytaire. Le parasite prolifère à l’intérieur d’une vacuole parasitophore, dans l’érythrocyte mature, une cellule ayant perdu son noyau et la capacité de synthétiser protéines et lipides. Outre les organites habituels d’un eucaryote, Plasmodium possède un complexe apical (micronèmes, rhoptries et granules denses) servant à l’invasion, ainsi qu’une vacuole digestive et un apicoplaste (Figure 1B). Pour assurer sa prolifération (P. falciparum peut donner jusqu’à 30 nouveaux parasites au cours de son cycle de 40-48 heures), le parasite intracellulaire doit synthétiser de nombreuses membranes. Contrairement à la plupart des organismes eucaryotes, les membranes de Plasmodium sont dénuées de cholestérol et ont pour composante lipidique essentielle des phospholipides. Les deux phospholipides majoritaires sont la phosphatidylcholine (40-50 %) et la phosphatidyléthanolamine (35-45 %) ; le phosphatidylinositol représente jusqu’à 11 % tandis que la sphingomyéline y est quasi absente [5]. Plasmodium doit posséder et met en place ses propres voies de biosynthèse pour effectuer une néo-synthèse d’une quantité considérable de phospholipides (jusqu’à 6 fois le contenu de la cellule hôte). L’approche pharmacologique consiste à cibler cette biosynthèse indispensable à la construction des structures membranaires du parasite et donc à sa survie. Les phospholipides sont synthétisés à partir de têtes polaires et d’acide gras puisés dans le plasma. Ce métabolisme paraît unique par son intensité et la multiplicité des voies métaboliques utilisées (Figure 2A). Il combine des voies généralement présentes chez les procaryotes, les eucaryotes et, encore plus remarquable, les plantes. La principale voie de biosynthèse de phosphatidylcholine semble être la voie de synthèse de novo, dite voie de Kennedy, qui met en jeu un système d’import de choline et trois enzymes. Le laboratoire a aussi montré que la sérine pouvait être décarboxylée en éthanolamine, suivi d’une formation de phosphoryléthanolamine. Les données génomiques ont montré qu’une activité phosphoryléthanolamine méthylase, jusque-là uniquement décrite chez les plantes, pouvait prendre le relais conduisant à de la phosphorylcholine, et ensuite à la phosphatidylcholine. Ces voies de synthèse n’apparaissent pas pouvoir se compenser et paraissent donc non redondantes [5].
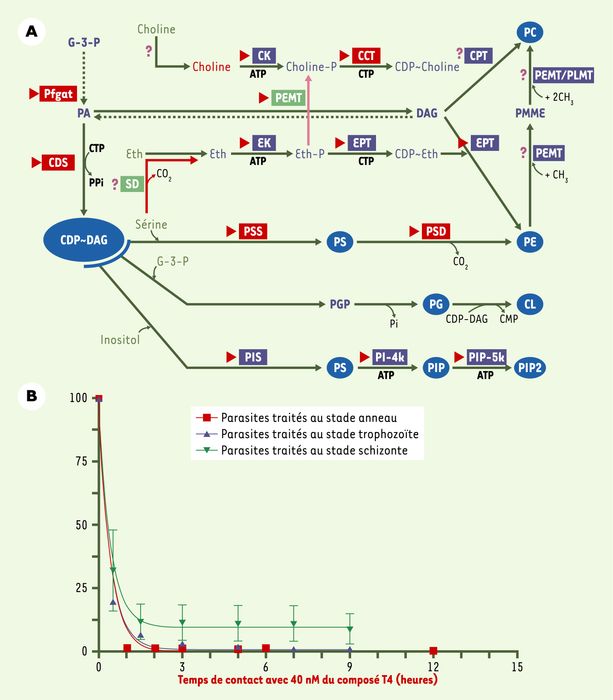
Figure 2
Cible(s) et activité des nouveaux composés antipaludiques.
A. Métabolisme des phospholipides de Plasmodium. Ce métabolisme est unique par l’association de voies métaboliques de type procaryotes (voies CDP-DAG dépendantes), eucaryotes et végétales. Le phospholipide majoritaire est la phosphatidylcholine (PC) qui est synthétisée par trois voies métaboliques non redondantes. La voie de synthèse de novo dite « voie de Kennedy » permet la synthèse de PC à partir de choline plasmatique et met en jeu trois enzymes : la choline kinase (CK), la CTP phosphocholine cytidylyl transférase (CCT) et la choline phosphotransférase (CPT). La phosphatidylcholine peut également être obtenue à partir de sérine ou d’éthanolamine. Les produits des gènes caractérisés biochimiquement sont surlignés en bleu. Les petites flèches rouges indiquent les gènes identifiés dans le génome de P. falciparum. Les gènes clonés et caractérisés (souvent par nos laboratoires) sont surlignés en rouge et les gènes à caractéristiques végétales en vert. Les points d’interrogation correspondent à des activités biochimiques dont les gènes correspondants n’ont pas encore été identifiés. CL : cardiolipide ; PE : phosphatidyléthanolamine ; PG : phosphatidylglycérol ; PI : phosphatidyl inositol ; PS : phosphatidylsérine (d’après [5]). B. Effet cytotoxique des composés. Les composés sont caractérisés par une activité cytotoxique puissante (qui se passe à faible concentration, < 10 nM), rapide (un temps de contact de 2 h avec le parasite suffit) et non réversible. Ici, le composé T4 est mis en contact avec des cultures synchrones de P. falciparum pendant des temps variables de 0 à 12 heures, à chacun de ses trois stades. La viabilité des parasites est déterminée au cycle suivant [11]. Un contact des parasites avec la drogue d’une heure seulement (stades anneau et trophozoïte), ou 2 h (stade schizonte) suffit à inhiber la croissance des parasites de 85-99 %. Cet effet cytotoxique est donc rapide, se produit quel que soit le stade de développement du parasite et paraît irréversible. Il est probablement dû à l’accumulation spécifique des composés dans les érythrocytes infectés (effet « cheval de Troie »).
Notre équipe a élaboré une stratégie utilisant des analogues de choline potentiellement capables de bloquer l’import de choline et/ou d’altérer une ou plusieurs des enzymes de synthèse de phosphatidylcholine [5, 6]. Ces analogues ont été optimisés pour leur activité antipaludique. Une première génération de bis-ammonium quaternaire, dont G25 est le composé leader, a montré une très puissante activité antipaludique à la fois in vitro et in vivo [7-10]. Cependant, la structure chargée de ces molécules ne leur permet pas un bon passage de la barrière gastro-intestinale, empêchant ainsi une administration par voie orale. Nous avons donc développé des pro-drogues neutres susceptibles de se convertir en composés bis-thiazolium ayant une activité antipaludique in vitro à moins de 10 nM. Ces composés sont actifs in vivo chez la souris à de très faibles doses par voie parentérale ou orale, et cela à faible ou haute parasitémie, et sont très faiblement toxiques (1 000 fois moins toxique sur les cellules de mammifères que sur Plasmodium). L’administration orale de la prodrogue TE3 (3 mg/kg/jour pendant 4 jours) permet une cure complète et sans recrudescence d’une infection par P. cynomolgi chez le singe Rhésus [11]. Nous montrons aussi que les bis-thiazolium inhibent spécifiquement la biosynthèse de phosphatidylcholine, sans toucher la synthèse d’ADN ou des autres phospholipides [11]. De plus, ils s’accumulent plus de 200 fois spécifiquement dans l’érythrocyte infecté. Ce ciblage spécifique de nos produits vers les cellules cibles est le rêve de tout pharmacologue et permet de travailler à faible dose et ainsi d’éviter les effets cholinergiques de ces produits. Enfin, nous avons récemment montré qu’une partie des composés était accumulée dans la vacuole digestive du parasite intracellulaire où ils peuvent interagir avec l’hème (métabolite de l’hémoglobine, toxique pour le parasite), interaction qui paraît contribuer à l’activité antiplasmodiale [12]. La puissance des composés s’exprime par une activité cytotoxique non réversible après un faible temps de contact (Figure 2B). Les bis-thiazolium sont donc des antipaludiques uniques par leur accumulation spécifique dans les érythrocytes infectés, leur double mécanisme d’action et leur faible toxicité. Le métabolisme de la phosphatidylcholine n’est la cible d’aucun antipaludique actuel, et apparaît comme une alternative réaliste aux antipaludiques pour lesquels une chimiorésistance existe.
Une collaboration avec Sanofi-Aventis est en cours afin d’identifier les molécules candidates pour un développement clinique.
Appendices
Remerciements
Ces travaux ont bénéficié du support de l’Europe (contrat QLK2-CT-2000-01166), du Ministère de l’Éducation et de la Recherche (Pal+) et de l’Organisation Mondiale de la Santé.
Références
- 1. Hartl DL. The origin of malaria : mixed messages from genetic diversity. Nat Rev Microbiol 2004 ; 2 :15-22.
- 2. http://www.who.int/tdr/diseases/malaria/default.htm
- 3. Biagini GA, O’Neill PM, Nzila A, et al. Antimalarial chemotherapy : young guns or back to the future ? Trends Parasitol 2003 ; 19 : 479-87.
- 4. Kremsner PG, Krishna S. Antimalarial combinations. Lancet 2004 ; 364 :285-94.
- 5. Vial HJ, Ben Mamoun C. Plasmodium lipids : metabolism and function. In : Sherman IW, ed. Molecular approach to malaria. Washington DC : ASM Press, 2005 (sous presse).
- 6. Roggero R, Zufferey R, Minca M, et al. Unraveling the mode of action of the antimalarial choline analog G25 in Plasmodium falciparum and Saccharomyces cerevisiae. Antimicrob Agents Chemother 2004 ; 48 : 2816-24.
- 7. Calas M, Ancelin ML, Cordina G, et al. Antimalarial activity of compounds interfering with Plasmodium falciparum phospholipid metabolism : comparison between mono- and bisquaternary ammonium salts. J Med Chem 2000 ; 43 : 505-16.
- 8. Wengelnik K, Vidal V, Ancelin ML, et al. A class of potent antimalarials and their specific accumulation in infected erythrocytes. Science 2002 ; 295 : 1311-4.
- 9. Ancelin ML, Calas M, Vidal-Sailhan V, et al. Potent inhibitors of Plasmodium phospholipid metabolism with a broad spectrum of in vitro antimalarial activities. Antimicrob Agents Chemother 2003 ; 47 : 2590-7.
- 10. Ancelin ML, Calas M, Bonhoure A, et al. In vivo activities of mono and bis quarternary ammonium salts interfering with Plasmodium phospholipids metabolism. Antimicrob Agents Chemother 2003 ; 47 : 2598-605.
- 11. Vial HJ, Wein S, Farenc C, et al. Prodrugs of bisthiazolium salts are orally potent antimalarials. Proc Natl Acad Sci USA 2004 ; 101 : 15458-63.
- 12. Biagini GA, Richier E, Bray P, et al.Heme binding contributes to the antimalarial activity of bis-quaternary ammonium compound. Antimicrob Agents Chemother 2003 ; 47 : 2584-9.
- 13. Van Dooren GG, Walker RF, Roos DS, Mc Fadden GI. Traffic jams : protein transport in Plasmodium falciparum. Parasitol Today 2000 ; 16 : 421-7.
List of figures
Figure 1
Cycle biologique et structure de Plasmodium chez l’homme.
A. Lors de son repas sanguin, le moustique du genre Anopheles injecte le parasite sous forme sporozoïte. Les parasites se multiplient dans les hépatocytes pendant une dizaine de jours puis sont libérés dans le sang sous forme de mérozoïtes qui envahissent les globules rouges. Cette prolifération intra-érythrocytaire qui passe par trois stades successifs (anneau, trophozoïte et schizonte) conduit à une destruction massive des hématies et constitue la phase symptomatique de la maladie. Au cours de cette phase, certains parasites se différencient en gamétocytes mâles ou femelles, qui seront ingérés par un moustique lors d’un repas sanguin sur un sujet impaludé. Après une multiplication sexuée et une migration vers les glandes salivaires, le moustique est prêt à infecter un nouvel hôte. B.Plasmodium, bien que possédant sa propre membrane plasmique (PPM), se développe à l’intérieur d’une vacuole parasitophore (PV) dont la membrane (PVM) le sépare du cytoplasme érythrocytaire. Il possède les organites habituels d’un eucaryote (noyau, réticulum endoplasmique [RE] et appareil de Golgi rudimentaires, une mitochondrie [Mit]) ainsi que des organites spécifiques. Le complexe apical composé des micronèmes (Mic), des rhoptries (R) et des granules denses (DG) sert à l’invasion de la cellule hôte. La vacuole digestive (FV) permet au parasite de dégrader l’hémoglobine en hème. L’apicoplaste (A) est le vestige d’un plaste qui résulte d’une endosymbiose avec une algue rouge. Au cours de son développement, le parasite met en place dans le cytoplasme de l’érythrocyte un réseau membranaire (TVN : réseau tubulovésiculaire, MC : corpuscules de Maurer) impliqué dans le trafic moléculaire entre le parasite et la membrane de l’érythrocyte (EPM) (d’après [13]).
Figure 2
Cible(s) et activité des nouveaux composés antipaludiques.
A. Métabolisme des phospholipides de Plasmodium. Ce métabolisme est unique par l’association de voies métaboliques de type procaryotes (voies CDP-DAG dépendantes), eucaryotes et végétales. Le phospholipide majoritaire est la phosphatidylcholine (PC) qui est synthétisée par trois voies métaboliques non redondantes. La voie de synthèse de novo dite « voie de Kennedy » permet la synthèse de PC à partir de choline plasmatique et met en jeu trois enzymes : la choline kinase (CK), la CTP phosphocholine cytidylyl transférase (CCT) et la choline phosphotransférase (CPT). La phosphatidylcholine peut également être obtenue à partir de sérine ou d’éthanolamine. Les produits des gènes caractérisés biochimiquement sont surlignés en bleu. Les petites flèches rouges indiquent les gènes identifiés dans le génome de P. falciparum. Les gènes clonés et caractérisés (souvent par nos laboratoires) sont surlignés en rouge et les gènes à caractéristiques végétales en vert. Les points d’interrogation correspondent à des activités biochimiques dont les gènes correspondants n’ont pas encore été identifiés. CL : cardiolipide ; PE : phosphatidyléthanolamine ; PG : phosphatidylglycérol ; PI : phosphatidyl inositol ; PS : phosphatidylsérine (d’après [5]). B. Effet cytotoxique des composés. Les composés sont caractérisés par une activité cytotoxique puissante (qui se passe à faible concentration, < 10 nM), rapide (un temps de contact de 2 h avec le parasite suffit) et non réversible. Ici, le composé T4 est mis en contact avec des cultures synchrones de P. falciparum pendant des temps variables de 0 à 12 heures, à chacun de ses trois stades. La viabilité des parasites est déterminée au cycle suivant [11]. Un contact des parasites avec la drogue d’une heure seulement (stades anneau et trophozoïte), ou 2 h (stade schizonte) suffit à inhiber la croissance des parasites de 85-99 %. Cet effet cytotoxique est donc rapide, se produit quel que soit le stade de développement du parasite et paraît irréversible. Il est probablement dû à l’accumulation spécifique des composés dans les érythrocytes infectés (effet « cheval de Troie »).