Article body
Le métabolisme du fer doit être finement régulé par l’organisme car une quantité insuffisante de ce métal entraîne une anémie. À l’inverse, lorsque le fer s’accumule dans les organes, il s’avère néfaste car il conduit à la formation de radicaux libres. C’est ce qui se passe chez les patients atteints d’hémochromatose, maladie génétique extrêmement fréquente.
L’hémochromatose, conséquence de la surcharge en fer
On estime à ce jour que 180 000 français ont trop de fer dans le sang. La forme la plus courante de la maladie est de transmission autosomique récessive et se caractérise par une surcharge en fer progressive dans tout l’organisme, en particulier le foie. Les premiers hépatocytes à se surcharger en fer sont les hépatocytes situés autour des espaces portes. En effet, le fer qui s’accumule provient, d’une part, de l’absorption excessive du fer alimentaire par les entérocytes duodénaux et, d’autre part, du relargage accru du fer des macrophages essentiellement spléniques. Les signes précurseurs d’une accumulation de fer sont l’augmentation de la saturation de la transferrine et l’augmentation de la ferritine sérique. Les symptômes de la maladie sont peu spécifiques, ce qui en fait une maladie difficile à diagnostiquer en absence de mesure des marqueurs biochimiques sériques.
L’accumulation du fer dans les organes est délétère et entraîne leur dysfonctionnement. Les premiers symptômes de l’hémochromatose sont le plus souvent la fatigue et les douleurs articulaires. Par la suite, la surcharge en fer s’aggravant, la maladie peut évoluer avec des complications variées comprenant cirrhose, hépatocarcinome, diabète, cardiomyopathie, arthrite, dérèglements endocriniens, etc. Pour éliminer la surcharge en fer, la mesure essentielle du traitement est la saignée.
C’est en 1996 que le gène responsable de cette maladie a pu être identifié, il s’agit du gène HFE. Près de 80% des patients atteints d’hémochromatose sont porteurs de la mutation C282Y du gène HFE à l’état homozygote. Le modèle murin d’invalidation du gène Hfe reproduit les anomalies du métabolisme du fer, avec une surcharge en fer viscérale associée à une diminution de la quantité de fer des macrophages (macrophages qui sont normalement responsables du recyclage du fer des globules rouges sénescents par érythrophagocytose) (Figure 2A) (pour revue, voir [1]).
Le déficit en hepcidine à l’origine de l’hémochromatose
L’hepcidine est un petit peptide de 25 acides aminés synthétisé par le foie, déversé dans la circulation sanguine et excrété par le rein. Son rôle dans le métabolisme du fer a récemment été mis en évidence (pour revue, voir [2]). Ce peptide hormonal agit en diminuant l’absorption intestinale du fer et le relargage du fer par les macrophages. L’hémochromatose, nous l’avons vu, est, dans la grande majorité des cas, due à une mutation dans le gène HFE. On le sait aujourd’hui, la maladie est hétérogène et la mutation d’autres gènes (comme le récepteur de la transferrine 2, l’hémojuvéline, et le gène de l’hepcidine lui-même) est responsable d’hémochromatoses. Un pas considérable dans la compréhension des mécanismes physiopathologiques de l’hémochromatose a été établi lorsque, récemment, plusieurs groupes ont montré que l’hepcidine était présente en quantité insuffisante dans l’hémochromatose et que la quantité résiduelle d’hepcidine était directement reliée à la précocité et à la gravité de la maladie. Ces résultats suggérant que l’insuffisance en hepcidine pouvait être la cause même de la maladie, nous avons cherché à déterminer l’effet d’hepcidine substitutive dans un modèle murin d’hémochromatose (les souris Hfe-/-). En croisant les souris malades Hfe-/- avec des souris transgéniques exprimant de façon constitutive et précoce l’hepcidine, nous avons effectivement pu montrer que l’hepcidine, quand elle est présente dès la naissance, peut empêcher l’apparition de la surcharge en fer qui s’opère normalement chez les souris Hfe-/- [3].
Les enseignements du modèle murin
Compte tenu de l’apparition progressive des symptômes de l’hémochromatose, le diagnostic n’est souvent possible qu’une fois la surcharge en fer déjà installée. C’est pourquoi, il nous a semblé important de tester les effets de l’hepcidine mais cette fois chez des souris Hfe-/- présentant déjà une surcharge en fer. Pour cela, nous avons développé un modèle murin surexprimant l’hepcidine de manière inductible (système Tet ON[1]). Ce modèle murin a été validé en montrant que les souris surexprimant de façon inductible l’hepcidine (appelées « souris inductibles ») présentent, après induction du transgène, une diminution du fer sérique à court terme et, à long terme, une anémie hypochrome microcytaire [4]).
Nous avons alors croisé ces souris inductibles avec des souris Hfe-/- et attendu que les souris issues de ces croisements (appelées ind/Hfe-/-) atteignent l’âge de deux mois avant d’induire l’expression de l’hepcidine transgénique par traitement des souris avec l’inducteur doxycycline. Après trois semaines de traitement, nous montrons que la présence d’hepcidine transgénique entraîne la rétention du fer dans les macrophages du foie (Figure 1D versus 1A) et de la rate (Figure 1EversusB) ainsi que dans les entérocytes (Figure 1F versus 1C) [4].
Figure 1
Détection du fer dans le foie, la rate et le duodénum de souris inductibles hepcidine croisées avec des souris Hfe-/- et traitées pendant trois semaines à la doxycycline.
Coloration du fer au Perls (A, B, D et E, le fer est coloré en bleu) ou Perls DAB (C et F, le fer est coloré en marron) sur des coupes de foie (A et D), de rate (B et E) et de duodénum (C et F) de souris Hfe-/-(A-C) et de souris inductibles hepcidine Hfe-/- (ind/Hfe-/-, D-F). La quantité totale de fer hépatique est indiquée pour chaque animal. Les flèches indiquent les macrophages du foie.
La ferroportine, seul exporteur cellulaire de fer connu à ce jour, est une cible importante de l’hepcidine. E. Nemeth et ses collaborateurs ont en effet montré que l’hepcidine était capable de se lier à la ferroportine et de conduire à l’internalisation puis à la dégradation de ce transporteur de fer [5]. Dans notre modèle murin, nous montrons pour la première fois in vivo, qu’après induction de l’hepcidine, la quantité de ferroportine à la surface des macrophages et des entérocytes est diminuée, expliquant très probablement la rétention du fer dans ces cellules. Enfin, nous observons que, sans modifier la quantité totale de fer présente dans le foie, la présence d’hepcidine transgénique semble toutefois entraîner un changement de distribution du fer. Dans le foie des souris malades Hfe-/-, le fer s’accumule dans les hépatocytes alors que dans le foie des souris ind/Hfe-/-, le fer des hépatocytes est diminué et le métal s’accumule préférentiellement dans les macrophages (Figure 1D versus 1A). La toxicité hépatique du fer étant liée à sa surabondance dans les hépatocytes, ce résultat confirme et élargit l’intérêt thérapeutique de l’hepcidine (ou des inducteurs de l’hepcidine) dans le traitement des surcharges en fer, en particulier des hémochromatoses communes. En effet, un tel traitement serait susceptible non seulement de corriger l’hyperabsorption intestinale du fer, cause de la maladie, mais aussi d’induire une redistribution du fer déjà accumulé, et donc d’en réduire la toxicité (Figure 2B).
Figure 2
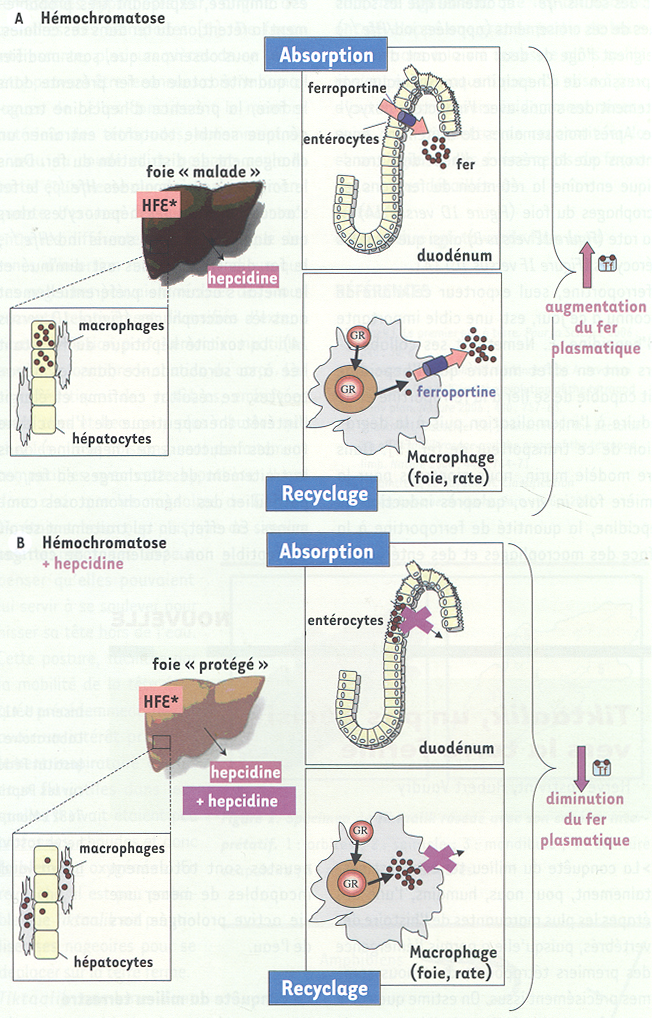
Modèle de la pathogénie de l’hémochromatose (A) et de l’action de l’hepcidine exogène sur la surcharge en fer (B).
Le fer est absorbé au niveau du duodénum par les cellules entérocytaires. Le fer absorbé se retrouve dans la circulation sanguine tranporté par la transferrine (Tf). Le fer est utilisé principalement pour la formation des globules rouges (GR). Les GR en fin de vie sont phagocytés par les macrophages qui recyclent ainsi le fer qu’ils contiennent. Le foie, avec les macrophages, est un lieu de stockage du fer. A. Dans le cas d’une hémochromatose (foie malade), la mutation du gène HFE (HFE*) conduit à une production insuffisante d’hepcidine par le foie. Il en résulte une augmentation de l’absorption du fer par les entérocytes et une augmentation du relargage du fer par les macrophages via la ferroportine. Cela entraîne une augmentation du fer circulant qui va s’accumuler en premier lieu dans les hépatocytes, entraînant fibrose, cirrhose et, en absence de traitement, peut conduire à un hépatocarcinome. B. L’apport d’hepcidine exogène, dans notre modèle par induction d’un transgène, entraîne une diminution de l’export du fer des entérocytes et des macrophages via une diminution de la ferroportine. Le fer étant retenu dans ces cellules, le fer circulant est diminué et l’accumulation dans les hépatocytes est moindre (foie protégé).
Appendices
Note
-
[1]
Système dérivé de l’opéron tétracycline qui repose sur l’utilisation de deux transgènes. L’induction du transgène hepcidine (transgène effecteur) est obtenue par traitement des souris à la doxycycline (un dérivé de la tétracycline) qui se lie alors à un transactivateur (facteur de transcription rtTA produit par le transgène activateur) reconnaissant spécifiquement les séquences promotrices placées en amont de la séquence hepcidine.
Références
- 1. Camaschella C. Understanding iron homeostasis through genetic analysis of hemochromatosis and related disorders. Blood 2005 ; 106 : 3710-7.
- 2. Ganz T. Hepcidin: a regulator of intestinal iron absorption and iron recycling by macrophages. Best Pract Res Clin Haematol 2005 ; 18 : 171-82.
- 3. Nicolas G, Viatte L, Lou DQ, et al. Constitutive hepcidin expression prevents iron overload in a mouse model of hemochromatosis. Nat Genet 2003 ; 34 : 97-101.
- 4. Viatte L, Nicolas G, Lou DQ, et al. Chronic hepcidin induction causes hyposideremia and alters the pattern of cellular iron accumulation in hemochromatotic mice. Blood 2006 ; 107 : 2952-8.
- 5. Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science 2004 ; 306 : 2090-3.
List of figures
Figure 1
Détection du fer dans le foie, la rate et le duodénum de souris inductibles hepcidine croisées avec des souris Hfe-/- et traitées pendant trois semaines à la doxycycline.
Coloration du fer au Perls (A, B, D et E, le fer est coloré en bleu) ou Perls DAB (C et F, le fer est coloré en marron) sur des coupes de foie (A et D), de rate (B et E) et de duodénum (C et F) de souris Hfe-/-(A-C) et de souris inductibles hepcidine Hfe-/- (ind/Hfe-/-, D-F). La quantité totale de fer hépatique est indiquée pour chaque animal. Les flèches indiquent les macrophages du foie.
Figure 2
Modèle de la pathogénie de l’hémochromatose (A) et de l’action de l’hepcidine exogène sur la surcharge en fer (B).
Le fer est absorbé au niveau du duodénum par les cellules entérocytaires. Le fer absorbé se retrouve dans la circulation sanguine tranporté par la transferrine (Tf). Le fer est utilisé principalement pour la formation des globules rouges (GR). Les GR en fin de vie sont phagocytés par les macrophages qui recyclent ainsi le fer qu’ils contiennent. Le foie, avec les macrophages, est un lieu de stockage du fer. A. Dans le cas d’une hémochromatose (foie malade), la mutation du gène HFE (HFE*) conduit à une production insuffisante d’hepcidine par le foie. Il en résulte une augmentation de l’absorption du fer par les entérocytes et une augmentation du relargage du fer par les macrophages via la ferroportine. Cela entraîne une augmentation du fer circulant qui va s’accumuler en premier lieu dans les hépatocytes, entraînant fibrose, cirrhose et, en absence de traitement, peut conduire à un hépatocarcinome. B. L’apport d’hepcidine exogène, dans notre modèle par induction d’un transgène, entraîne une diminution de l’export du fer des entérocytes et des macrophages via une diminution de la ferroportine. Le fer étant retenu dans ces cellules, le fer circulant est diminué et l’accumulation dans les hépatocytes est moindre (foie protégé).