Abstracts
Résumé
L’élimination d’une solution aqueuse de Noir Eriochrome T (NET), composé organique largement utilisé en industrie textile, a été effectuée par plasma glidarc. Ce procédé d’oxydation avancée (POA) met en jeu les espèces gazeuses actives créées dans la décharge, principalement les radicaux OH°, son dimère H2O2 et le peroxynitrite ONOO- (dérivé de l’oxyde nitrique). Ces espèces induisent des propriétés fortement oxydantes qui sont largement employées pour la destruction de déchets organiques. Outre les espèces oxydantes, certains composés issus du radical NO°(HONO et ONOOH) et présents en solution confèrent également au plasma des propriétés acidifiantes qui accélèrent ainsi les réactions d’oxydation. L’étude spectrophotométrique d’une solution de NET (15 µM) exposée à la décharge électrique a permis de révéler qu’aux premiers instants du traitement (t < 3 min), il se forme un composé intermédiaire qui absorbe à λ = 752 nm; la cinétique de décoloration observée présente une loi de variation d’ordre global égal à un avec une constante de vitesse k = 2,11 min‑1. Après 45 min de traitement, un taux de décoloration de 85,1 % est obtenu. Au bout du même temps, le composé présent initialement en solution à 15 µM se minéralise à 57,3 % avec une constante de vitesse k1 = 0,0188 min‑1. L’obtention d’un abattement de 67 % de la demande chimique en oxygène (DCO) avec une constante de vitesse k2 = 0,0253 min‑1 permet de confirmer que le composé se dégrade bien sous l’effet de la décharge. Par ailleurs, bien que la cinétique de disparition d’une solution plus concentrée (150 µM) soit plus lente (k3 = 0,0178 min‑1), le composé se décolore à 82,0 % et un taux de dégradation de 86,6 % est obtenu après une durée d’exposition de 50 min. Les analyses qualitatives effectuées juste après arrêt de la décharge ont également révélé la présence en solution des ions minéraux issus de la dégradation de la molécule.
Mots clés:
- plasma glidarc,
- Noir Eriochrome T,
- décoloration,
- dégradation,
- minéralisation,
- abattement
Abstract
The elimination of an aqueous solution of Eriochrome Black T, an organic compound widely used in the textile industry, was carried out using a gliding arc plasma. This advanced oxidation process (AOP) involves the active gaseous species created in the discharge, mainly OH° radicals, its dimer H2O2, and peroxynitrite ONOO- (a nitric oxide derivative). These species induce highly oxidizing properties which are widely used for the destruction of organic wastes. In addition to the oxidizing species, some derivatives of the NO radical (HONO and ONOOH) present in solution also confer on the plasma some acidifying properties, which accelerate the oxidation reactions. The spectrophotometric study of an Eriochrome Black T solution exposed to an electric discharge showed that an intermediate compound which absorbs at 750 nm forms at the beginning of the treatment (t < 3 min) with a relevant pseudo first order kinetic rate constant k = 2.11 min‑1. After 45 min of treatment, a decolouration rate of 85.1% was obtained and the compound initially present in solution at a concentration of 15 μM was mineralized (57.3%) with a rate constant k1 = 0.0188 min‑1. The observation of a concurrent 67% decrease in chemical oxygen demand with a rate constant k2 = 0.0253 min‑1 confirms the degradation of the compound as a result of the discharge. Although the kinetics of disappearance of a more concentrated solution (150 µM) are slow (k3 = 0,0178 min‑1), the compound faded at 82.0% and a degradation of 86.6% was obtained for an exposure time of 50 min. Qualitative analysis performed immediately after the discharge also revealed the presence in solution of mineral ions derived from the degradation of the parent molecule.
Key words:
- gliding arc plasma,
- Eriochrome Black T,
- decolouration,
- degradation,
- mineralization,
- abatement
Article body
1. Introduction
La dépollution des eaux usées et l’assainissement des réserves d’eau potable sont aujourd’hui une préoccupation majeure. Les procédés classiques de traitement des effluents et des polluants qu’ils contiennent s’avèrent pour la plupart inefficaces et très couteux au regard de la complexité et de la grande quantité de rejets d’après (HONG et al., 2007). La nécessité de trouver des technologies nouvelles, efficaces et économes d’énergie devient impérative. Parmi celles-ci, les technologies basées sur des décharges électriques et classées parmi les procédés d’oxydation avancée (POA) ont fait leurs preuves au laboratoire pour l’élimination de composés organiques usuels habituellement récalcitrants. L’une d’elles, la décharge glissante ou « glidarc » peut être bien adaptée à l’environnement industriel avec des coûts de fonctionnement et d’investissement modestes pour une efficacité notable (BRISSET, 2009). Le dispositif de génération de plasma type arc rampant ou glidarc a été mis au point par CZERNICHOWSKI (1994) pour le traitement des gaz. Plus tard, il fut reconnu comme source convenable pour la production de plasmas non thermiques par plusieurs laboratoires. La décharge glidarc génère un plasma non thermique dont les propriétés sont utilisées pour la dégradation des polluants. En rappel, le plasma est un milieu gazeux électriquement neutre comportant des espèces « légères » (i.e., photons et électrons) et des espèces « lourdes » (molécules, radicaux, atomes). Cet apport énergétique provient du champ électrique et bénéficie au gaz baignant les électrodes. Il joue sur la répartition électronique des couches externes des entités gazeuses, et la modification résultante confère à l’entité des propriétés chimiques nouvelles (BRISSET, 2009). Les propriétés des entités lourdes créées dans le plasma dépendent de la nature du gaz plasmagène. Avec l’air humide, le glidarc génère les radicaux OH et NO comme espèces réactives principales qui ont été identifiées et quantifiées dans les études récentes (BENSTAALI et al., 2002; DELAIR, 2004; KOSSITSYN et al., 2003). Ces entités sont responsables des propriétés fortement oxydantes (E°OH/H2O = 2,85 V/ENH) et acidifiantes. D’après BENSTAALI et al. (1998, 2002) repris par BURLICA et al. (2006), ces radicaux génèrent en solution d’autres espèces oxydantes à durée de vie longue telles que le H2O2 et l’ion peroxonitrite. Dans le cas de l’élimination en solution de la molécule, c’est l’effet oxydant qui sera privilégié. Il se trouve juste renforcé par l’effet acidifiant, puisque la grande majorité des systèmes oxydoréducteurs organiques impliquent la présence des protons.
2. Matériel et méthodes
2.1 Dispositif expérimental
La figure 1 réprésente un schéma du dispositif glidarc utilisé. Le plasma est généré entre deux conducteurs métalliques divergents reliés à un transformateur à fuite Aupem-Sefli (50 Hz, 9 Kv-100 mA à vide, intensité moyenne en fonctionnement 160 mA). Lorsque les électrodes sont soumises à une différence de potentiel convenable, un arc électrique se forme au minimun d’écartement, il est poussé par le flux gazeux et glisse le long des électrodes jusqu’à extinction lorsqu’il est court-circuité par un nouvel arc (DOUBLA et al., 2007). Il se crée donc un panache d’arc formant le plasma. Le gaz plasmagène utilisé dans l’étude est l’air humide saturé en eau par l’intermédiaire d’un saturateur (débit : 13,33 L.min‑1). La distance électrode-cible D est égale à 2,5 cm. La solution traitée est agitée à l’aide d’un agitateur magnétique pour assurer l’homogénéité de la cible. La réaction entre les espèces issues de la décharge et la cible ayant lieu à l’interface liquide/gaz, une agitation efficace rend difficile l’accumulation des produits de réaction à la surface du liquide et permet d’accroître ainsi la vitesse de réaction.
Figure 1
Schéma du dispositif expérimental du réacteur glidarc utilisé.
Sketch of the experimental gliding arc reactor used.
Par ailleurs, le fonctionnement à pression atmosphérique de la décharge n’induit qu’un accroissement limité de la température macroscopique de la cible. Le réacteur en pyrex utilisé est à double paroi et est équipé d’un système de refroidissement par une simple circulation d’eau, ce qui permet de limiter les échauffements au cours de l’exposition de la cible tout en maintenant la température du milieu réactionnel à une valeur ne pouvant excéder une trentaine de degré.
2.2 Nature du polluant
Dans cette étude la molécule cible utilisée est un colorant azoïque sulfonique appartenant à la classe des colorants acides anioniques, correspondant à la formule brute C20H12N3NaO7S dont la structure est représentée à la figure 2. Il est très utilisé dans les industries textiles à cause de sa forme tinctoriale. Les solutions exposées au plasma d’arc électrique glissant sont des solutions aqueuses de NET préparées à partir de produits commerciaux. Pour effectuer le traitement, une solution de volume 430 mL est exposée à la décharge.
Figure 2
Structure du Noir Eriochrome T, sel sodique.
Structure of Eriochrome Black-T, sodium salt.
2.3 Méthodes d’analyses
La dégradation du Noir Eriochrome T a été suivie par la mesure du carbone organique total (COT) au moyen d’un COT-mètre Shimadzu TOC-VE après calibration. De plus, la mesure de la demande chimique en oxygène (DCO) est effectuée par lecture directe de l’échantillon préalabrement préparée par une solution digestive de DCO sur un spectrophotomètre à affichage numérique HACH 3900. Les mesures spectrophotométriques d’absorption UV-visible ont également été réalisées au pic d’absorption du composé (λ = 525 nm). Quant aux analyses qualitatives, elles ont été effectuées par les différentes méthodes classiques d’identification des ions en solution et de piégeage du dioxyde de carbone.
3. Résultats et discussion
3.1 Mesures spectrophotométriques
L’exposition à la décharge d’une solution de concentration 1,5.10‑5 mol.L‑1 pour des durées t* courtes (t* < 5 min) montre immédiatement qu’après arrêt de la décharge, l’absorbance mesurée au pic d’absorption du composé (525 nm) diminue, ce qui est bien traduit par la figure 3.
Figure 3
Spectre UV- visible d’une solution de NET traitée par plasma : 1 : 0 min, 2 : 0,5 min, 3 : 1 min, 4 : 1,5 min, 5 : 2 min, 6 : 3 min, 7 : 5 min, 8 : 9 min, 9 : 12 min, 10 : 15 min, 11 : 30 min, 12 : 45 min.
UV-visible spectrum of a NET solution treated by plasma 1: 0 min, 2: 0.5 min, 3: 1 min, 4: 1.5 min, 5: 2 min, 6: 3 min, 7: 5 min, 8: 9 min, 9: 12 min, 10: 15 min, 11: 30 min, 12: 45 min.
Le spectre UV-visible obtenu pour les différentes durées de traitement montre qu’à partir de 0,5 min, le pic principal à 525 nm décroît. L’évolution du spectre après 2 min d’exposition à la décharge fait ressortir de manière plus précise l’existence d’un pic à 752 nm, caractéristique de la formation d’un composé intermédiaire qui proviendrait de la rupture de la liaison azoïque (-N = N-), car cette liaison est souvent présentée comme le site le plus actif lors des attaques oxydatives (BENSTAALI et al., 1998; BENHNAJADY et al., 2006). Cet intermédiaire, sous l’effet de la décharge, disparaît très vite après 3 min de traitement (3-45 min); on assiste à une très forte décroissance du pic principal qui tend à disparaître complètement. Ce résultat montre que le Noir Eriochrome T se dégrade effectivement sous l’effet de la décharge.
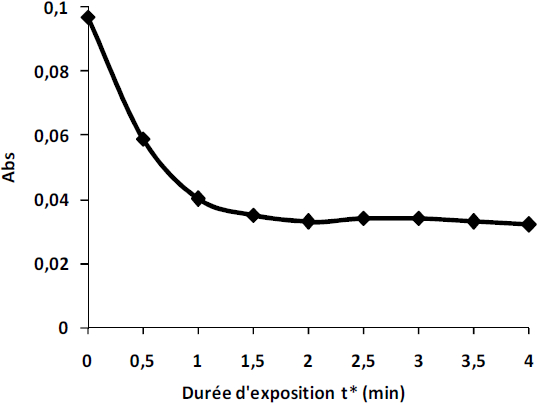
L’évolution de l’absorbance à λ = 525 nm obtenue sur la courbe de la figure 4 fait apparaître un profil présentant une partie monotone décroissante entre 0 et 1 min correspondant à une forte baisse de l’absorbance, une partie concave transitoire et une partie horizontale qui se présentent sous forme de plateau et qui traduiraient la consommation totale des espèces oxydantes créées ou activées par le plasma (BENSTAALI et al., 1998; MOUSSA et al., 2007). Cette diminution de l’absorbance montre également que les chromophores responsables de la coloration sont détruits progressivement. Un taux de décoloration de 67 % est obtenu au bout de 4 min de traitement. Ce taux de décoloration a été enregistré pour une densité d’énergie estimée à 56 kJ.L‑1. Il en résulte ainsi un pouvoir dégradant de l’ordre de 29 g.kWh‑1.
Figure 4
Évolution de l’absorbance en fonction de la durée d’exposition.
Evolution of absorbance as a function of exposure time.
Pour préciser le rôle de la quantité d’énergie sur la cinétique de la réaction, nous avons tracé les variations de la fonction Ln (A-Ainf) aux premiers instants d’exposition (0 < t* < 2 min) en décharge continue (Figure 5). La courbe obtenue présente une loi de variation d’ordre global égal à 1, avec une constante de vitesse k = 2,11 ± 0,03.min‑1, cette constante vient davantage montrer que les cinétiques de réaction de décoloration par plasma de colorants azoïques sont très rapides pour les solutions diluées (GUIVARCH et al., 2003; MOUSSA et al., 2007).
Figure 5
Expression logarithmique de l’absorbance en fonction de la durée d’exposition (0 < t* < 2 min).
Logarithmic expression of the absorbance as a function of exposure time (0 < t* < 2 min).
Par ailleurs, une solution de NET, présente initialement à 1,5.10‑4 mol.L‑1, soit 150 µM, se dégrade à 86,6 % au bout de 50 min de traitement (Figure 6). La décroissance dans le temps de la concentration présente une allure exponentielle et donc des variations linéaires de Ln C/C0 = f(t*), ce qui indique que la transformation suit une cinétique d’ordre apparent 1 (C = C0e-kt).
Figure 6
Cinétique de dégradation du Noir Eriochrome T en solution aqueuse (C = 150 µM).
Degradation kinetics of an aqueous solution of Eriochrome Black T (C = 150 µM).
On va par la suite considérer au cours de cette partie la cinétique d’hydroxylation du Noir Eriochrome T contribuant à la dégradation du colorant. La réaction entre les radicaux hydroxyles et le NET est présentée ci-dessous.
Ainsi, la vitesse de disparition du colorant aura la forme suivante :
Si α = 1 (premier ordre) alors
Par conséquent, pour vérifier l’ordre de notre réaction, on va tracer la courbe illustrant le ![]() pour les différents temps de traitement réalisés selon la figure 7.
pour les différents temps de traitement réalisés selon la figure 7.
Figure 7
Variation de Ln C/C0 en fonction de la durée de traitement.
Variation of ln (C/C0) as a function of treatment time.
On constate que le coefficient de corrélation de la courbe est proche de l’unité et comme les radicaux OH° sont non cumulatifs car leur durée de vie est très courte (quelques centaines de ns), il en résulte que la concentration en radicaux hydroxyles dans la solution est maintenue quasi stationnaire (vitesse de consommation = vitesse de formation) et, par conséquent, la réaction d’hydroxylation du NET est considérée comme une cinétique de pseudo-premier ordre (ABDELMALEK et al., 2006). On en déduit, selon les molécules considérées, puisqu'il s'agit d'un phénomène de diffusion en solution, dont la vitesse est affectée par la composition du milieu, que les radicaux OH° jouent un rôle important dans le processus de dégradation de la molécule. La constante apparente de la cinétique de disparition du NET obtenue est de 0,0178 min‑1. Cette constante est similaire à diverses autres constantes obtenues dans les études portant sur la dégradation des colorants azoïques par plasma où elles varient de 0,008 min‑1 à 0,033 min‑1 (ABDELMALEK et al., 2004; GHEZZAR et al., 2007).
3.2 Mesure du carbone organique total
Les résultats expérimentaux regroupés dans la figure 8 montrent un accroissement rapide du taux d’abattement du COT qui croît avec le temps d’exposition à la décharge. On obtient après 45 min de traitement un taux de minéralisation de 57,3 %. Cette variation est une preuve de la minéralisation du NET sous l’action des espèces réactives générées par le plasma d’air humide. L’abattement obtenu révèle l’efficacité de notre technique à décomposer le NET. Cette décomposition résulterait premièrement de la rupture de la liaison (-N = N-), puis de la formation des produits d’hydroxylation du NET sous l’action des radicaux hydroxyles.
Figure 8
Abattement du COT et cinétique en fonction de la durée de traitement ((■) COT (%), (▲) Ln (COT)).
TOC abatement and kinetics of the reaction as a function of treatment time ((■) COT (%), (▲) Ln (COT)).
La performance du glidarc est démontrée par une diminution exponentielle du COTpour (0 < t* < 45 min). Les valeurs du COT permettent d’établir les paramètres cinétiques de minéralisation déduits de la figure 6. Nous obtenons globalement une cinétique d’ordre 1 et une constante de vitesse k1 = 0,0188 min‑1.
3.3 Suivi de la demande chimique en oxygène
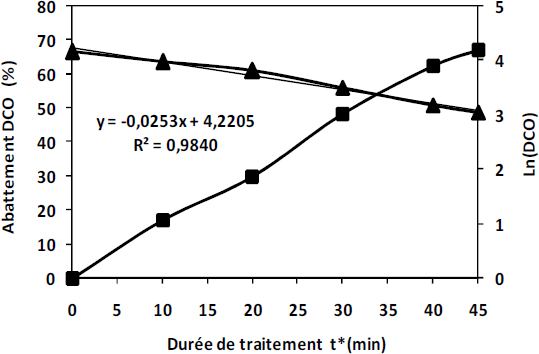
Compte tenu du fait que les effluents textiles sont très chargés en DCO, on se propose d’étudier son évolution après exposition du colorant textile (solution aqueuse) à la décharge électrique. Notons que la mesure de la DCO constitue également un bon indicateur de l’efficacité de la minéralisation. La variation de la DCO a été suivie au cours du temps de traitement. D’après la courbe de la figure 9, on remarque que la DCO diminue progressivement avec la durée de traitement. Après 45 min d’exposition à l’effluvage électrique, nous obtenons un abattement de 67,2 %. La décroissance de la DCO confirme la minéralisation qui peut s’expliquer par la conversion des composés aromatiques en aliphatiques suite à l’ouverture des cycles benzéniques (BELHADJ et SAVALL, 1999; CALINDO et al., 2000; OTURAN, 2001). Elle indique également qu’au contact de la décharge électrique il y a eu oxydation du NET en ions minéraux (NH4+, NO3‑, SO42‑, CO2 et H2O) en solution (MALETZKY et BAUER, 1998; TANAKA et al., 2000).
Figure 9
Abattement de la DCO et cinétique en fonction de la durée de traitement ((■) DCO (%), (▲) Ln (DCO)).
COD abatement and kinetics of the reaction as a function of treatment time((■) COD (%), (▲) Ln (COD)).
L’étude cinétique de la dégradation du NET évaluée par le tracé du logarithme des valeurs de la DCO obtenues en fonction du temps d’exposition (Figure 9), a conduit à l’obtention d’une cinétique de réaction d’ordre 1 avec une constante de vitesse de 0,0253 min‑1.
3.4 Analyses qualitatives
Après arrêt de la décharge, nous avons pu identifier la présence du dioxyde de carbone à l’aide de tubes dosimètres Dräger. La formation d’ions ammonium a été attestée par un test positif au réactif de Nessler. De même, l’application du test au BaCl2 à une aliquote de notre solution traitée par plasma a montré la formation d’un précipité blanc résistant à l’action de l’acide chlorhydrique dilué ou concentré, ce test indique qu’il s’est formé du BaSO4, et établit donc l’existence d’ions sulfates en solution. Ces résultats qualitatifs sont en accord avec les diverses hypothèses avancées sur la minéralisation de NET.
4. Conclusion
La décharge électrique glissante d'air humide permet de générer des espèces radicalaires très oxydantes à pression atmosphérique et température modérées. Cette technique peut ainsi être utilisée avec succès et proposée comme solution pour la dégradation du Noir Eriochrome T, en particulier, et celle des molécules de la famille des composés azoïques. La formation d’un composé intermédiaire au cours du traitement révèle qu’il y a eu rupture de la liaison N = N, la présence des ions minéraux en solution confirme le caractère oxydant du plasma d’air humide utilisé, qui se traduit par la présence et le rôle des radicaux OH présents dans la décharge. La destruction du polluant obéit à une cinétique de premier ordre. Le plasma glidarc constitue donc une technologie efficace pour l’élimination des polluants.
Appendices
Remerciements
Les auteurs remercient la Fondation Internationale pour la Science pour le soutien matériel et scientifique apporté pour la réalisation de ce travail (programme FIS 2010 No: W/4219-1) offert à Nzali Serge, l’unité de recherche Wastewater Research Unit de l’Université de Yaoundé I pour les analyses effectuées, ainsi que le Professeur Émérite Jean-Louis BRISSET de l’Université de Rouen pour son soutien matériel et sa contribution dans l’élaboration de ce travail de recherche.
Références bibliographiques
- ADBELMALEK F., M.R. GHEZZAR, M.N. BELHADJ, A. ADDOU et J.L. BRISSET (2006). Bleaching and degradation of textile dyes by non-thermal plasma process at atmospheric pressure. Ind. Eng. Chem. Res., 45, 23-29.
- ADBELMALEK F., S. GHARBI, B. BENSTAALI, A. ADDOU et J.L. BRISSET (2004). Plasmachemical degradation of azo dyes by humid air plasma: yellow supranol 4 GL, scarlet red nylosan F3 GL and industrial waste. Water Res., 38, 2339-2347.
- BELHADJ T. et A. SAVALL (1999). Mecanistic aspect of phenol electrochemical degradation by oxidation on Ti/PbO2 anode. J. Electrochem. Soc., 145, 3427.
- BENHNAJADY M.A., N. MODIRSHAHLA et H. FATHI (2006). Kinetics of decolorization of an azo dye in UV alone and UV/H2O2 processes. J. Hazardous. Mater., B136, 816-821.
- BENSTAALI B., D. MOUSSA, A. ADDOU et J.L. BRISSET (1998). Plasma treatment of aqueous solutes: some chemical properties of a gliding arc in humid air. Eur. Phys. J. AP, 4, 171-179.
- BENSTAALI B., P. BOUBERT, B.G CHERON, A. ADDOU et J.L. BRISSET (2002). Density and rotational temperatures measurements of the NO° and HO° radicals produced by a gliding arc in humid air and their interaction with aqueous solution. Plasma Chem. Plasma Proc., 22, 553-571.
- BRISSET J.L. (2009). La foudre en bouteille. Décharges électriques glissantes à la pression atmosphérique et leurs applications à l’environnement. Union des professeurs de physique et de chimie, France, Vol 103.
- BURLICA R., M. KIRKPATRICK et B.R. LOCKE (2006). Formation of reactive species in gliding arc discharges with liquid water. J. Electrostat., 64, 35-43.
- CALINDO C., P. JACQUES et A. KALT (2000). Photodegradation of the amino azo benzene acid orange 52 by trace advanced oxidation processes UV/H2O2, UV/TiO2, and VIS/TiO2 comparative mechanistic and kinetic investigations. J. Photochem. Photobiol. A: Chem., 130, 35.
- CZERNICHOWSKI A. (1994). Gliding arc. Applications to engineering and environment control. Pure Appl.Chem., 66, 1301-1310.
- DELAIR L. (2004). Caractérisation de sources plasma dédiées à la simulation de rentrée atmosphérique et au traitement des polluants : arc soufflé basse pression et décharge glissante atmosphérique. Thèse de Doctorat, Univ. Rouen, France, 56 p.
- DOUBLA A., E.B. TSAGOU-SOBZE, D. MOUSSA, R. BURLICA, E. HNATIUC et J.L. BRISSET (2007). Plasmachemical degradation of urea and thiourea solutes exposed to an electric discharge at atmospheric pressure. Rev. Sci. Eau., 20, 265-272.
- GHEZZAR M.R., F. ABDELMALEK, M.N. BELHADJ, N. BENDERDOUCHE et A. ADDOU. (2007). Gliding arc plasma assisted photocatalytic degradation of anthraquinonic dye acid green 25 in solution with TiO2. Appl. Catal. B., 72, 304-313.
- GUIVARCH E., S. TREVIN et C. LAHITTE (2003). Degradation of azo dyes in water by Electro-Fenton process. Environ Chem Lett., 1, 38 p.
- HONG J., N. TA, S. YANG, Y. LUI et C. SUN (2007). Microwave-assisted direct photolysis of bromophenol blue using electrodeless discharge lamps. Desalination, 214, 62-69.
- KOSSITSYN M., A. GUTSOL et A. FRIEDMAN (2003). Generation and diagnostic of non equilibrium plasma in gliding arc discharge. Dans : Proc. 16th International Conference on phenomena in Ionized gases (ICPIG), Taormina, Italie, Po 4.6, p. 231.
- MALETZKY P. et R. BAUER (1998). The photo-Fenton method degradation of nitrogen containing organic compounds. Chemosphere, 37, 899.
- MOUSSA D., A. DOUBLA, G. KAMGANG-YOUBI et J.L. BRISSET (2007). Post discharge long life reactive intermediates involved in the plasma chemical degradation of an azoic dye. IEEE Transac. Plasma Sci., 35, 444-453.
- OTURAN M.A., N. OTURAN, C. LAHITTE et S. TREVIN (2001). Production of hydroxyl radicals by electrochemically assisted Fenton’s reagent. Application to the mineralization of an organic micropollutant, pentachlorophenol. J. Electroanal. Chem., 507, 96-102.
- TANAKA K., K. PARDEMOLE et T. HISENAGA (2000). Photocatalytic degradation of commercial azo dyes. Water Res., 34, 327.
List of figures
Figure 1
Schéma du dispositif expérimental du réacteur glidarc utilisé.
Sketch of the experimental gliding arc reactor used.
Figure 2
Structure du Noir Eriochrome T, sel sodique.
Structure of Eriochrome Black-T, sodium salt.
Figure 3
Spectre UV- visible d’une solution de NET traitée par plasma : 1 : 0 min, 2 : 0,5 min, 3 : 1 min, 4 : 1,5 min, 5 : 2 min, 6 : 3 min, 7 : 5 min, 8 : 9 min, 9 : 12 min, 10 : 15 min, 11 : 30 min, 12 : 45 min.
UV-visible spectrum of a NET solution treated by plasma 1: 0 min, 2: 0.5 min, 3: 1 min, 4: 1.5 min, 5: 2 min, 6: 3 min, 7: 5 min, 8: 9 min, 9: 12 min, 10: 15 min, 11: 30 min, 12: 45 min.
Figure 4
Évolution de l’absorbance en fonction de la durée d’exposition.
Evolution of absorbance as a function of exposure time.
Figure 5
Expression logarithmique de l’absorbance en fonction de la durée d’exposition (0 < t* < 2 min).
Logarithmic expression of the absorbance as a function of exposure time (0 < t* < 2 min).
Figure 6
Cinétique de dégradation du Noir Eriochrome T en solution aqueuse (C = 150 µM).
Degradation kinetics of an aqueous solution of Eriochrome Black T (C = 150 µM).
Figure 7
Variation de Ln C/C0 en fonction de la durée de traitement.
Variation of ln (C/C0) as a function of treatment time.
Figure 8
Abattement du COT et cinétique en fonction de la durée de traitement ((■) COT (%), (▲) Ln (COT)).
TOC abatement and kinetics of the reaction as a function of treatment time ((■) COT (%), (▲) Ln (COT)).
Figure 9
Abattement de la DCO et cinétique en fonction de la durée de traitement ((■) DCO (%), (▲) Ln (DCO)).
COD abatement and kinetics of the reaction as a function of treatment time((■) COD (%), (▲) Ln (COD)).