Corps de l’article
Au cours des 20 dernières années, les recherches en génétique moléculaire des mammifères, et bon nombre de leurs applications, ont développé et utilisé des technologies pour manipuler le génome des organismes supérieurs en général et de la souris en particulier. Il s’agit d’inscrire une modification du génome dans la lignée germinale, par une intervention à une étape très précoce du développement, avant la première mise en place des précurseurs de la gamétogenèse. Trois voies sont utilisées, la microinjection d’ADN dans un oeuf fécondé, le transfert dans les cellules souches embryonnaires (lignées ES), et plus récemment, le « clonage reproductif » par reprogrammation du noyau d’une cellule somatique injecté dans un oeuf énucléé. Un nouvel accès au génome de l’embryon très précoce est aujourd’hui ouvert par les progrès de nos connaissances sur les cellules germinales, en particulier les cellules germinales mâles plus facilement accessibles. Modifier de manière permanente les gamètes, cellules à vie courte constamment renouvelées, exige une intervention sur les cellules souches dont ils dérivent. Or, jusqu’à une date récente, peu de choses était connu de la biologie de la cellule souche germinale. En très petit nombre (20-30000 par testicule adulte), ces cellules pendant toute la vie adulte produisent, à des intervalles rigoureusement définis, une cellule fille engagée dans la voie de différenciation menant à la méiose, puis à la formation du spermatozoïde (spermiogenèse) [1]. Des progrès significatifs récents ouvrent des voies nouvelles tant pour la recherche fondamentale que pour les biotechnologies.
Après une première caractérisation cytologique et histologique fine [2], l’étude fonctionnelle des cellules souches germinales n’est devenue possible que depuis les travaux récents du laboratoire de R. Brinster à Philadelphie [3] (Figure 1). Il a été montré que les cellules germinales extraites d’un testicule (donneur) peuvent être implantées dans un testicule receveur d’un mâle stérile. L’arrêt, temporaire ou permanent, de la spermatogenèse du receveur peut être le fait d’une mutation du récepteur Kit (récepteur du stem cell factor) chez le mutant W-, d’une irradiation ou d’un traitement pharmacologique. Toutes les étapes de la différenciation germinale sont reconstituées à partir des cellules implantées. La spermatogenèse est rétablie à long terme, avec ses cycles réguliers caractéristiques, montrant bien que dans la fraction germinale transférée, relativement hétérogène, existait bien une fraction de cellules souches, minoritaire mais essentielle. Ces résultats impliquent, mais on le savait par ailleurs, que ni les traitements utilisés pour stériliser le testicule receveur, ni la mutation W-, n’affectent les cellules somatiques de l’épithélium séminifère qui assurent la fonction de support de la différenciation germinale (cellules de Sertoli). Il est à noter qu’une telle restitution complète d’un tissu adulte par transplantation de cellules souches n’a été possible jusqu’à présent que dans un autre cas, celui des cellules hématopoïétiques, capables de reconstituer tout le répertoire des cellules sanguines.
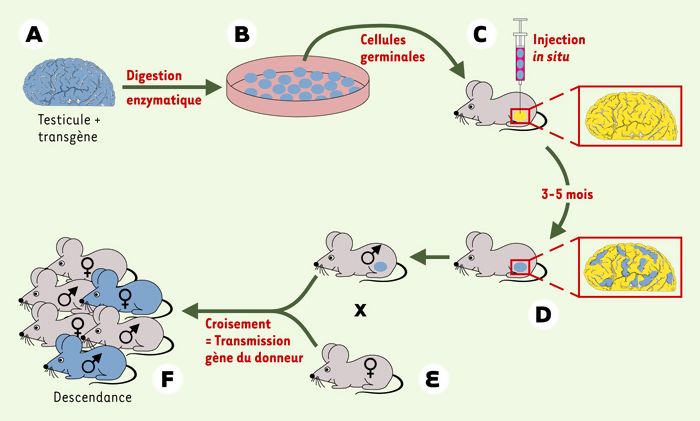
Figure 1
Stratégie de transplantation testiculaire.
Une suspension cellulaire est obtenue à partir du testicule d’un donneur fertile (A). Les cellules peuvent être cultivées (B) avant leur microinjection dans la lumière de tubes séminifères d’une souris receveuse stérile (C). Seule une cellule souche pourra être à l’origine d’un processus de spermiogenèse efficace dans le testicule du receveur. Si les cellules testiculaires greffées expriment un transgène marqueur (lacz) dont l’expression est symbolisée par la couleur bleue, on peut facilement détecter les clones de cellules germinales chez le receveur sous forme de bandes tubulaires bleues (D). L’accouplement du mâle receveur à une femelle sauvage (E) engendre une descendance qui porte le gène du donneur (F). Une modification génétique peut être introduite dans les cellules germinales pendant le temps de culture (B) (d’après [3]).
L’efficacité de la reconstruction dépend pour une large part de la préparation des cellules germinales du testicule donneur, que l’on s’attachera à enrichir en cellules souches par des moyens physiologiques ou moléculaires. L’utilisation du testicule dit cryptorchide (stérilité induite par la température) permet un enrichissement significatif. On sait que le maintien, pathologique ou expérimental, du testicule dans la cavité abdominale (à 37 °C alors qu’en position externe, il est normalement à 30-32 °C) aboutit à la disparition des cellules germinales en voie de différenciation, alors que les stades germinaux précoces survivent. Les fractions germinales cryptorchides montrent ainsi une augmentation de l’ordre de 25 fois de la proportion des cellules capables de coloniser les tubes séminifères du receveur. Un second moyen a été d’utiliser des marqueurs de surface des cellules souches pour un fractionnement immunologique. Ainsi, les anticorps dirigés contre les intégrines α1β6 caractéristiques de la cellule germinale souche ont été utilisés pour une purification, qui cependant demeure limitée (25 %) [4, 5]. Nous-mêmes avons pu obtenir des fractions très enrichies à partir de mâles transgéniques exprimant un marqueur de surface hétérologue à la surface des cellules souches. L’efficacité de colonisation du tube séminifère devient alors très élevée [6] (Figure 2). Les critères cytologiques ou moléculaires pour l’identification et la purification de ces cellules sont encore fragiles. Cependant, les techniques performantes aujourd’hui disponibles pour l’analyse des « protéomes » et « transcriptomes », appliquées aux fractions purifiées et couplées avec le test de transplantation, ouvrent un vaste champ d’investigation pour identifier les marqueurs adéquats afin de les utiliser pour purifier les cellules souches dans différentes espèces.
Figure 2
Reconstitution de l’épithélium séminifère après injection de cellules souches purifiées dans les tubes séminifères [6].
Les cellules souches germinales purifiées à partir du testicule d’un mâle adulte portant un transgène à expression ubiquitaire codant pour la β-galactosidase d’Escherichia coli (Rosa26) ont été injectées dans les tubes séminifères d’un receveur préalablement stérilisé par irradiation. A. Après 13 semaines, les tubes séminifères d’un testicule entier sont colorés (X-Gal) pour la détection de l’enzyme marqueur des cellules injectées. B. Coupe colorée montrant les cellules β-galactosidase-positives à tous les stades de différenciation. Le fait que plusieurs cycles de différenciation se sont déroulés pendant ces 13 semaines démontre une reconstitution complète à partir des cellules souches.
Une série de questions importantes peuvent maintenant être abordées, qui seront utiles en biologie fondamentale ou pour des applications médicales et biotechnologiques. Ainsi, les régulations qui permettent, à des intervalles rigoureusement définis, le démarrage de chaque cycle spermatogénique sont encore mal comprises. L’identification des signaux impliqués peut avoir des conséquences sur notre compréhension des mécanismes encore obscurs des stérilités mâles. Une autre application médicale envisagée est de pouvoir reconstituer la spermatogenèse après les traitements anticancéreux appliqués avant la puberté. Cependant, les apports les plus importants à court terme sont dans le domaine de la biotechnologie. Bien que seulement pour une période limitée (pour le moment), il est possible de maintenir les cellules germinales en culture avant de les réimplanter. La perspective d’une intervention génétique pendant cette période est alors tentante. En 2001, Nagano, Brinster et leurs collaborateurs ont réussi une expérience pilote de transfert génétique par un vecteur rétroviral dans des cellules germinales [7]. L’efficacité de « prise » de la greffe des cellules génétiquement modifiées est encore variable. Cependant, dans les meilleurs cas, de 1 à 8 % des descendants des mâles receveurs ont été trouvés porteurs du transgène et capables d’une transmission mendélienne stable. Ce résultat est d’un grand intérêt en transgenèse, d’abord parce que la méthode est rapide et relativement simple techniquement. Mais aussi et surtout parce que le site d’intégration du transgène est différent dans chaque cellule souche transplantée, et donc dans chacune des familles qui seront établies à partir de la première génération des descendants. On pourra ainsi d’emblée étudier l’expression des gènes intégrés indépendamment des effets éventuels des séquences environnantes - problème récurrent de la transgenèse classique.
Il a été également montré, toujours par le laboratoire de Brinster, que des cellules souches d’autres rongeurs, notamment de rat, pouvaient poursuivre leur maturation après leur transplantation dans le testicule de la souris [8], et les transplantations croisées entre espèces seront intéressantes pour analyser les systèmes de reconnaissance tissulaire. Un travail récent a maintenant étendu au rat la transgenèse par transplantation germinale [9]. Alors que la souris reste le premier matériel expérimental pour le généticien, le rat est particulièrement favorable pour le physiologiste. C’est sur le rat, en particulier du fait d’une plus grande taille, que beaucoup d’observations de référence ont été faites. Toutefois, une limitation importante est l’absence des puissants outils génétiques disponibles pour la souris – la microinjection d’ADN dans l’embryon précoce est peu efficace, il n’existe pas de lignées de cellules souches embryonnaires (ES). La technique aujourd’hui proposée pour la modification du génome du rat aura donc un impact certain en physiologie. Au-delà, l’amélioration par transgenèse devient possible pour tous les animaux d’intérêt économique pour lesquels les techniques classiques de modification du génome établies chez la souris s’étaient révélées impraticables. En plus de l’amélioration proprement dite du bétail, de nombreuses applications ont été envisagées, des xénogreffes à la production de protéines d’intérêt médical. Mais les recherches sont encore peu avancées, du fait des mêmes limitations que celles rencontrées pour le rat, ajoutées au coût d’essais qui doivent être pratiqués chez des animaux de grande taille. C’est au demeurant pour cette raison que l’approche surmédiatisée, laborieuse et coûteuse du clonage reproductif avait été mise en oeuvre. La stratégie serait de modifier d’abord le génome d’une cellule somatique en culture (ce que l’on sait faire, en principe), puis d’obtenir la « reprogrammation » du noyau modifié, ramené à l’état embryonnaire après son injection dans un ovocyte. Cette opération est affectée aujourd’hui d’un taux d’échec considérable, même si les premiers résultats ont pu être annoncés [10]. L’exploration de voies alternatives est donc d’un intérêt certain, l’intervention sur les cellules germinales, encore balbutiante, sera peut être une des voies de l’avenir. Et la recherche, imprévisible, ouvrira encore de nouvelles perspectives.
Parties annexes
Références
- 1. Russell LD, Ettlin RA, Sinha Hikim AP, Clegg ED. Histological and histopathological evaluation of the testis. Clearwater FL: Cache River Press, 1990.
- 2. De Rooij DG, Grootegoed JA. Spermatogonial stem cells. Curr Opin Cell Biol 1998; 10: 694-701.
- 3. Brinster RL. Germline stem cell transplantation and transgenesis. Science 2002; 296: 2174-6.
- 4. Shinohara T, Orwig KE, Avarbock MR, Brinster RL. Spermatogonial stem cell enrichment by multiparameter selection of mouse testis cells. Proc Natl Acad Sci USA 2000; 97: 8346-51.
- 5. Shinohara T, Avarbock MR, Brinster RL. beta1- and alpha6-integrin are surface markers on mouse spermatogonial stem cells. Proc Natl Acad Sci USA 1999; 96: 5504-9.
- 6. Giuili G, Tomljenovic A, Labrecque N, Oulad-Abdelghani M, Rassoulzadegan M, Cuzin F. Murine spermatogonial stem cells: targeted transgene expression and purification in an active state. EMBO Rep 2002; 3: 753-9.
- 7. Nagano M, Brinster CJ, Orwig KE, Ryu BY, Avarbock MR, Brinster RL. Transgenic mice produced by retroviral transduction of male germ-line stem cells. Proc Natl Acad Sci USA 2001; 98: 13090-5.
- 8. Orwig KE, Shinohara T, Avarbock MR, Brinster RL. Functional analysis of stem cells in the adult rat testis. Biol Reprod 2002; 66: 944-9.
- 9. Hamra FK, Gatlin J, Chapman KM, et al. Production of transgenic rats by lentiviral transduction of male germ-line stem cells. Proc Natl Acad Sci USA 2002; 99: 14931-6.
- 10. Lai L, Kolber-Simonds D, Park KW, et al. Production of alpha-1,3-galactosyltransferase knockout pigs by nuclear transfer cloning. Science 2002; 295: 1089-92.
Liste des figures
Figure 1
Stratégie de transplantation testiculaire.
Une suspension cellulaire est obtenue à partir du testicule d’un donneur fertile (A). Les cellules peuvent être cultivées (B) avant leur microinjection dans la lumière de tubes séminifères d’une souris receveuse stérile (C). Seule une cellule souche pourra être à l’origine d’un processus de spermiogenèse efficace dans le testicule du receveur. Si les cellules testiculaires greffées expriment un transgène marqueur (lacz) dont l’expression est symbolisée par la couleur bleue, on peut facilement détecter les clones de cellules germinales chez le receveur sous forme de bandes tubulaires bleues (D). L’accouplement du mâle receveur à une femelle sauvage (E) engendre une descendance qui porte le gène du donneur (F). Une modification génétique peut être introduite dans les cellules germinales pendant le temps de culture (B) (d’après [3]).
Figure 2
Reconstitution de l’épithélium séminifère après injection de cellules souches purifiées dans les tubes séminifères [6].
Les cellules souches germinales purifiées à partir du testicule d’un mâle adulte portant un transgène à expression ubiquitaire codant pour la β-galactosidase d’Escherichia coli (Rosa26) ont été injectées dans les tubes séminifères d’un receveur préalablement stérilisé par irradiation. A. Après 13 semaines, les tubes séminifères d’un testicule entier sont colorés (X-Gal) pour la détection de l’enzyme marqueur des cellules injectées. B. Coupe colorée montrant les cellules β-galactosidase-positives à tous les stades de différenciation. Le fait que plusieurs cycles de différenciation se sont déroulés pendant ces 13 semaines démontre une reconstitution complète à partir des cellules souches.


![Reconstitution de l’épithélium séminifère après injection de cellules souches purifiées dans les tubes séminifères [6].](/fr/revues/ms/2003-v19-n6-7-ms537/006819ar/media/006819arf002n.jpg)