Résumés
Résumé
La faune ichtyologique du fjord du Saguenay est composée de plus de 60 espèces de poissons marins, diadromes et dulcicoles dont plusieurs font l’objet d’une pêche récréative comme l’éperlan arc-en-ciel anadrome (Osmerus mordax), le sébaste (Sebastes spp.), la morue franche (Gadus morhua), la morue ogac (Gadus ogac) et le flétan du Groenland (Reinhardtius hippoglossoides). On ignore si le recrutement des poissons marins exploités par la pêche récréative dans le Saguenay dépend de la production des stocks locaux ou des échanges avec les populations de l’estuaire du Saint-Laurent. Nous avons donc étudié la distribution spatio-temporelle de l’ichtyoplancton dans le fjord du Saguenay afin d’identifier les zones de production, de rétention et d’advection larvaires dans le but d’y préciser les mécanismes de recrutement des stocks de poissons. L’ichtyoplancton a été échantillonné à 21 stations sur le fjord du Saguenay à six occasions, de mai à octobre 2004, et à cinq occasions, de juin à septembre 2005. Les résultats montrent que le recrutement du capelan et de l’éperlan arc‑en‑ciel anadrome repose sur la production et la rétention des larves dans le fjord du Saguenay. Cependant, le recrutement des sébastes et des morues dépendrait de l’immigration de juvéniles en provenance de l’estuaire du Saint-Laurent. Ces résultats sont supportés par une revue des résultats des études antérieures sur les poissons du fjord du Saguenay. L’étude des mécanismes de recrutement des stocks de poissons du fjord du Saguenay favorise l’exploitation durable de ces ressources halieutiques conformément à la mission de Pêches et Océans Canada et dans le respect du programme de conservation du parc marin du Saguenay‑Saint-Laurent.
Mots clés:
- Fjord du Saguenay,
- recrutement,
- ichtyoplancton,
- capelan,
- éperlan arc-en-ciel,
- sébaste,
- morue,
- flétan du Groenland
Abstract
In the Saguenay Fjord, the fish community is composed of more than 60 marine, diadromous and freshwater species, including many species exploited by the winter sport fishery such as the rainbow smelt (Osmerus mordax), redfish (Sebastes spp.), Atlantic cod (Gadus morhua), Greenland cod (Gadus ogac), and Greenland halibut (Reinhardtius hippoglossoides). We do not know if the recruitment of the fish species exploited by the winter sport fishery depends on the local production of recruits in the Saguenay Fjord or on exchanges with the St. Lawrence Estuary populations. Hence, we measured the spatio-temporal distribution of ichthyoplankton in the Fjord to identify zones of larval production, retention or advection, in order to investigate the recruitment mechanisms of these stocks. We sampled ichthyoplankton at 21 stations on six occasions, from May to October 2004, and on five occasions, from June to September 2005. Results indicated that the recruitment of capelin (Mallotus villosus) and of the anadromous rainbow smelt (Osmerus mordax) relied on the local production and retention of larvae within the Fjord. However, the recruitment of redfish (Sebastes spp.) and cods (Gadus spp.) depended on the immigration of juveniles from the St. Lawrence Estuary. Our results are corroborated by a review of previous studies of these fish populations. Studying the recruitment mechanisms of fish populations in the Saguenay Fjord supports a sustainable exploitation of these locally important fisheries resources, in accordance with the mission of Fisheries and Oceans Canada and consistent with the conservation program of the Saguenay St. Lawrence Marine Park.
Keywords:
- Saguenay Fjord,
- recruitment,
- ichthyoplankton,
- capelin,
- rainbow smelt,
- redfish,
- cod,
- Greenland halibut
Corps de l’article
1. Introduction
Le fjord du Saguenay constitue, avec l’estuaire moyen et l’estuaire maritime du Saint‑Laurent, l’un des trois principaux écosystèmes qui forment le parc marin du Saguenay‑Saint‑Laurent (PMSSL, 2007). À l’exception de la Baie‑des‑Ha! Ha! et du Bras Nord, situés en amont, l’ensemble du fjord est inclus dans les limites du parc marin (Figure 1). Le Saguenay est un fjord typique avec un profil transversal en forme de U et un seuil d’une profondeur de 20 m à l’embouchure qui limite les échanges avec l’estuaire du Saint‑Laurent (SCHAFER et al., 1990). Il s’étend sur 120 km, de Saint-Fulgence à Tadoussac (Figure 1) et est constitué de trois bassins délimités par des seuils internes (DRAINVILLE, 1968). Le bassin supérieur en amont représente 75 % de la superficie totale du fjord et atteint une profondeur maximale de 276 m. Les eaux du fjord sont caractérisées par une thermo-halocline qui sépare une couche de surface mince (0‑20 m), chaude (5‑20 ºC) et saumâtre (5‑25 %) et une couche profonde épaisse (20‑276 m), très froide (0‑2 ºC) et salée (25‑31 %; DRAINVILLE, 1968; SCHAFER et al., 1990). La couche de surface est fortement influencée par l’apport d’eau douce de la rivière Saguenay en amont et par le réchauffement atmosphérique estival (SCHAFER et al., 1990). La couche profonde du fjord est renouvelée par les eaux froides, salées et bien oxygénées de l’estuaire maritime du Saint‑Laurent, en fonction des marées et des vents (BÉLANGER, 2003; DRAINVILLE, 1968; SEIBERT et al., 1979; STACEY et GRATTON, 2001; THERRIAULT et al., 1984).
Figure 1
Carte de localisation des sites d’échantillonnage sur le fjord du Saguenay.
Map of sampling site locations in the Saguenay Fjord.
DRAINVILLE (1970) a décrit la faune ichtyologique du fjord du Saguenay, composée de plus de 60 espèces de poissons marins, diadromes et dulcicoles. Certaines de ces espèces font l’objet d’une pêche récréative hivernale, aussi appelée pêche blanche, devenue très populaire sur les glaces du Saguenay au cours des 20 dernières années (LAMBERT et BÉRUBÉ, 2002; MPO, 2007). Les principales espèces recherchées par la pêche blanche sont l’éperlan arc-en-ciel (Osmerus mordax), le sébaste (Sebastes spp.), la morue franche (Gadus morhua), la morue ogac (Gadus ogac) et le flétan du Groenland (Reinhardtius hippoglossoides). La pêche récréative hivernale s’organise principalement autour de huit villages sur glace dont quatre sont situés à l’intérieur des limites du parc marin du Saguenay‑Saint‑Laurent. La fréquentation annuelle des huit principaux villages de pêche a fluctué entre 46 000 et 63 000 jours/pêcheurs au cours de la période 1995‑2006 (MPO, 2007). Un suivi de la pêche blanche initié en 1995 indique un important déclin des stocks de poissons marins, tels que les sébastes et les morues depuis 1998‑1999 (MPO, 2007). La diminution de la limite de capture quotidienne et la réduction de la durée de la saison de pêche imposées en 2004 n’ont pas permis d’inverser les tendances. En terme de productivité marine, le Saguenay serait un écosystème peu productif (CÔTÉ et LACROIX, 1979). Conséquemment, on ignore si le taux d’exploitation des stocks de poissons marins du Saguenay a dépassé leur capacité de renouvellement. En outre, on ignore si le recrutement dépend de la production des stocks locaux ou des échanges avec les populations de l’estuaire du Saint‑Laurent.
Les poissons du Saguenay ont fait l’objet de relativement peu d’études scientifiques. Les travaux de DRAINVILLE (1970), basés sur une analyse zoogéographique des espèces de poissons présentes dans le Saguenay, ont conclu que la nappe profonde du fjord constituait une enclave biogéographique arctique dans une zone boréale. L’hypothèse de DRAINVILLE (1970) a engendré l’idée largement répandue que les populations de poissons marins du fjord du Saguenay étaient isolées de celles de l’estuaire et du golfe du Saint-Laurent et que leur renouvellement était assuré par le recrutement de jeunes produits localement (BOURGEOIS, 1993; LALANCETTE, 1984; RICHARD, 1997; TALBOT et al., 1994). Les travaux de BOSSÉ et al. (1996) sur les invertébrés benthiques ont rejeté le statut d’enclave arctique du fjord du Saguenay. Dans le cas de l’éperlan arc-en-ciel anadrome, il a été démontré que les populations du Saguenay se différencient de celles de l’estuaire du Saint‑Laurent et de la baie des Chaleurs sur le plan des caractéristiques morphologiques et méristiques (FRÉCHET et al., 1983a; LECOMTE, 2005), de la faune parasitaire (FRÉCHET et al., 1983b) et du génotype (LECOMTE, 2005). Par contre, les travaux en génétique n’ont démontré aucune différenciation entre les stocks de poissons marins du fjord du Saguenay et ceux de l’estuaire et du golfe du Saint‑Laurent pour le sébaste atlantique. (Sebastes mentella) (ROQUES et al., 2002; Valentin, 2006), le flétan du Groenland (SÉVIGNY, 1994) et la morue franche (SÉVIGNY et al., 2009). Ces résultats suggèrent qu’il existe des échanges entre le fjord du Saguenay et l’estuaire du Saint‑Laurent qui s’effectueraient passivement par l’advection des oeufs et des larves ou activement par la migration de juvéniles ou d’adultes (ARTHUR et ALBERT, 1993; SÉVIGNY, 1994).
Considérant les résultats présentés dans les études antérieures sur les poissons du fjord du Saguenay, on peut définir trois modèles conceptuels sur le recrutement des populations : (I) recrutement reposant sur la production locale de larves dans le fjord, (II) recrutement reposant sur l’advection d’oeufs et/ou de larves à partir de l’estuaire du Saint-Laurent et (III) recrutement reposant sur l’immigration de juvéniles à partir de l’estuaire du Saint‑Laurent (Figure 2). Ces trois modèles conceptuels ne sont pas mutuellement exclusifs et considèrent uniquement le recrutement des jeunes stades de vie et non le mouvement des adultes.
Figure 2
Modèles conceptuels du recrutement des populations de poissons dans le fjord du Saguenay
Conceptual models of the recruitment of fish populations in the Saguenay Fjord.
L’étude de l’ichtyoplancton est essentielle à la compréhension des mécanismes de recrutement chez les poissons car c’est au cours des jeunes stades de vie que s’établit la force des classes d’âge (CUSHING, 1996; FUIMAN et WERNER, 2002; HOUDE, 2008; LEGGETT et DEBLOIS, 1994). L’ichtyoplancton du fjord du Saguenay n’a encore jamais été étudié malgré l’importance de celui-ci pour le recrutement des populations et malgré que les mécanismes de renouvellement des stocks de poissons exploités par la pêche récréative hivernale soient inconnus.
Le premier objectif de cette étude est de décrire la distribution spatio-temporelle de l’ichtyoplancton dans le Saguenay afin d’identifier les zones de production, de rétention et d’advection larvaire qui préciseraient les mécanismes de recrutement des stocks de poissons du fjord. Le second objectif vise à comparer les études antérieures sur les poissons du fjord du Saguenay avec les résultats des relevés ichtyoplanctoniques en regard des trois modèles conceptuels sur le recrutement présentés à la Figure 2. L’atteinte de ces objectifs procurera des connaissances fondamentales sur le recrutement des poissons exploités par la pêche récréative hivernale. Celles-ci pourront être intégrées aux mesures de gestion qui favorisent l’utilisation durable des ressources halieutiques du fjord du Saguenay conformément à la mission de Pêches et Océans Canada et dans le respect du programme de conservation du parc marin du Saguenay‑Saint‑Laurent.
2. Matériels et méthodes
2.1 Échantillonnage
L’ichtyoplancton a été échantillonné à sept sites répartis dans les trois bassins du fjord du Saguenay. Le bassin supérieur comprend : Cap‑Jaseux, Baie‑des‑Ha! Ha!, Anse‑de‑Sable, Baie‑Éternité et Anse‑Saint-Jean. Le bassin intermédiaire comprend Baie‑Sainte-Marguerite et le bassin inférieur Anse‑à‑la‑Boule (Figure 1). À chaque site, une station près de la côte de chaque côté du fjord et une autre près du centre ont été échantillonnées pour un total de 21 stations sur l’ensemble du fjord. Toutes les stations ont été visitées de jour à six occasions en 2004 (18‑20 mai, 9-12 juin, 29-30 juin, 26-27 juillet, 30-31 août et 5-6 octobre) et à cinq occasions en 2005 (8 juin, 20-22 juin, 11‑12 juillet, 10-11 août et 31 août-4 septembre), à l’exception des sites de Anse‑Saint‑Jean, Baie‑Sainte‑Marguerite et Anse‑à‑la‑Boule qui n’ont pas été échantillonnés lors de la mission du 8 juin 2005 en raison d’un bris du treuil hydraulique.
En 2004, l’ichtyoplancton a été capturé à l’aide d’un échantillonneur Bongo, équipé de deux filets de 0,5 m de diamètre, de mailles de 475 µm et 153 µm respectivement, de débitmètres mécaniques General Oceanics (modèle 2030) et d’un thermographe Minilog VemcoMC mesurant la température et la profondeur. Le Bongo a été déployé de façon double oblique, à un maximum de 15 m de profondeur pour les stations côtières et de 60 m pour les stations centrales, pendant une période de dix minutes. Le volume d’eau filtrée était en moyenne de 254,6 m3. Immédiatement après la récolte, le contenu des filets était anesthésié dans une solution de dioxyde de carbone et conservé dans l’éthanol 95 % pour le filet de 475 µm, et dans une solution de formaldéhyde 4 %, tamponnée au borate de sodium pour le filet de 153 µm. En 2005, un chalut pélagique de type Tucker muni de deux filets (1m x 1m; maille de 500 µm), de deux débitmètres mécaniques General Oceanics (modèle 2030), d’un mécanisme d’ouverture/fermeture et d’un thermographe Minilog VEMCOMC, mesurant la température et la profondeur, a été utilisé pour récolter l’ichtyoplancton. Aux stations côtières, un seul filet a été déployé de façon double oblique à une profondeur maximale de 15 mètres pendant dix minutes. Aux stations centrales, deux filets ont été déployés de façon double oblique durant 15 minutes sous la thermohalocline (15‑120 m ou jusqu’à 5 m du fond) et durant dix minutes au-dessus de la thermo-halocline (0‑15 m). Le volume d’eau filtrée par le filet Tucker était en moyenne de 390,4 m3 et de 489,4 m3 respectivement dans la strate de surface et dans la strate profonde. Immédiatement après la récolte, le contenu des filets était anesthésié dans une solution de dioxyde de carbone et conservé dans l’éthanol 95 %. L’éthanol de tous les échantillons du Bongo, maille 475 µm et du filet Tucker a été changé la journée suivant l’échantillonnage pour éviter la dilution du conservatif (BUTLER, 1992). Plusieurs études ont démontré que la structure de taille de l’ichtyoplancton capturé avec un Bongo n’est pas différente que celle des larves de poissons échantillonnées avec un filet Tucker, pour des longueurs variant entre 4 et 22 mm (SHIMA et BAILEY, 1994). Cependant, l’échantillonneur Bongo serait plus variable que le filet Tucker (PEPIN et SHEARS, 1997).
2.2 Traitement des échantillons
En laboratoire, toutes les larves de poissons ont été triées, identifiées et dénombrées. L’identification était basée sur le guide de FAHAY (1983). Les oeufs de poissons ont seulement été dénombrés. La densité des larves a été calculée en divisant le nombre d’individus dénombrés par le volume d’eau filtré dans la strate échantillonnée. Toutes les larves de morue et un minimum de cinq larves d’éperlan arc-en-ciel, de capelan et de sébaste par échantillon ont été mesurées (longueur standard) à l’aide d’un oculaire micrométrique (± 0,1 mm).
Les otolithes sagitta ont été prélevés sur un sous-échantillon aléatoire de 84 sébastes et 276 éperlans échantillonnés en 2004 et sur 66 sébastes et 233 éperlans capturés en 2005, afin de déterminer l’âge des larves en jours à partir de l’analyse de la microstructure (SIROIS et al., 1998; STEVENSON et CAMPANA, 1992). Les otolithes ont été extraits de l’oreille interne avec des aiguilles entomologiques et déposés dans une goutte de colle thermoplastique Crystal BondMC sur une lame de microscope. L’interprétation de la microstructure des otolithes et la détermination d’âge ont été réalisées à un grossissement de 1 000X d’un microscope relié à un système d’analyse d’images. Le nombre d’accroissements journaliers comptés correspondait au nombre de jours depuis l’expulsion de la larve de la femelle ovovivipare chez le sébaste (PENNEY et EVANS, 1985) et depuis l’éclosion de l’oeuf chez l’éperlan arc-en-ciel (SIROIS et al., 1998).
3. Résultats et discussion
3.1 Diversité et distribution spatio-temporelle de l’ichtyoplancton dans le fjord du Saguenay
Les osmeridés (capelan, Mallotus villosus, et éperlan arc-en-ciel, Osmerus mordax) représentaient plus de 98 % des captures de larves de poissons en 2004‑2005 (Tableau 1). Quelques centaines de sébastes (Sebastes spp.) ont été capturés et de petites quantités de sigouines de roche (Pholis gunnelus), morues (Gadus spp.), lançons (Ammodytes sp.), lompénie-serpent (Lumpenus lumpretaeformis) et cyclopteridés ont été récoltées au cours des deux années. En 2004, on a également retrouvé quelques larves du grand corégone (Coregonus clupeaformis) et deux chaboisseaux à épines courtes (Myoxocephalus scorpius). Enfin, quatre autres espèces ont été récoltées en faible quantité en 2005 seulement : deux perchaudes (Perca flavescens), un poisson-alligator arctique (Aspidophoroides monopterygius), deux motelles à quatre barbillons (Enchelyopus cimbrius) et trois harengs atlantique (Clupea harengus). Toutes les espèces de poissons échantillonnées ont déjà été répertoriées dans le fjord du Saguenay et les dates de capture de ces larves concordent avec les périodes d’éclosion décrites dans SCOTT et SCOTT (1988) et avec les périodes d’occurrence des larves dans l’estuaire du Saint‑Laurent et la baie des Chaleurs (ABLE, 1978; DE LAFONTAINE et al., 1984).
Tableau 1
Diversité et nombre de larves de poissons capturées dans le cadre des relevés ichtyoplanctoniques menés sur le fjord du Saguenay en 2004‑2005.
Diversity and number of fish larvae caught during the ichthyoplanktonic surveys on the Saguenay fjord in 2004‑2005.
Espèce |
2004 |
2005 |
|
|---|---|---|---|
|
Strates de surface et profonde intégrées n |
Strate de surface (0 ‑ 15 m) n |
Strate profonde (> 15 m) n |
|
Mallotus villosus |
19 561 |
30 551 |
45 |
Osmerus mordax |
5 928 |
11 336 |
15 |
Sebastes spp. |
268 |
306 |
18 |
Pholis gunnelus |
11 |
15 |
0 |
Gadus spp. |
2 |
14 |
1 |
Ammodytes sp. |
8 |
3 |
0 |
Coregonus sp. |
5 |
0 |
0 |
Cyclopteridae |
1 |
4 |
0 |
Clupea harengus |
0 |
3 |
0 |
Enchelyopus cimbrius |
0 |
2 |
0 |
Lumpenus lumpretaeformis |
1 |
1 |
0 |
Myoxocephalus scorpius |
2 |
0 |
0 |
Perca flavescens |
0 |
2 |
0 |
Aspidophoroides monopterygius |
0 |
1 |
0 |
|
|
|
|
OEufs de poissons |
1 601 |
1 533 |
207 |
L’échantillonnage de 2005 a permis de mettre en évidence que plus de 99 % des larves de poissons capturées occupaient la mince couche de surface chaude et saumâtre du fjord du Saguenay (Tableau 1). Cependant, près de 12 % des oeufs de poissons ont été récoltés dans la strate inférieure (Tableau 1). Ce résultat suggère qu’il peut y avoir production d’oeufs dans la couche profonde du fjord par les espèces marines ou advection d’oeufs en provenance de l’estuaire du Saint‑Laurent. La moitié des oeufs de poissons retrouvés dans la couche profonde ont été récoltés au site de l’Anse‑à‑la‑Boule, supportant l’hypothèse de l’advection des oeufs car des échanges d’eau entre le bassin inférieur du Saguenay et l’estuaire du Saint‑Laurent ont lieu à tous les cycles de marée (DRAINVILLE, 1968, SEIBERT et al., 1979; STACEY et GRATTON, 2001; THERRIAULT et al., 1984). Néanmoins, la production ou l’advection d’oeufs dans la couche profonde du fjord du Saguenay ne contribue pas au maintien d’une communauté de larves de poissons dans ce milieu car elles en sont pratiquement absentes.
L’ichtyoplancton dans le fjord du Saguenay est dominé par les larves de capelan avec des densités atteignant 709,6 individus par 100 m-3 à l’Anse‑de‑Sable à la fin de juillet 2004 et 244,5 individus par 100•m-3 au site de Baie‑Éternité à la mi-juillet 2005 (Tableau 2). Les larves de capelan ont été capturées sur l’ensemble de la superficie du fjord avec les plus fortes densités dans le bassin supérieur (Tableau 2), indiquant une importante zone de production larvaire dans la portion amont de ce bassin (LESUEUR, 2004). DRAINVILLE (1970) ne mentionne pas la présence de capelan dans son inventaire des poissons du Saguenay réalisé de 1958 à 1968. En outre, aucune larve de capelan n’a été capturée en amont du bassin inférieur dans le cadre des travaux de PARENT et BRUNEL (1977), menés en juin et juillet 1973. Conséquemment, il semble que la présence du capelan dans le fjord du Saguenay représente une expansion récente de l’aire de répartition de l’espèce. L’hypothèse selon laquelle les larves de capelan seraient produites dans le Saint‑Laurent et transportées par les marées dans le Saguenay (JACQUAZ et al., 1977; PARENT et BRUNEL, 1977) n’est pas supportée par nos relevés ichtyoplanctoniques de 2004‑2005 car la densité larvaire est plus faible dans les bassins intermédiaire et inférieur que dans le bassin supérieur et les larves sont pratiquement absentes dans la couche profonde du fjord, c’est-à-dire, celle qui reçoit les eaux de l’estuaire (DRAINVILLE, 1968; SEIBERT et al., 1979; STACEY et GRATTON, 2001; THERRIAULT et al., 1984).
Tableau 2
Distribution spatio-temporelle des densités (en nb 100 m-3) des larves de capelan (Mallotus villosus), d’éperlan arc-en-ciel (Osmerus mordax) et de sébaste (Sebastes spp.). Aucune larve de capelan, d’éperlan arc-en-ciel ou de sébaste n’a été capturée lors de la mission du 18‑20 mai 2004.
Spatio-temporal distribution (in nb 100 m-3) of larval capelin (Mallotus villosus), rainbow smelt (Osmerus mordax), and redfish (Sebastes spp.). No capelin, rainbow smelt or redfish larvae were caught on May 18-20, 2004.
Site |
2004 |
2005 |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|
09‑12 juin |
29‑30 juin |
26‑27 juil. |
30‑31 août |
05‑06 oct. |
08 juin |
20‑22 juin |
11‑12 juil. |
10‑11 août |
31 août |
|
Mallotus villosus | ||||||||||
Cap‑Jaseux |
7,5 |
57,7 |
252,7 |
27,6 |
0,3 |
0 |
193,8 |
88,5 |
68,6 |
19,3 |
Baie‑des‑Ha! Ha! |
0,3 |
39,4 |
291,0 |
1,3 |
0 |
0 |
82,3 |
34,2 |
36,7 |
6,3 |
Anse‑de‑Sable |
6,7 |
32,7 |
709,6 |
1,8 |
0,1 |
0 |
175,7 |
151,6 |
99,0 |
102,9 |
Baie‑Éternité |
11,9 |
8,5 |
468,9 |
2,7 |
0 |
0 |
30,1 |
244,5 |
97,3 |
47,7 |
Anse‑Saint‑Jean |
10,4 |
16,1 |
403,7 |
2,0 |
0,1 |
- |
18,8 |
162,2 |
105,5 |
33,3 |
Baie‑Sainte‑Marguerite |
6,5 |
7,7 |
180,0 |
1,3 |
0 |
- |
8,6 |
49,7 |
5,1 |
9,4 |
Anse‑à‑la‑Boule |
5,9 |
6,8 |
17,1 |
2,8 |
0 |
- |
26,3 |
8,7 |
1,2 |
7,1 |
Osmerus mordax | ||||||||||
Cap‑Jaseux |
4,9 |
153,7 |
59,6 |
0 |
0 |
1,1 |
290,9 |
28,3 |
1,6 |
0,1 |
Baie‑des‑Ha! Ha! |
0 |
127,5 |
11,4 |
0 |
0 |
0 |
166,9 |
24,6 |
1,0 |
0,1 |
Anse‑de‑Sable |
2,1 |
90,5 |
36,8 |
0,1 |
0 |
0,4 |
109,9 |
10,2 |
0,4 |
0,1 |
Baie‑Éternité |
0,3 |
38,6 |
172,1 |
0,1 |
0 |
0,2 |
2,3 |
7,1 |
0 |
0 |
Anse‑Saint‑Jean |
0 |
22,8 |
49,7 |
0,1 |
0 |
- |
0,8 |
5,4 |
0 |
0 |
Baie‑Sainte‑Marguerite |
0,8 |
13,6 |
3,7 |
0 |
0 |
- |
0,2 |
2,1 |
0 |
0 |
Anse‑à‑la‑Boule |
0 |
1,4 |
1,3 |
0 |
0 |
- |
0,7 |
0,2 |
0,1 |
0 |
Sebastes sp. | ||||||||||
Cap‑Jaseux |
0 |
0 |
0,1 |
0 |
0 |
0 |
0 |
0,4 |
2,1 |
0,1 |
Baie‑des‑Ha! Ha! |
0 |
2,2 |
20,2 |
1,4 |
0 |
0 |
0,3 |
2,1 |
5,2 |
1,2 |
Anse‑de‑Sable |
0 |
0 |
2,1 |
0,4 |
0,3 |
0 |
0 |
1,7 |
3,8 |
0,6 |
Baie‑Éternité |
0 |
0 |
3,6 |
0,3 |
0 |
0 |
0 |
0,1 |
0,5 |
0,5 |
Anse‑Saint‑Jean |
0 |
0,1 |
2,8 |
0,8 |
0 |
- |
0 |
0,1 |
0,7 |
1,6 |
Baie‑Sainte‑Marguerite |
0 |
0 |
0 |
0 |
0 |
- |
0 |
0 |
0,1 |
0,1 |
Anse‑à‑la‑Boule |
0 |
0 |
0,1 |
0 |
0 |
- |
0 |
0 |
0,2 |
0 |
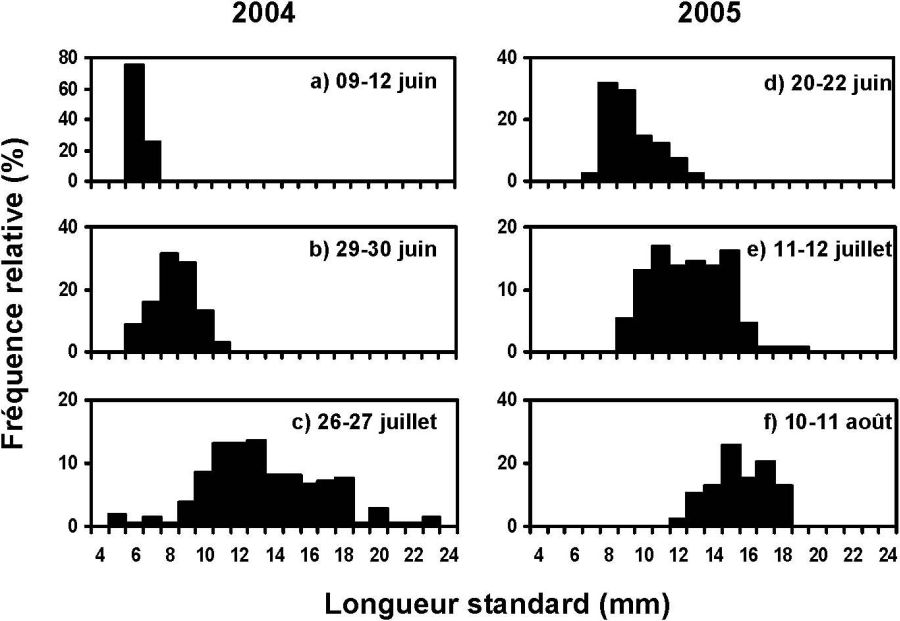
Les larves de capelan apparaissent dans le Saguenay à partir de la mi-juin, ce qui est plus tardif que dans l’estuaire moyen du Saint‑Laurent mais équivalent à l’estuaire maritime (JACQUAZ et al., 1977; PARENT et BRUNEL, 1977). Les distributions de fréquences des tailles des larves de capelan montrent la présence de petits individus fraîchement éclos (longueur standard < 7 mm) de la mi-juin jusqu’à la fin août (Figure 3). La taille moyenne des individus augmente au cours de l’été, particulièrement en 2005, alors qu’une importante proportion des larves de capelan mesurent plus de 15 mm à la fin août (Figure 3). Ces résultats supportent le modèle I (Figure 2) car le Saguenay peut permettre la rétention des larves produites localement et contribuer au recrutement du capelan dans le fjord. Néanmoins, le recrutement semble être très variable d’une année à l’autre, tel qu’illustré par l’abondance des larves mesurant plus de 15 mm, ce qui est beaucoup plus élevé en 2005 qu’en 2004.
Figure 3
Distributions de fréquences des longueurs des larves de capelan capturées dans le fjord du Saguenay à différentes dates en 2004 (a‑d) et en 2005 (e‑h).
Length frequency distributions of capelin larvae caught in the Saguenay Fjord at different dates in 2004 (a‑d) and in 2005 (e‑h).
L’éperlan arc-en-ciel représentait la seconde espèce la plus abondante dans l’ichtyoplancton du fjord du Saguenay en 2004‑2005. Les larves ont fait leur apparition dès le début juin et les plus fortes densités ont été observées à la fin du mois de juin dans la partie amont du bassin supérieur (Tableau 2). L’éperlan arc-en-ciel est un poisson anadrome qui fraye dans la portion fluviale du Saguenay, en amont de Chicoutimi, et les larves dérivent dans le fjord immédiatement après l’éclosion (LESUEUR, 2004). La détermination de l’âge des larves d’éperlan arc-en-ciel à partir de la microstructure des otolithes a révélé que plusieurs individus âgés entre 0 et 2 jours ont été capturés au Cap‑Jaseux et à l’Anse‑de‑Sable. En outre, des densités décroissantes de l’amont vers l’aval ont été observées en 2004‑2005, à l’exception des mois de juillet et août 2004, alors que les plus fortes densités étaient retrouvées en aval du bassin supérieur (Tableau 2).
Les distributions de fréquences des tailles des larves d’éperlan arc-en-ciel montrent que la longueur standard moyenne des individus augmente au cours de l’été (Figure 4). L’âge des larves mesurant plus de 15 mm variait entre 32 et 116 jours en 2004 et entre 29 et 74 jours en 2005. Comme chez le capelan, les résultats indiquent que le Saguenay, particulièrement le bassin supérieur, constitue une zone de rétention pour les larves d’éperlan arc-en-ciel, ce qui assure le recrutement de cette espèce dans le fjord (Modèle I; Figure 2). La figure 4 révèle la présence de petits individus mesurant moins de 7 mm pendant une période de deux mois, c’est-à-dire du début du mois de juin jusqu’à la fin du mois de juillet. Les dates d’éclosion, qui sont calculées à partir de l’âge des individus et de la date de capture, confirment que la période d’éclosion des larves d’éperlan arc-en-ciel a duré deux mois en 2004 et en 2005. Cette observation est unique chez cette espèce qui présente généralement une période d’éclosion d’environ trois semaines (SIROIS et DODSON, 2000).
Figure 4
Distributions de fréquences des longueurs des larves d’éperlan arc-en-ciel capturées dans le fjord du Saguenay à différentes dates en 2004 (a‑c) et en 2005 (d‑f).
Length frequency distributions of rainbow smelt larvae caught in the Saguenay Fjord at different dates in 2004 (a‑c) and in 2005 (d‑f).
Les densités de larves de sébaste étaient de plus d’un ordre de grandeur inférieur à celles du capelan et de l’éperlan arc-en-ciel (Tableau 2). Les jeunes sébastes ont été capturés principalement dans le bassin supérieur, et surtout dans la Baie‑des‑Ha! Ha!, entre la fin juin et la fin août (Tableau 2). La longueur standard des sébastes capturés variait entre 5,3 et 8,6 mm en 2004 et 5,1 et 8,0 mm en 2005 (Figure 5). L’âge maximal observé sur les otolithes de 150 larves était de quatre jours après expulsion de la femelle. L’absence d’individus mesurant plus de 9 mm et âgés de plus de quatre jours montre que la rétention ou la survie des larves de sébaste dans le fjord du Saguenay est nulle. On retrouve ordinairement les larves de sébaste dans les 50 premiers mètres de la colonne d’eau (KENCHINGTON, 1991). Il est possible que les eaux saumâtres et chaudes qui prévalent dans la couche de surface du Saguenay ne soient pas favorables à la survie des larves de ces poissons marins. Les résultats montrent que les femelles expulsent leurs larves dans le fjord du Saguenay, car il est improbable que les processus physiques du fjord transportent en quelques jours des individus de l’estuaire du Saint‑Laurent jusque dans la couche de surface du bassin supérieur (BÉLANGER, 2003). Toutefois, la production larvaire locale n’assure pas le recrutement des sébastes dans le fjord du Saguenay en raison de la mortalité ou de la dispersion des larves. Les résultats des relevés ichtyoplanctoniques supportent donc le modèle III pour le recrutement des sébastes (Figure 2).
Figure 5
Distributions de fréquences des longueurs des larves de sébastes capturées dans le fjord du Saguenay à différentes dates en 2004 (a‑c) et en 2005 (d‑f).
Length frequency distributions of redfish larvae caught in the Saguenay Fjord at different dates in 2004 (a‑c) and in 2005 (d‑f).
Seulement 17 larves de morue ont été capturées lors des relevés ichtyoplanctoniques réalisés en 2004‑2005 (Tableau 1). La longueur standard des individus capturés variait entre 3,52 et 8,00 mm, à l’exception d’un individu mesurant 10,60 mm qui a été capturé dans la couche profonde du bassin inférieur le 12 juillet 2005. Cette larve pourrait provenir du Saint‑Laurent en raison de la pénétration des eaux de l’estuaire à tous les cycles de marée dans la couche profonde du bassin inférieur (DRAINVILLE, 1968; SEIBERT et al., 1979; STACEY et GRATTON, 2001; THERRIAULT et al., 1984). Les larves de morue franche mesurent approximativement entre 3,5 et 30 mm lors de leur phase pélagique (MEEKAN et FORTIER, 1996). Conséquemment, la très faible densité de larves capturées dans le Saguenay et la petite taille de celles-ci indiquent que le fjord ne constituerait pas une zone de rétention pour les morues. Il est possible que les femelles pondent des oeufs dans le fjord du Saguenay (LALANCETTE, 1984), mais il n’y a pas d’indices de rétention ou de survie de ces individus. Comme chez le sébaste, il est probable que les eaux saumâtres de la couche de surface soient peu propices à la survie des larves de ces poissons marins. Les résultats montrent que le recrutement des morues dans le fjord du Saguenay ne dépend pas de la production larvaire locale qui est très faible et pour laquelle il n’y a aucun signe de rétention ou de survie. La présente étude supporte ainsi le modèle III pour les morues (Figure 2).
Aucune larve de flétan du Groenland n’a été capturée dans cette étude. La biologie et l’écologie de ce poisson dans le fjord du Saguenay, l’estuaire et le golfe du Saint‑Laurent sont très peu connues. Des larves de flétan du Groenland ont déjà été capturées dans les canaux profonds du golfe du Saint‑Laurent, mais peu dans l’estuaire maritime du Saint‑Laurent (DE LAFONTAINE, 1980). Nous évitons de conclure, au sujet de la production, de la rétention et du recrutement des larves du flétan du Groenland dans le fjord du Saguenay, à partir des relevés ichtyoplanctoniques, en raison des connaissances insuffisantes sur la distribution des larves de ce poisson et de l’échantillonnage en surface (0‑60 m en 2004 et 0‑120 m en 2005) qui a été réalisé dans le cadre de la présente étude.
3.2 Revue des travaux de recherche antérieurs sur les poissons du fjord du Saguenay en regard des trois modèles conceptuels sur le recrutement
Les résultats des relevés ichtyoplanctoniques réalisés en 2004‑2005 ont permis de comprendre les mécanismes de recrutement des principales populations de poissons exploitées dans le fjord du Saguenay en fonction des trois modèles conceptuels sur le recrutement présentés à la figure 2. Plusieurs travaux de recherche menés au cours des 25 dernières années ont comparé les populations de poissons du fjord du Saguenay avec celles retrouvées dans l’estuaire ou le golfe du Saint-Laurent, en utilisant des indicateurs très variés comme la génétique, les parasites, la morphométrie, etc. Il est possible de revisiter ces études pour vérifier quels modèles conceptuels du recrutement (Figure 2) peuvent être supportés ou rejetés.
Notre étude est la seule ayant porté sur les larves de capelan du Saguenay. Nos données récoltées en 2004‑2005 supportent le modèle I qui propose que le recrutement dépend de la production locale de larves dans le Saguenay (Tableau 3).
Tableau 3
Revue des travaux de recherche antérieurs sur les poissons du fjord du Saguenay en fonction des trois modèles conceptuels sur le recrutement présentés à la figure 2. L’appui (+) ou le rejet (-) des modèles conceptuels sont présentés.
Review of previous works on Saguenay Fjord fish according to the three conceptual models on recruitment presented in Figure 2. Support (+) or rejection (-) of the models are presented.
Espèce et indicateur |
Référence |
Modèle I |
Modèle II |
Modèle III |
|---|---|---|---|---|
Mallotus villosus | ||||
Ichtyoplancton |
Présente étude |
+ |
– |
– |
Conclusion |
|
Accepté |
Rejeté |
Rejeté |
Osmerus mordax | ||||
Ichtyoplancton |
Présente étude |
+ |
– |
– |
Génétique |
LECOMTE (2005) |
+ |
– |
– |
Caractères morphologiques et méristiques |
LECOMTE (2005) FRÉCHET et al. (1983a) |
+ |
– |
– |
Parasites |
FRÉCHET et al. (1983b) |
+ |
+ |
+ |
Conclusion |
|
Accepté |
Rejeté |
Rejeté |
Sebastes mentella | ||||
Ichtyoplancton |
Présente étude |
– |
– |
+ |
Éléments traces de l’otolithe |
CAMPANA et al. (2007) |
+ |
+ |
+ |
Génétique |
ROQUES et al. (2002) VALENTIN (2006) |
– |
+ |
+ |
Morphométrie |
VALENTIN (2006) |
+ |
+ |
+ |
Croissance |
BOURGEOIS (1993) |
+ |
+ |
+ |
Conclusion |
|
Rejeté |
Rejeté |
Accepté |
Gadus morhua | ||||
Ichtyoplancton |
Présente étude |
– |
– |
+ |
Éléments traces de l’otolithe |
SÉVIGNY et al. (2008) |
+ |
+ |
+ |
Génétique |
SÉVIGNY et al. (2008) |
– |
+ |
+ |
Indice de condition |
RICHARD (1997) |
+ |
+ |
+ |
Conclusion |
|
Rejeté |
Rejeté |
Accepté |
Reinhardtius hippoglossoides | ||||
Génétique |
SÉVIGNY (1994) |
– |
+ |
+ |
Caractéristiques du cycle vital |
TALBOT et SÉVIGNY (1994) |
– |
+ |
+ |
Parasites |
ARTHUR et ALBERT (1993) |
+ |
+ |
+ |
Conclusion |
|
Rejeté |
Accepté |
Accepté |
La différenciation de l’éperlan arc-en-ciel anadrome du Saguenay avec les populations de l’estuaire du Saint-Laurent a déjà été reconnue par des travaux de recherche sur les caractéristiques morphologiques et méristiques (FRÉCHET et al., 1983a; LECOMTE, 2005), sur la faune parasitaire (FRÉCHET et al., 1983b) et sur les marqueurs génétiques (LECOMTE, 2005). Les résultats sur les larves d’éperlan arc-en-ciel présentés ici concordent avec tous ces travaux et supportent le modèle I de recrutement (Tableau 3). Seuls les résultats de l’étude sur la faune parasitaire ne rejettent pas les modèles II et III car l’infestation aurait lieu au stade adulte (FRÉCHET et al., 1983b), après les processus d’advection ou de migration proposés pour ces deux modèles conceptuels.
Plusieurs études ont comparé le sébaste Atlantique retrouvé dans le Saguenay avec ceux de l’estuaire et du golfe du Saint‑Laurent en utilisant l’empreinte élémentaire de l’otolithe (CAMPANA et al., 2007), la génétique (ROQUES et al., 2002; Valentin, 2006), la morphométrie (Valentin, 2006) et la croissance (BOURGEOIS, 1993). Seul le modèle III de recrutement, reposant sur l’immigration de juvéniles, est supporté par ces cinq études et par la présente étude sur l’ichtyoplancton (Tableau 3). CAMPANA et al. (2007) ont démontré que l’empreinte élémentaire des otolithes du sébaste du Saguenay était fortement différenciée de celle des individus capturés dans le golfe du Saint-Laurent. Les travaux de Valentin (2006) ont montré que la forme des sébastes du Saguenay était différente de celle des individus du golfe du Saint‑Laurent. Ils concluent que les sébastes du Saguenay ont été séparés des autres sébastes pendant une grande partie de leur vie, ce qui est en accord avec les trois modèles conceptuels du recrutement. Par ailleurs, les travaux de ROQUES et al. (2002) et ceux de Valentin (2006) ont montré qu’il n’y a pas de différenciation génétique entre le sébaste du Saguenay et celui du golfe du Saint‑Laurent. Cette étude rejetterait le modèle I de recrutement reposant sur la reproduction isolée de la population de sébaste. Enfin, BOURGEOIS (1993) a estimé que la croissance du sébaste est plus faible dans le Saguenay que dans le golfe du Saint-Laurent. Cette observation peut être reliée à une séparation pendant une grande partie de leur vie, tel qu’il est démontré par CAMPANA et al. (2007) et Valentin (2006).
L’indice de condition de la morue franche du Saguenay, mesuré par RICHARD (1997), était plus élevé que celui mesuré sur les morues du golfe Saint‑Laurent. Ceci peut être relié à un isolement plus ou moins long des morues du fjord par rapport à celles de l’estuaire. SÉVIGNY et al. (2009) ont démontré que l’empreinte élémentaire des otolithes de la morue franche du Saguenay était fortement différenciée de celle des individus capturés dans le golfe du Saint‑Laurent, indiquant qu’elles ont été isolées pendant une grande partie de leur vie, ce qui est en accord avec les trois modèles conceptuels du recrutement. En outre, les résultats sur la génétique de la morue franche du fjord du Saguenay n’indiqueraient pas de différenciation avec les morues du Saint‑Laurent (SÉVIGNY et al., 2009). Conséquemment, ils ne supporteraient pas le modèle I du recrutement (Tableau 3). Comme pour le sébaste, seul le modèle III du recrutement n’est pas rejeté ni par ces travaux ni par nos résultats sur les larves de morue (Tableau 3).
Enfin, bien que les résultats des travaux sur l’ichtyoplancton soient peu concluants sur le flétan du Groenland, des études antérieures peuvent alimenter la réflexion sur les mécanismes de recrutement de cette espèce dans le fjord du Saguenay. SÉVIGNY (1994) a montré que le flux génique est important entre les flétans du Groenland, du Saguenay et ceux de l’estuaire du Saint‑Laurent. Cependant, ARTHUR et ALBERT (1993) ont réussi à séparer de façon très précise les flétans du Saguenay de ceux de l’estuaire et du golfe du Saint‑Laurent à partir de leur faune parasitaire. ARTHUR et ALBERT (1993) et SÉVIGNY (1994) ont suggéré que les échanges entre le fjord du Saguenay et l’estuaire du Saint-Laurent s’effectueraient passivement par l’advection des oeufs et des larves (modèle II) ou activement par la migration des juvéniles (modèle III; Tableau 3). Cependant, on ne peut pas rejeter le modèle I dans le cas de l’étude sur les parasites (Tableau 3). Plusieurs caractéristiques du cycle vital rapprochent les flétans du Groenland du Saguenay de ceux du Saint-Laurent par rapport aux populations de l’Atlantique (TALBOT et SÉVIGNY, 1994), appuyant également les modèles II et III (Tableau 3).
4. Conclusion
L’étude de l’ichtyoplancton du Saguenay et la revue des études antérieures sur les populations de poissons du fjord ont permis de mieux comprendre les mécanismes de recrutement des principales espèces exploitées par la pêche sportive hivernale. Le recrutement du capelan et de l’éperlan arc-en-ciel anadrome repose sur la production et la rétention des larves à l’intérieur du fjord. Le recrutement des sébastes et des morues dépend de l’immigration de juvéniles en provenance de l’estuaire du Saint‑Laurent. Le maintien du flétan du Groenland dans le fjord du Saguenay serait relié au transport passif d’oeufs et/ou de larves ou au transport actif de juvéniles à partir de l’estuaire du Saint‑Laurent.
Il serait important d’approfondir les connaissances sur les facteurs qui contrôlent les fluctuations interannuelles du recrutement des principales espèces de poissons qui font l’objet de la pêche blanche. Ainsi, il serait possible d’améliorer les prédictions sur l’état des stocks de poissons du fjord et d’assurer une exploitation durable de ceux-ci, conformément à la mission de Pêches et Océans Canada et dans le respect du programme de conservation du parc marin du Saguenay‑Saint‑Laurent.
Parties annexes
Remerciements
Les auteurs tiennent à remercier Amélie Bérubé, Mylène Bourque, Julie Brassard, Dominique Gauthier, Chantale Girard, Véronique Gravel, Pierre Joly et Patrick Nadeau pour leur aide sur le terrain et en laboratoire. Le projet de recherche a été financé par le programme de partenariat du Parc marin du Saguenay‑Saint‑Laurent, le ministère des Pêches et des Océans du Canada et par une subvention à la découverte octroyée à Pascal Sirois par le Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG). Gabriel Diab a été récipiendaire d’une bourse de maîtrise du Fonds québécois de recherche sur la nature et les technologies (FQRNT).
Références bibliographiques
- ABLE K.W. (1978). Ichtyoplankton of the St. Lawrence estuary: composition, distribution and abundance. J. Fish. Res. Bd. Can., 35, 1518-1531.
- ARTHUR J.R. et E. ALBERT (1993). Use of parasites for separating stocks of Greenland halibut (Reinhardtius hippoglossoides) in the Canadian Northwest Atlantic. Can. J. Fish. Aquat. Sci., 50, 2175-2181.
- BÉLANGER C. (2003). Observation and modelling of a renewal event in the Saguenay fjord. Thèse de doctorat, Université du Québec à Rimouski, Canada, 255 p.
- BOSSÉ L., B. SAINTE-MARIE et J. FOURNIER (1996). Les invertébrés des fonds meubles et la biogéographie du fjord du Saguenay. Rap. Tech. Can. Sci. Halieutiques Aquat., 2132, 52 p.
- BOURGEOIS A. (1993). Évaluation de l’exploitation du sébaste Atlantique (Sebastes mentella) par la pêche sportive hivernale sur le Saguenay, saison 1990-91. Mémoire de maîtrise, Université du Québec à Chicoutimi, Canada, 80 p.
- BUTLER J.L. (1992). Collection and preservation of material for otolith analysis. Dans: Otolith microstructure examination and analysis. STEVENSON D.K. et S.E. CAMPANA (Éditeurs), Can. Spec. Publ. Fish. Aquat. Sci., 117, Chap. 2, 13-17.
- CAMPANA S.E., A. VALENTIN, J.-M. SÉVIGNY et D. POWER (2007). Tracking seasonal migrations of redfish (Sebastes spp.) in and around the Gulf of St. Lawrence using otolith elemental fingerprints. Can. J. Fish. Aquat. Sci., 64, 6-18.
- CÔTÉ R. et G. LACROIX (1979). Influence de débits élevés et variables d’eau douce sur le régime saisonnier de production primaire d’un fjord subarctique. Oceanol. Acta, 2, 299-306.
- CUSHING D.H. (1996). Towards a science of recruitment in fish populations. Ecology Institute, Oldendorf/Luhe, Allemagne, 200 p.
- DE LAFONTAINE Y. (1980). First record of Greenland halibut larvae [Reinhardtius hippoglossoides (Walbaum)] in the lower St. Lawrence estuary. Nat. Can., 107, 285-287.
- DE LAFONTAINE Y., M.I. EL-SABH, M. SINCLAIR, S.N. MESSIEH et J.-D. LAMBERT (1984). Structure océanographique et distribution spatio-temporelle d’oeufs et de larves de poissons dans l’estuaire maritime et la partie ouest du golfe Saint‑Laurent. Sci. Tech. Eau, 17, 43-50.
- DRAINVILLE G. (1968). Le fjord du Saguenay : I. contribu-tion à l’océanographie. Nat. Can., 95, 809-855.
- DRAINVILLE G. (1970). Le fjord du Saguenay : II. La faune ichtyo-logique et les conditions écologiques. Nat. Can., 97, 623-666.
- FAHAY M.P. (1983). Guide to the early stages of marine fishes occurring in the Western North Atlantic Ocean, Cape Hatteras to the Southern Scotian shelf. J. Northw. Atl. Fish. Sci., 4, 1-423.
- FRÉCHET A., J.J. DODSON et H. POWLES (1983a). Use of variation in biological characters for the classification of anadromous rainbow smelt (Osmerus mordax) groups. Can. J. Fish. Aquat. Sci., 40, 718-727.
- FRÉCHET A., J.J. DODSON et H. POWLES (1983b). Les parasites de l’éperlan d’Amérique (Osmerus mordax) anadrome du Québec et leur utilité comme étiquettes biologiques. Can. J. Zool., 61, 621-626.
- FUIMAN L.A. et R.G. WERNER (2002). Fishery science: The unique contributions of early life stages. Blackwell Science, Malden, MA, USA, 336 p.
- HOUDE E.D. (2008). Emerging from Hjort’s shadow. J. Northw. Atl. Fish. Sci., 41, 53-70.
- JACQUAZ B., K.W. ABLE et W.C. LEGGETT (1977). Seasonal distribution, abundance and growth of larval capelin (Mallotus villosus) in the St. Lawrence estuary and northwestern Gulf of St. Lawrence. J. Fish. Res. Bd Canada, 34, 2015-2029.
- KENCHINGTON T.J. (1991). Vertical distribution and movements of larval redfishes (Sebastes spp.) in the southern Gulf of St. Lawrence. J. Northw. Atl. Fish. Sci., 11, 43‑49.
- LALANCETTE L.-M. (1984). Croissance, reproduction et régime alimentaire de la morue (Gadus morhua) vivant dans le fjord du Saguenay, au Québec. Can. Field Nat., 98, 305-314.
- LAMBERT J.D. et S. BÉRUBÉ (2002). La pêche sportive hivernale dans le fjord du Saguenay. Rapp. Tech. Can. Sci. Halieutiques Aquat., 2445, 68 p.
- LECOMTE F. (2005). Déterminisme écologique de la ségrégation génétique des populations sympathiques d’éperlans arc-en-ciel (Osmerus mordax) de l’estuaire moyen du Saint‑Laurent. Thèse de doctorat, Université Laval, Québec, Canada, 272 p.
- LEGGETT W.C. et E. DEBLOIS (1994). Recruitment in marine fishes: is it regulated by starvation and predation in the egg and larval stages? Neth. J. Sea. Res., 32, 119-134.
- LESUEUR C. (2004). Localisation des frayères à éperlans arc-en-ciel de la rivière Saguenay : rapport de fin de projet (1995-2003). Rapport du Comité ZIP‑Saguenay au ministère des Pêches et des Océans Canada, à la Société de la faune et des parcs du Québec et au parc marin du Saguenay‑Saint‑Laurent, 26 p.
- MEEKAN M.G. et L. FORTIER (1996). Selection for fast growth during the larval life of Atlantic cod (Gadus morhua) on the Scotian Shelf. Mar. Ecol. Prog. Ser., 137, 25‑37.
- MPO (2007). La pêche sportive hivernale dans le fjord du Saguenay en 2006. Secr. can. de consult. sci. du MPO, Avis scientifique 2007/001.
- PARENT S. et P. BRUNEL (1977). Aires et périodes de fraye du capelan (Mallotus villosus) dans l’estuaire et le golfe du Saint‑Laurent. Ministère de l’industrie et du commerce du Québec, Travaux sur les pêcheries du Québec, 45, 46 p.
- PENNEY R.W. et G.T. EVANS (1985). Growth histories of larval redfish (Sebastes spp.) on an offshore Atlantic fishing bank determined by otolith increment analysis. Can. J. Fish. Aquat. Sci., 42, 1452-1464.
- PEPIN P. et T.H. SHEARS (1997). Variability and capture efficiency of bongo and Tucker trawl samplers in the collection of ichthyoplankton and other macrozooplankton. Can. J. Fish. Aquat. Sci., 54, 765-773.
- PMSSL (2007). Rapport sur l’état du parc marin du Saguenay‑Saint‑Laurent 2007. Parc marin du Saguenay‑Saint‑Laurent, Tadoussac, Canada, 78 p.
- RICHARD F. (1997). Étude comparative de la condition et de l’état reproducteur de morues (Gadus morhua) du fjord du Saguenay et du folfe Saint‑Laurent. Mémoire de maîtrise, Université du Québec à Chicoutimi, Canada, 122 p.
- ROQUES S., J.-M. SÉVIGNY et L. BERNATCHEZ (2002). Genetic structure of deep-water redfish (Sebastes mentella) populations across the North Atlantic. Mar. Biol., 140, 297-307.
- SCHAFER C.T., J.N. SMITH et R. CÔTÉ (1990). The Saguenay fjord: A major tributary to the St. Lawrence estuary. Dans : Oceanography of a large-scale estuarine system: the St. Lawrence. EL-SABH M.I. et N. SILVERBERG (Éditeurs), Coastal and estuarine studies 39, Springer-Verlag, New York, NY, USA, Chap. 17, p. 378-420.
- SCOTT W.B. et M.G. SCOTT (1988). Atlantic fishes of Canada. Can. Bull. Fish. Aquat. Sci., 219, 731 p.
- SEIBERT G.H., R.W. TRITES et S.J. REID (1979). Deepwater exchange processes in the Saguenay Fjord. J. Fish. Res. Board Can., 36, 42-53.
- SÉVIGNY J.-M. (1994). Variation génétique chez le flétan du Groenland (Reinhardtius hippoglossoides) et la crevette nordique (Pandalus borealis) du fjord du Saguenay. Dans : Le fjord du Saguenay: un milieu exceptionnel de recherche. SÉVIGNY J.-M. et C.M. COUILLARD (Éditeurs), Rapp. Manus. Can. Sci. Halieutiques Aquat., 2270, 50-62.
- SÉVIGNY J.-M., A. VALENTIN, A. TALBOT et N. MÉNARD (2009). Connectivité entre les populations du fjord du Saguenay et celles du golfe du Saint-Laurent. Rev. Sci. Eau, (ce numéro).
- SHIMA M. et K.M. BAILEY (1994). Comparative analysis of ichthyoplankton sampling gear for early life stages of walleye pollock (Theragra chalcogramma). Fish. Oceanogr., 3, 50-59.
- SIROIS P., F. LECOMTE et J.J. DODSON (1998). An otolithbased backcalculation method to account for time-varying growth rate in rainbow smelt larvae (Osmerus mordax). Can. J. Fish. Aquat. Sci., 55, 2662‑2671
- SIROIS P. et J.J. DODSON (2000). Critical periods and growth-dependent survival of larvae of an estuarine fish, the rainbow smelt Osmerus mordax. Mar. Ecol. Prog. Ser., 203, 233-245.
- STACEY M.W. et Y. GRATTON (2001). The energetics and tidally induced reverse renewal in a twosilled fjord. J. Phys. Oceanogr., 31, 1599-1615.
- STEVENSON D.K. et S.E. CAMPANA (1992). Otolith microstructure examination and analysis. Can. Spec. Publ. Fish. Aquat. Sci., 117, 126 p.
- TALBOT A., A. BOURGEOIS et J.-M. SÉVIGNY (1994). Biologie du sébaste Atlantique (Sebastes spp.) dans le fjord du Saguenay. Dans : Le fjord du Saguenay : un milieu exceptionnel de recherche. SÉVIGNY J.-M. et C.M. COUILLARD (Éditeurs), Rapp. Manus. Can. Sci. Halieutiques Aquat., 2270, 77-82.
- TALBOT A. et J.-M. SÉVIGNY (1994). Caractéristiques de la population de flétan du Groenland (Reinhardtius hippoglossoides) du fjord du Saguenay. Dans : Le fjord du Saguenay : un milieu exceptionnel de recherche. SÉVIGNY J.‑M. et C.M. COUILLARD (Éditeurs), Rapp. Manus. Can. Sci. Halieutiques Aquat., 2270, 65-76.
- THERRIAULT J.-C., R. De LADURANTAYE et R.G. INGRAM (1984). Particulate matter exchange across the Saguenay fjord sill. Estuar. Coast. Shelf Sci., 18, 51-64.
- VALENTIN A. (2006). Structure des populations de sébaste de l’Atlantique du nord-ouest dans un contexte de gestion des stocks et d’évolution. Thèse de Doctorat, Univ. du Québec à Rimouski, Canada, 212 p.
Liste des figures
Figure 1
Carte de localisation des sites d’échantillonnage sur le fjord du Saguenay.
Map of sampling site locations in the Saguenay Fjord.
Figure 2
Modèles conceptuels du recrutement des populations de poissons dans le fjord du Saguenay
Conceptual models of the recruitment of fish populations in the Saguenay Fjord.
Figure 3
Distributions de fréquences des longueurs des larves de capelan capturées dans le fjord du Saguenay à différentes dates en 2004 (a‑d) et en 2005 (e‑h).
Length frequency distributions of capelin larvae caught in the Saguenay Fjord at different dates in 2004 (a‑d) and in 2005 (e‑h).
Figure 4
Distributions de fréquences des longueurs des larves d’éperlan arc-en-ciel capturées dans le fjord du Saguenay à différentes dates en 2004 (a‑c) et en 2005 (d‑f).
Length frequency distributions of rainbow smelt larvae caught in the Saguenay Fjord at different dates in 2004 (a‑c) and in 2005 (d‑f).
Figure 5
Distributions de fréquences des longueurs des larves de sébastes capturées dans le fjord du Saguenay à différentes dates en 2004 (a‑c) et en 2005 (d‑f).
Length frequency distributions of redfish larvae caught in the Saguenay Fjord at different dates in 2004 (a‑c) and in 2005 (d‑f).
Liste des tableaux
Tableau 1
Diversité et nombre de larves de poissons capturées dans le cadre des relevés ichtyoplanctoniques menés sur le fjord du Saguenay en 2004‑2005.
Diversity and number of fish larvae caught during the ichthyoplanktonic surveys on the Saguenay fjord in 2004‑2005.
Espèce |
2004 |
2005 |
|
|---|---|---|---|
|
Strates de surface et profonde intégrées n |
Strate de surface (0 ‑ 15 m) n |
Strate profonde (> 15 m) n |
|
Mallotus villosus |
19 561 |
30 551 |
45 |
Osmerus mordax |
5 928 |
11 336 |
15 |
Sebastes spp. |
268 |
306 |
18 |
Pholis gunnelus |
11 |
15 |
0 |
Gadus spp. |
2 |
14 |
1 |
Ammodytes sp. |
8 |
3 |
0 |
Coregonus sp. |
5 |
0 |
0 |
Cyclopteridae |
1 |
4 |
0 |
Clupea harengus |
0 |
3 |
0 |
Enchelyopus cimbrius |
0 |
2 |
0 |
Lumpenus lumpretaeformis |
1 |
1 |
0 |
Myoxocephalus scorpius |
2 |
0 |
0 |
Perca flavescens |
0 |
2 |
0 |
Aspidophoroides monopterygius |
0 |
1 |
0 |
|
|
|
|
OEufs de poissons |
1 601 |
1 533 |
207 |
Tableau 2
Distribution spatio-temporelle des densités (en nb 100 m-3) des larves de capelan (Mallotus villosus), d’éperlan arc-en-ciel (Osmerus mordax) et de sébaste (Sebastes spp.). Aucune larve de capelan, d’éperlan arc-en-ciel ou de sébaste n’a été capturée lors de la mission du 18‑20 mai 2004.
Spatio-temporal distribution (in nb 100 m-3) of larval capelin (Mallotus villosus), rainbow smelt (Osmerus mordax), and redfish (Sebastes spp.). No capelin, rainbow smelt or redfish larvae were caught on May 18-20, 2004.
Site |
2004 |
2005 |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|
09‑12 juin |
29‑30 juin |
26‑27 juil. |
30‑31 août |
05‑06 oct. |
08 juin |
20‑22 juin |
11‑12 juil. |
10‑11 août |
31 août |
|
Mallotus villosus | ||||||||||
Cap‑Jaseux |
7,5 |
57,7 |
252,7 |
27,6 |
0,3 |
0 |
193,8 |
88,5 |
68,6 |
19,3 |
Baie‑des‑Ha! Ha! |
0,3 |
39,4 |
291,0 |
1,3 |
0 |
0 |
82,3 |
34,2 |
36,7 |
6,3 |
Anse‑de‑Sable |
6,7 |
32,7 |
709,6 |
1,8 |
0,1 |
0 |
175,7 |
151,6 |
99,0 |
102,9 |
Baie‑Éternité |
11,9 |
8,5 |
468,9 |
2,7 |
0 |
0 |
30,1 |
244,5 |
97,3 |
47,7 |
Anse‑Saint‑Jean |
10,4 |
16,1 |
403,7 |
2,0 |
0,1 |
- |
18,8 |
162,2 |
105,5 |
33,3 |
Baie‑Sainte‑Marguerite |
6,5 |
7,7 |
180,0 |
1,3 |
0 |
- |
8,6 |
49,7 |
5,1 |
9,4 |
Anse‑à‑la‑Boule |
5,9 |
6,8 |
17,1 |
2,8 |
0 |
- |
26,3 |
8,7 |
1,2 |
7,1 |
Osmerus mordax | ||||||||||
Cap‑Jaseux |
4,9 |
153,7 |
59,6 |
0 |
0 |
1,1 |
290,9 |
28,3 |
1,6 |
0,1 |
Baie‑des‑Ha! Ha! |
0 |
127,5 |
11,4 |
0 |
0 |
0 |
166,9 |
24,6 |
1,0 |
0,1 |
Anse‑de‑Sable |
2,1 |
90,5 |
36,8 |
0,1 |
0 |
0,4 |
109,9 |
10,2 |
0,4 |
0,1 |
Baie‑Éternité |
0,3 |
38,6 |
172,1 |
0,1 |
0 |
0,2 |
2,3 |
7,1 |
0 |
0 |
Anse‑Saint‑Jean |
0 |
22,8 |
49,7 |
0,1 |
0 |
- |
0,8 |
5,4 |
0 |
0 |
Baie‑Sainte‑Marguerite |
0,8 |
13,6 |
3,7 |
0 |
0 |
- |
0,2 |
2,1 |
0 |
0 |
Anse‑à‑la‑Boule |
0 |
1,4 |
1,3 |
0 |
0 |
- |
0,7 |
0,2 |
0,1 |
0 |
Sebastes sp. | ||||||||||
Cap‑Jaseux |
0 |
0 |
0,1 |
0 |
0 |
0 |
0 |
0,4 |
2,1 |
0,1 |
Baie‑des‑Ha! Ha! |
0 |
2,2 |
20,2 |
1,4 |
0 |
0 |
0,3 |
2,1 |
5,2 |
1,2 |
Anse‑de‑Sable |
0 |
0 |
2,1 |
0,4 |
0,3 |
0 |
0 |
1,7 |
3,8 |
0,6 |
Baie‑Éternité |
0 |
0 |
3,6 |
0,3 |
0 |
0 |
0 |
0,1 |
0,5 |
0,5 |
Anse‑Saint‑Jean |
0 |
0,1 |
2,8 |
0,8 |
0 |
- |
0 |
0,1 |
0,7 |
1,6 |
Baie‑Sainte‑Marguerite |
0 |
0 |
0 |
0 |
0 |
- |
0 |
0 |
0,1 |
0,1 |
Anse‑à‑la‑Boule |
0 |
0 |
0,1 |
0 |
0 |
- |
0 |
0 |
0,2 |
0 |
Tableau 3
Revue des travaux de recherche antérieurs sur les poissons du fjord du Saguenay en fonction des trois modèles conceptuels sur le recrutement présentés à la figure 2. L’appui (+) ou le rejet (-) des modèles conceptuels sont présentés.
Review of previous works on Saguenay Fjord fish according to the three conceptual models on recruitment presented in Figure 2. Support (+) or rejection (-) of the models are presented.
Espèce et indicateur |
Référence |
Modèle I |
Modèle II |
Modèle III |
|---|---|---|---|---|
Mallotus villosus | ||||
Ichtyoplancton |
Présente étude |
+ |
– |
– |
Conclusion |
|
Accepté |
Rejeté |
Rejeté |
Osmerus mordax | ||||
Ichtyoplancton |
Présente étude |
+ |
– |
– |
Génétique |
LECOMTE (2005) |
+ |
– |
– |
Caractères morphologiques et méristiques |
LECOMTE (2005) FRÉCHET et al. (1983a) |
+ |
– |
– |
Parasites |
FRÉCHET et al. (1983b) |
+ |
+ |
+ |
Conclusion |
|
Accepté |
Rejeté |
Rejeté |
Sebastes mentella | ||||
Ichtyoplancton |
Présente étude |
– |
– |
+ |
Éléments traces de l’otolithe |
CAMPANA et al. (2007) |
+ |
+ |
+ |
Génétique |
ROQUES et al. (2002) VALENTIN (2006) |
– |
+ |
+ |
Morphométrie |
VALENTIN (2006) |
+ |
+ |
+ |
Croissance |
BOURGEOIS (1993) |
+ |
+ |
+ |
Conclusion |
|
Rejeté |
Rejeté |
Accepté |
Gadus morhua | ||||
Ichtyoplancton |
Présente étude |
– |
– |
+ |
Éléments traces de l’otolithe |
SÉVIGNY et al. (2008) |
+ |
+ |
+ |
Génétique |
SÉVIGNY et al. (2008) |
– |
+ |
+ |
Indice de condition |
RICHARD (1997) |
+ |
+ |
+ |
Conclusion |
|
Rejeté |
Rejeté |
Accepté |
Reinhardtius hippoglossoides | ||||
Génétique |
SÉVIGNY (1994) |
– |
+ |
+ |
Caractéristiques du cycle vital |
TALBOT et SÉVIGNY (1994) |
– |
+ |
+ |
Parasites |
ARTHUR et ALBERT (1993) |
+ |
+ |
+ |
Conclusion |
|
Rejeté |
Accepté |
Accepté |