Abstracts
Résumé
Ce travail est une comparaison des capacités d’électro-oxydation du cristal violet sur des électrodes de Ti/TiO2 et Ti/IrO2-RuO2. Les résultats révèlent que le dépôt d’oxyde de métaux semi-conducteurs sur un support métallique adéquat tel que le titane permet d’améliorer l’activité électrochimique de ces électrodes. De même que l’influence des paramètres opératoires que sont la densité de courant (4,4, à 6,6 mA∙cm-2), la concentration de l’électrolyte (0,5 à 1,5 g∙L-1), la concentration initiale du colorant (2,5 x 10-5 à 10-4 M) et la surface d’électrode (4,55, 5,85 et 7,15 cm2) sur l’efficacité du traitement serait liée à la nature de l’électrode. Le suivi de la demande chimique en oxygène (DCO) au cours de l’électrolyse montre que Ti/IrO2-RuO2 possède le meilleur rendement épuratoire, puisqu’il permet d’atteindre un taux de réduction de la DCO de 92 % comparativement à un taux de 83 % enregistré dans le cas de Ti/TiO2 au bout de 2 h de traitement.
Mots-clés :
- électro-oxydation,
- cristal violet,
- oxyde de métaux,
- demande chimique en oxygène,
- paramètres opératoires
Abstract
The degradation of crystal violet in aqueous solution has been studied by an electro-oxidation process using Ti/TiO2 and Ti/IrO2-RuO2 anode electrodes. The study reveals that the deposition of metal oxide on a suitable metal support, such as pure titanium, improves the electrochemical activity of the electrodes. Different operating parameters were investigated such as current density (4.4 to 6.6 mA∙cm-2), initial concentration of dye (2.5 x 10-5 to 10-4 M), supporting electrolyte concentration (0.5 to 1.5 g∙L-1) and electrode surface (4.55, 5.85 and 7.15 cm2). The best performances of the electrolytic system were recorded using Ti/IrO2-RuO2 and 92% of COD could be removed in 2 h. By comparison, a maximum of 83% of COD could be removed using Ti/TiO2 for a similar imposed treatment time of 2 h.
Keywords:
- electro-oxidation,
- crystal violet,
- metal oxide,
- chemical oxygen demand,
- operating parameters
Article body
1. Introduction
Les rejets directs d’effluents colorés dans le milieu aquatique constituent une problématique environnementale de ces dernières années (WANG et al., 2018). Ceci provient de la quantité, la composition chimique et le caractère non biodégradable de certains de ces colorants utilisés dans l’industrie (ALAHIANE et al., 2013) et qui de surcroit seraient toxiques, cancérogènes, tératogènes ou mutagènes de par leurs dérivés (PALMA-GOYES et al., 2014). Leur résistance à l’oxydation, aux agents de lavage (OROZCO et al., 2008) et leur stabilité chimique leur confèrent une persistance accrue dans le milieu aquatique et font de ces colorants des polluants organiques très réfractaires, difficilement éliminés par les procédés classiques de traitement (MOREIRA et al., 2017).
Les colorants de la famille des triphénylméthanes tel que le cristal violet (chlorure d’hexamethylpararosaniline (Figure 1) sont très utilisés dans l’industrie alimentaire, cosmétique, du cuir, du papier (PALMA-GOYES et al., 2010), dans l’industrie textile (KAUR et al., 2017), mais également en tant qu'additif dans des comprimés et des capsules pharmaceutiques (PALMA-GOYES et al., 2010), à des fins de diagnostic médical ou biologique (LESHEM et al., 2006). Ce sont des colorants hydrophiles qui ont une faible affinité avec la biomasse et par conséquent le traitement biologique est souvent inefficace (ERSEVER et al., 2014).
Figure 1
Structure du cristal violet
Cristal violet structure
Le rejet sans traitement de ces effluents colorés dans l’environnement aquatique entraine souvent des dommages esthétiques (MOREIRA et al., 2013), des odeurs nauséabondes, inhibe la photosynthèse et dans de nombreux cas provoque la stérilité et la féminisation des organismes aquatiques (cas des perturbateurs endocriniens) (PAL et al., 2010), l’intoxication et l’asphyxie des microorganismes aquatiques par une sous oxygénation du milieu (BANDALA et al., 2008). De même, si ces colorants se retrouvent dans l’eau potable ou dans la chaine alimentaire grâce à la bioaccumulation, il peut y avoir des effets néfastes sur la santé humaine (WENG et PEI, 2016).
Le défi majeur actuel est de trouver une méthode efficace qui permette d’éviter l’arrivée de ces micropolluants dans le milieu aquatique (WANG et al., 2018). Plusieurs techniques de traitement ont été testées ces dernières années à cet effet (CHEN et al., 2017; ERSEVER et al., 2014).
Toutefois ces micropolluants sont souvent réfractaires à la plupart de ces technologies de traitement conventionnelles (SABLE et al., 2015; MOREIRA et al., 2017). En exemple, les procédés biologiques sont souvent inhibés par la toxicité des micropolluants (LI et al., 2016) et les procédés physicochimiques tels que la filtration, l’adsorption, la coagulation, etc. ne permettent pas leur élimination complète. Ces procédés consistent souvent en un transfert de la pollution (de la phase liquide à phase solide) plutôt qu’a une véritable dépollution, ce qui nécessite un traitement additionnel (KAUR et al., 2015; WANG et al., 2018).
Le développement des procédés d’oxydation avancés (POA) se présente comme une alternative intéressante pour le traitement de l’eau contenant ces composés organiques persistants (SUN et al., 2017; DE LA CRUZ et al., 2013; PRIETO-RODRÍGUEZ et al., 2013; ZHANG et al., 2016). Les POA sont des technologies de traitement efficaces capables de minéraliser complètement les polluants en CO2, H2O et ions inorganiques (MOREIRA et al., 2013; SIRES et al., 2014) ou les transformer en sous-produits biodégradables qui peuvent être éliminés par la suite par un procédé biologique (GARCIA-SEGURA et al., 2018). Ce sont des procédés physicochimiques, tous basés sur la génération in situ du radical hydroxyle OH• qui est l’oxydant le plus puissant généré en milieu aqueux avec un potentiel redox E° de 2,8 V/ENH. Parmi les POA les plus utilisés, les procédés d’oxydation électrochimique ont le gros avantage de ne pas nécessiter l’ajout de produits supplémentaires. En outre, Ils sont faciles d’automatisation, propres, compatibles avec l’environnement (réactif non polluant qui est l’électron) (ANGLADA et al., 2009; KAUR et al., 2015; THIAM et al., 2015; LI et al., 2016), rentables et efficaces avec un haut rendement de décoloration des effluents colorés (HAMZA et al., 2009; PALMA-GOYES et al., 2010; ZAVISKA et al., 2009; ZHANG et al., 2016; KAUR et al., 2017).
L’oxydation électrochimique est un POA qui utilise des électrodes anodiques à forte surtension d’oxygène telles que les oxydes métalliques (PbO2, SnO2). Ces oxydes fixés sur un support adéquat comme le titane et tout récemment le diamant dopé au bore (DDB) permettent la génération du radical hydroxyle par la réaction (1) dite décharge anodique de l’eau (GARCIA-GOMEZ et al., 2016; FLORES et al., 2017).
où M désigne le matériau d’électrode.
En effet, en appliquant un potentiel supérieur au potentiel de stabilité thermodynamique de l’eau à savoir 1,23 V/ENH, les molécules d’eau électrolysées seront activées et produisent les radicaux hydroxyles (NIDHEESH et al., 2018).
Par leur forte réactivité, les radicaux OH• ainsi formés et adsorbés à la surface de l’électrode réagissent avec les polluants en solution pour les minéraliser. L’efficacité du traitement par électro-oxydation dépend de plusieurs paramètres tels que le matériau d’électrode, le pH, la concentration du polluant, la concentration et la nature de l’électrolyte support, le courant d’électrolyse, etc. (PERALTA-HERNANDEZ et al., 2012). Plusieurs auteurs ont montré que le matériau influe fortement sur le procédé d’oxydation électrochimique en imposant le mécanisme de la réaction d’oxydation électrochimique à sa surface (active ou non active) et la voie de dégradation du polluant (MOREIRA et al., 2017; SIRES et al., 2014).
Selon le type d’électrolyte utilisé, le rendement du traitement peut aussi être amélioré avec la génération in situ d’autres agents oxydants à partir de celui-ci; par exemple l’acide hypochloreux (HClO) et l’ion hypochlorite (ClO- ), des oxydants certes moins puissants que les radicaux hydroxyles peuvent être générés à partir des ions chlorures (WANG et al., 2018; GARCIA-SEGURA et al., 2015; HAMZA et al. 2009; ZAVISKA et al., 2009) selon les réactions suivantes :
Le but de cet article est d’étudier la faisabilité du procédé d’oxydation électrochimique du cristal violet en utilisant différents matériaux d’électrodes que sont Ti/TiO2 et Ti/RuO2-IrO2, d’en évaluer et comparer l’efficacité selon les paramètres inhérents à ce procédé. Une comparaison de la cinétique et la capacité d’épuration du cristal violet a également été effectuée.
2. Matériels et méthodes
2.1 Produits chimiques
Les réactifs utilisés sont de qualité analytique. Ce sont le chlorure de sodium et le cristal violet fournis par Sigma-Aldrich. Le cristal violet est un colorant de la famille des triphénylméthanes de formule brute C25H30ClN3 et de structure chimique présentée à la figure 1. De l'eau distillée a été utilisée tout au long de la préparation des solutions aqueuses.
2.2 Cellule électrochimique et méthode d’analyse
L’oxydation électrochimique a été effectuée dans une cellule d’électrolyse non compartimentée de 100 mL de volume utile. Les anodes sont des électrodes de (Ti/IrO2-RuO2 et Ti/TiO2) de 7,15 cm2 de surface. La cathode est une électrode en grille de titane de la même surface. Les deux électrodes sont plongées dans la solution aqueuse à traiter avec une distance interélectrode fixée à 0,5 cm. Le système (cellule/électrodes) est posé sur un agitateur magnétique afin de maintenir l’électrolyte sous agitation et les électrodes sont reliées au potentiostat Radiometer Analytical Voltalab PGZ100 All-in-one.
La concentration résiduelle en cristal violet est déterminée par intervalle de temps. Le système est arrêté pour effectuer un prélèvement et un dosage par spectrométrie UV-visible est effectué sur un spectrophotomètre UV-visible Analytik Jena modèle Specord 200 Plus avec une longueur d’onde fixée à 592 nm. Les courbes de polarisation sont obtenues par balayage anodique par voltamétrie linéaire d’une solution contenant du cristal violet et du chlorure de sodium de concentration respective 7,5 x 10-5 M et 1 g∙L-1. La cellule électrochimique est constituée de trois électrodes que sont l’anode (électrode de travail) sous forme de métal/oxyde, la cathode ou contre-électrode en grille de titane et l’électrode de référence qui est Ag/AgCl. Cette étude voltampérométrique a été effectuée avec un potentiostat Radiometer Analytical Voltalab PGZ100 All-in-one piloté par le logiciel Master 4. La gamme de tension de balayage est de 0 à 2,5 V avec une vitesse de 20 mV∙s-1. L’évolution de la demande chimique en oxygène (DCO) a été suivie par la méthode à reflux avec un système de chauffage multiposte de type Bloc Digest. Les courants limites de diffusion ont été déterminés à partir des relations 5 et 6 :
où Ilim (t) représente le courant limite (ampère); F est la constante de Faraday (C∙mol-1), Ks est le coefficient apparent de transfert de matière (m∙s-1); A est la surface géométrique de l’électrode (m2); C est la concentration du polluant (mol∙L-1) et DCOt la demande chimique en oxygène à un instant t quelconque; n est le nombre d’électrons échangés (144), déterminé à partir de l’équation de minéralisation du cristal violet en dioxyde de carbone et ion inorganique :
3. Résultats et discussion
3.1 Activité électrochimique des électrodes
Afin de prédire la capacité des deux électrodes de travail à dégrader le cristal violet lors du traitement par électro-oxydation, les courbes de polarisation anodique de ces électrodes ont été tracées pour comparer les valeurs de leur surtension de dégagement d’oxygène. La surtension de dégagement de l’oxygène d’une électrode est liée à sa composition chimique, à ses facteurs géométriques et aux lacunes d’oxygène dans le film d’oxyde. En général, les électrodes de faible granulométrie qui ont donc le moins de lacunes d’oxygène présentent les valeurs de surtension d’oxygène les plus élevées et une meilleure activité électrochimique (WU et al., 2011).
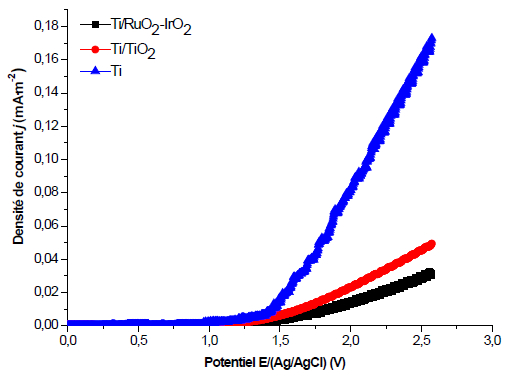
La figure 2 représente les voltamogrammes à balayage linéaire des électrodes de titane Ti et d’électrodes de titane recouvertes de film d’oxyde (Ti/TiO2 et de Ti/IrO2-RuO2). Les résultats montrent que le film d’oxyde déposé à la surface du titane augmente la valeur de la surtension de dégagement d’oxygène. Cette valeur (1,928 V) est maximale pour les électrodes de Ti/RuO2-IrO2, relativement plus élevée que celles (1,822 V et 1,616 V) des électrodes de Ti/TiO2 et Ti, respectivement.
Figure 2
Courbe de polarisation anodique des électrodes de Ti, Ti/TiO2 et de Ti/IrO2- RuO2 pour une solution de concentration en cristal violet de 7,5 x 10-5 M et de 1 g∙L-1 de NaCl; vitesse de balayage de 20 mV∙s-1
Anodic polarization curve of the Ti, Ti/TiO2 and Ti/IrO2-RuO2 electrodes for a solution of crystal violet (7.5 x 10-5 M) and NaCl (1 g∙L-1); scan rate of 20 mV∙s-1
Cela est souvent attribué à la morphologie de la surface des électrodes aux lacunes d’oxygène du film d’oxyde, mais aussi à l’affinité de l’électrode avec l’oxygène ou à des limitations d’ordre cinétique. Par conséquent, le dépôt du film d'oxyde améliore les sites actifs sur la surface de l'anode et modifie l’activité électrocatalytique de l’électrode, ce qui pourra conduire à une accélération à la fois de la production de OH• et de l’élimination des molécules organiques (LI et al., 2008). Ces valeurs de surtension de dégagement d’oxygène sont proches de celles répertoriées dans la littérature. En utilisant le même support métallique (le titane) sur lequel les oxydes de plomb et d’étain (PbO2 et SnO2) sont déposés, ANGLADA et al. (2009) et CHEN (2004) ont présenté dans leurs travaux une surtension d’oxygène de 1,9 V pour ces deux électrodes. Toutefois, ils ont signalé que, bien que ces électrodes soient très efficaces pour la dégradation des polluants, elles sont électrochimiquement instables en milieu très concentré en ions chlorures ce qui réduit leur performance. KAUR et al. (2017) ont montré que les électrodes de titane recouvertes de RuO2 permettent la génération des radicaux hydroxyles, et sont des électrodes stables avec une surtension d’oxygène de 2 V et que leurs performances sont améliorées par leur facilité à générer le chlore actif en présence d’ion chlorure dans le milieu. Fort de ce constat, il est possible de prévoir une dégradation plus rapide du cristal violet avec les électrodes de Ti/IrO2-RuO2 que sur les électrodes de Ti/TiO2.
3.2 Influence des paramètres opératoires
3.2.1 Influence de la densité de courant appliqué
L’effet de la densité du courant appliqué sur la dégradation du cristal violet par le procédé électro-oxydation a été étudié par électrolyse de solutions aqueuses de cristal violet (C0 = 7,5 x 10-5 M; NaCl = 1 g∙L-1; à la température ambiante (27 °C) et pour des densités de courant fixées à 4,4, 5,5 et 6,6 mA∙cm-2 à l’aide du potentiostat Voltalab PGZ100.
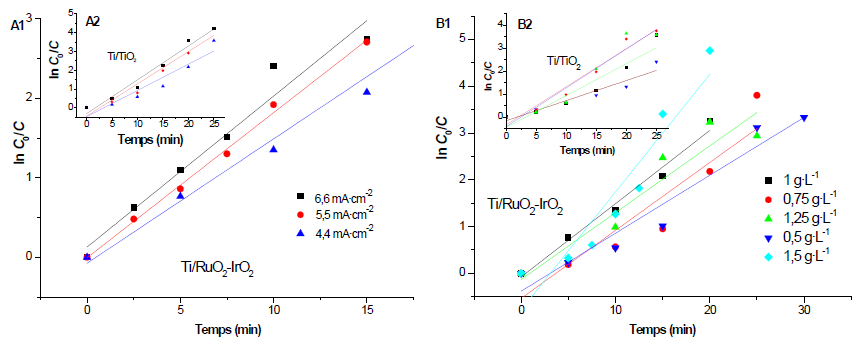
Les courbes cinétiques d'oxydation du cristal violet obtenues lors du traitement par électro-oxydation sur les électrodes de Ti/IrO2-RuO2 et Ti/TiO2 sont présentées respectivement aux figures 3A1 et 3A2). Ces courbes montrent une diminution exponentielle régulière et rapide de la concentration de cristal violet avec le temps au cours de l’électrolyse pour les deux électrodes.
Figure 3
Évolution de la concentration du colorant au cours de l’électrolyse en fonction de : a) la densité de courant (A1= Ti/IrO2-RuO2 et A2= Ti/TiO2), b) la concentration de l’électrolyte (B1= Ti/IrO2-RuO2 et B2= Ti/TiO2), c) la concentration initiale (C1= Ti/IrO2-RuO2 et C2= Ti/TiO2) et d) la surface d’électrode (D1= Ti/IrO2-RuO2 et D2= Ti/TiO2)
Evolution of the dye concentration during electrolysis depending on: a) current density (A1= Ti/IrO2-RuO2 and A2= Ti/TiO2), b) electrolyte concentration (B1= Ti/IrO2-RuO2 and B2= Ti/TiO2), c) initial concentration (C1= Ti/IrO2-RuO2 and C2= Ti/TiO2), and d) electrode surface (D1= Ti/IrO2-RuO2 and D2= Ti/TiO2)
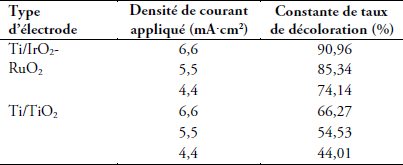
L’efficacité de la dégradation du cristal violet par électro-oxydation évolue avec la densité du courant appliqué et la nature de l’électrode. Elle augmente dans les deux cas, mais reste supérieure avec l’électrode de Ti/IrO2-RuO2. En effet, les valeurs déterminées du taux de décoloration au bout de 10 min de traitement et représentées dans le tableau 1 montrent que dans le cas des électrodes de Ti/IrO2-RuO2 on obtient des taux de décoloration de 90,96 %, 85,34 % et 74,14 % contre 66,27 %, 54,53 % et 44,01 % pour des électrodes de Ti/TiO2 respectivement pour des valeurs de densité de courant de 6,6, 5,5 et 4,4 mA∙cm-2. Cette augmentation de la vitesse d'oxydation du cristal violet avec la densité de courant peut s’expliquer par l'augmentation de la vitesse des réactions électrochimiques, consécutive à une génération plus rapide du radical hydroxyle à la surface de l’électrode (oxydation directe) et du chlore actif principalement (au pH du milieu) de l’acide hypochloreux HClO et de l’ion hypochlorite ClO- en solution (oxydation indirecte) à partir de l’électrolyte NaCl (KAUR et al., 2017; DROGUI et al., 2007). En effet, l’électricité étant le déplacement des électrons dans un conducteur métallique et le déplacement des ions dans une solution, dans ce cas, plus l’intensité du courant électrique est élevée plus les réactions électrochimiques en solution seront importantes. Or, toutes les réactions favorables à l’oxydation du cristal violet (décharge anodique de l’eau, formation du radical hydroxyle OH•, oxydation du cristal violet par ce radical hydroxyle et génération de chlore actif) dépendent de l’intensité du courant.
Tableau 1
Variation du taux de décoloration après 10 min de traitement en fonction de la densité de courant
Variation of the fading rate after a treatment time of 10 min, as a function of the current density
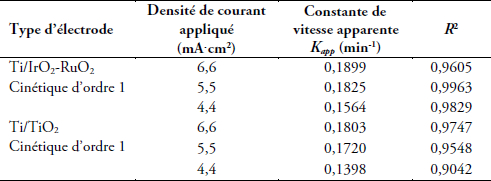
De plus, les constantes apparentes déterminées avec le tracé ln C0/C = f(t) (Figure 4A1 et 4A2) pour les différentes analyses sont présentés dans le tableau 2 et les densités de courant limites calculées pour les différentes concentrations sont représentées dans le tableau 3. Ces données montrent dans les deux cas que jappl > jlim et que la cinétique est de premier ordre avec des R2 > 0,9. Ces résultats confirment que pour une même intensité de courant, la dégradation est beaucoup plus rapide pour l’électrode de Ti/IrO2-RuO2 que pour l’électrode de Ti/TiO2. Cette différence de cinétique de disparition du cristal violet sur les deux électrodes est souvent attribuée à plusieurs facteurs. Il s’agit de la différence de surtension de dégagement d’oxygène et de la sélectivité des électrodes utilisées. En effet, selon la structure et la morphologie de l’électrode, l’affinité de celle-ci avec les radicaux hydroxyles (principal oxydant) varie. Pour une forte affinité de l’électrode avec ces radicaux, l’efficacité de l’électrode diminue et la disparition du cristal violet est moins rapide que dans le cas d’une électrode présentant une faible affinité avec ces radicaux. Ces résultats nous montrent donc que la cinétique et l’efficacité du traitement par le procédé d’électro-oxydation dépendent fortement de la nature de l’électrode.
Figure 4
Évolution de ln C0/C au cours de l’électrolyse en fonction de : a) la densité de courant (A1= Ti/IrO2-RuO2 et A2= Ti/TiO2) et b) la concentration de l’électrolyte (B1= Ti/IrO2-RuO2 et B2= Ti/TiO2)
Evolution of ln C0/C during electrolysis depending on: a) current density (A1= Ti/IrO2-RuO2 and A2= Ti/TiO2), and b) electrolyte concentration (B1= Ti/IrO2-RuO2 and B2= Ti/TiO2)
Tableau 2
Variation de la constante apparente de vitesse en fonction de la densité de courant
Variation of the apparent rate constant as a function of current density
Tableau 3
Variation du courant limite en fonction de la concentration initiale du colorant et de la demande chimique en oxygène (DCO)
Variation of the limiting current as a function of the initial concentration of dye and the chemical oxygen demand (COD)
3.2.2 Influence de la concentration de l’électrolyte NaCl
L’électrolyte utilisé est le chlorure de sodium (NaCl). L’étude de l’influence de sa concentration sur la dégradation du cristal violet par le procédé d’électro-oxydation a été effectuée sur une solution de concentration initiale en cristal violet de C0 = 7,5 x 10-5 M; pour un courant constant d’intensité I = 20 mA et des concentrations en NaCl allant de 0,5 à 1,5 g∙L-1 avec un pas de 0,25 g∙L-1.
La dégradation du cristal violet en solution par électro-oxydation peut se faire de manière directe à la surface de l’électrode ou de manière indirecte via des entités oxydantes générées à partir de l’électrolyte support (HURWITZ et al., 2014; LI et al., 2016). L’utilisation du chlorure de sodium comme électrolyte permet la génération in situ du dichlore Cl2, de l’acide hypochloreux HClO et de l’ion hypochlorite ClO- avec une prédominance d’une de ces trois espèces selon le pH du milieu. ZAVISKA et al. (2009) ont établi dans leurs travaux effectués sur la dégradation du violet de méthyle 2B, que la voie de dégradation indirecte contribuait à hauteur de 80 % dans la décomposition du colorant en utilisant l’électrode de Ti/IrO2 ce qui indiquerait l’existence possible d’une compétition entre ces deux voies de dégradation pour une concentration d’électrolyte donnée.
En observant les courbes des figures 3B1 et 3B2, on constate que la dégradation du cristal violet est influencée par la présence de l’électrolyte support. L’influence de l’électrolyte sur la dégradation du colorant dépend fortement de la concentration en solution de celui-ci, mais également de la nature de l’électrode.
Les résultats obtenus donnés par les figures 4B1 et 4B2 et les constantes apparentes de vitesses indiquées dans le tableau 4, montrent qu’avec une concentration d’électrolyte de 0,5 g∙L-1 l’électrode de Ti/IrO2-RuO2 possède une meilleure cinétique de dégradation que celle de Ti/TiO2. Les constantes apparentes obtenues sont de 0,1238 et 0,0875 min-1 respectivement pour l’électrode de Ti/IrO2-RuO2 et de Ti/TiO2. Ceci pourrait être dû au fait qu’à une faible concentration d’électrolyte on a une faible quantité de chlore actif généré, ainsi l’effet direct dominerait sur l’effet indirect. L’électrode Ti/IrO2-RuO2 possédant la valeur de surtension de dégagement d’oxygène la plus élevée aura le meilleur rendement de dégradation. Lorsqu’on augmente la concentration de l’électrolyte de 0,5 à 0,75 g∙L-1 on obtient dans les deux cas une amélioration de la vitesse de dégradation du cristal violet. Les constantes apparentes passent de 0,1238 à 0,1451 min-1 pour l’électrode de Ti/IrO2-RuO2 et de 0,0875 à 0,1657 min-1 pour celle de Ti/TiO2. Plusieurs auteurs ont montré que le chlorure de sodium utilisé comme électrolyte dans le procédé d’électro-oxydation permet à la fois de faciliter le passage du courant électrique, mais aussi à la génération en solution du dichlore espèce oxydante active (DROGUI et al., 2007; ZAVISKA et al., 2009; KAUR et al., 2015). Ceci montre donc que l’effet indirect vient appuyer le processus direct.
Tableau 4
Variation de la constante apparente de vitesse en fonction de la concentration de l’électrolyte
Variation of the apparent rate constant as a function of the electrolyte concentration
Toutefois, il faut noter que l’effet de l’augmentation de la concentration en électrolyte dans cette zone dépend de la nature de l’électrode, elle se manifeste plus dans le cas de l’électrode de Ti/TiO2. En effet, lorsque la concentration de l’électrolyte passe de 0,5 à 0,75 g∙L-1 la variation de la constante apparente est de 0,0782 min-1 pour Ti/TiO2, qui est 3,5 fois plus élevée que celle de Ti/IrO2-RuO2 qui est de 0,0213 min-1. Ce résultat suggère donc que l’électrode de Ti/TiO2 génère plus de chlore actif en solution que celle de Ti/IrO2- RuO2, ainsi elle favorisera le plus la dégradation indirecte.
Si la solution est de plus en plus concentrée en électrolyte, dans les deux cas on obtient une dégradation plus rapide du cristal violet du fait de l’augmentation de la conductivité de la solution qui facilite le passage du courant (ZHANG et al., 2016). Par conséquent, les réactions électrochimiques en solution, mais aussi la possibilité de génération d’agents oxydants in situ à partir de l’électrolyte sont favorisées. Ces agents oxydants ainsi générés entreraient en compétition avec les radicaux libres dans la dégradation du cristal violet.
Cependant, on note que la vitesse de dégradation ne croit pas sur toute la zone d’étude avec la concentration en électrolyte. Dans les deux cas, il existe une valeur critique qui amorce un ralentissement de la dégradation. En effet, lorsque la concentration de l’électrolyte passe de 1 à 1,25 g∙L-1 la constante apparente passe de 0,1564 à 0,1426 min-1 pour l’électrode de Ti/IrO2-RuO2. Pour l’électrode de Ti/TiO2, lorsque la concentration de l’électrolyte passe de 0,75 à 1 g∙L-1, la constante apparente passe de 0,1657 à 0,1389 min-1. Cette valeur critique de la concentration de l’électrolyte est donc de 0,75 et 1 g∙L-1 respectivement pour les électrodes de Ti/TiO2 et de Ti/IrO2-RuO2. Ce qui semblerait montrer que l’effet direct soit plus important sur Ti/IrO2-RuO2 que sur Ti/TiO2.
L’existence d’une valeur critique pour la concentration en électrolyte peut s’expliquer par la compétition entre les deux voies de dégradation. Pour de faibles concentrations en électrolyte on a une synergie des deux procédés (directs et indirects) : les entités oxydantes générées à partir de l’électrolyte viennent appuyer les radicaux hydroxyles dans la dégradation du cristal violet. Lorsque la valeur critique de la concentration en électrolyte est atteinte, la diminution de la vitesse peut s’expliquer par l’effet inhibiteur de radicaux hydroxyles des ions chlorure, comme évoqué dans plusieurs travaux (DJANEYE-BOUNDJOU et al., 2001; ALAHIANE et al., 2013) selon les équations suivantes (LIAO et al., 2001) :
En effet, dans ce cas-ci la quantité de chlore actif générée est plus importante, mais celui-ci a un pouvoir oxydant inférieur à celui des radicaux hydroxyles inhibés. Par contre, pour des concentrations supérieures à la valeur critique la vitesse de dégradation continue de croître avec la concentration en électrolyte, ceci parce que le processus est contrôlé par le procédé indirect. La vitesse de dégradation dépend dans ce cas de la concentration en chlore actif généré en solution.
3.2.3 Influence de la concentration initiale de cristal violet
L’étude de l’effet de la concentration initiale en cristal violet a été menée sur une plage de concentration de 2,5 x 10-5 à 10-4 M à la température ambiante, avec un courant constant d’intensité I = 20 mA et une concentration de l’électrolyte (NaCl) de 1 g∙L-1.
Vu qu’à l’échelle industrielle la charge organique des rejets est variable, alors l’effet de la concentration en cristal violet sur l’efficacité du procédé mérite d’être étudié pour une application ultérieure sur des effluents réels. La dégradation des composés se produit à la surface de l’électrode ou in situ via des réactions avec les oxydants générés à partir de l’électrolyte. Une forte concentration en cristal violet permet d’atténuer les limitations dues au transfert de masse à la surface de l’électrode, ainsi elle facilitera les interactions colorant/radicaux hydroxyles adsorbés à la surface d’électrode et colorant/oxydants générés.
Les résultats obtenus représentés dans les figures 3C1 et 3C2 montrent que pour les deux électrodes la durée du traitement pour la disparition complète du cristal violet est d’autant plus longue que la concentration initiale du cristal violet est de plus en plus élevée.
Les constantes apparentes de vitesse déterminées et présentées dans le tableau 5 montrent que pour les deux électrodes la cinétique est du premier ordre, la vitesse de dégradation du cristal violet baisse lorsque la concentration initiale varie de 2,5 x 10-5 à 10-4 M. Ceci est dû au fait que le courant appliqué est supérieur au courant limite de diffusion (Tableau 3), mais aussi que les intermédiaires issus de la dégradation partielle du cristal violet seraient en compétition avec celui-ci. En effet, les radicaux hydroxyles étant des entités très réactives et non sélectives, ils réagiraient avec tous les composés organiques en solution. Une élévation de la concentration initiale entraine donc une formation beaucoup plus importante de ces intermédiaires de réaction et la baisse de la vitesse de disparition du cristal violet. La décroissance exponentielle notée avec les deux électrodes révèle donc un système sous contrôle de la diffusion. En effet, tel que relaté dans les travaux de PANIZZA et al. (2001), si l’intensité du courant appliqué est supérieure au courant limite de diffusion, la concentration du polluant décroit exponentiellement.
Tableau 5
Constantes apparentes de vitesse de la dégradation du cristal violet sur électrodes de Ti/IrO2-RuO2 et Ti/TiO2 pour différentes concentrations initiales
Apparent rate constants for crystal violet degradation on Ti/IrO2-RuO2 and Ti/TiO2 electrodes for different initial concentrations of dye
Ces résultats montrent donc que pour la plage de concentration étudiée (2,5 x 10-5 à 10-4 M), avec une intensité de courant de 20 mA on a une cinétique constante d’ordre 1 pour les deux électrodes et la vitesse de dégradation du cristal violet diminue lorsque la concentration augmente.
3.2.4 Influence de la surface de l’électrode
L’étude de l’effet de la surface d’électrode sur la cinétique de dégradation du cristal violet a été effectuée avec une solution de concentration en cristal violet de 7,5 x 10-5 M; la concentration de l’électrolyte (NaCl) a été fixée à 1 g∙L-1 avec une intensité de courant de 20 mA, et à la température ambiante 27 °C pour des surfaces d’électrode S1 = 4,55 cm2, S2 = 5,85 cm2 et S3 = 7,15 cm2.
Les courbes cinétiques obtenues lors de l’électrolyse pour les trois surfaces d’électrode utilisées sont représentées par les figures 3D1 et 3D2. Ces courbes montrent que pour les trois surfaces d’électrode utilisées l’allure des courbes d’évolution de la concentration de cristal violet en fonction du temps ne change pas. On obtient toujours une décroissance exponentielle de la concentration de cristal violet au cours du temps avec les deux électrodes pour la plage de surfaces étudiée.
Ces courbes montrent également que l’effet de la surface d’électrode sur la cinétique de décoloration du cristal violet est fonction de la nature de l’électrode pour la plage de surface étudiée. En effet, une variation de la surface d’électrode de 4,55, 5,85 et 7,15 cm2 n’a pratiquement pas d’effet sur la cinétique de dégradation du cristal violet pour l’électrode de Ti/IrO2-RuO2, tandis que cette même variation de surface influe fortement sur la cinétique de décoloration du cristal violet pour le cas des électrodes de Ti/TiO2. On constate donc que pour le cas des électrodes de Ti/TiO2 plus la surface d’électrode augmente plus la dégradation du cristal violet est de plus en plus rapide et que la vitesse de dégradation reste pratiquement constante pour les électrodes de Ti/IrO2-RuO2.
Fort de ce constat, on peut affirmer que pour le cas des électrodes de Ti/IrO2-RuO2 la production de radical hydroxyle, l’oxydant principal, responsable de la dégradation du cristal violet est indépendante de la surface d’électrode; elle ne dépend que de l’intensité du courant d’électrolyse, tandis que pour l’électrode de Ti/TiO2 l’augmentation de la vitesse de dégradation avec la surface d’électrode montre que le système est limité par le transfert de matières électrode/solution. En effet, l’augmentation de cette surface donne la possibilité à plus de molécules de cristal violet à accéder à la surface de l’électrode, levant ainsi ces limitations de transfert, d’où une plus grande quantité de cristal violet enlevée et des résultats similaires peuvent être notés dans les travaux d’INDU et al. (2011). Ces résultats laissent penser donc que l’électrode de Ti/IrO2-RuO2 pourrait posséder plus de sites actifs pour la production de radicaux hydroxyles que celle de Ti/TiO2.
3.3 Évolution de la charge polluante (DCO)
La figure 5 donne l’évolution de la DCO en fonction du temps d’électrolyse en utilisant les électrodes de Ti/IrO2-RuO2 et Ti/TiO2. Afin de comparer la capacité épuratrice de ces deux électrodes, l’étude a été effectuée sur une solution dont la DCO initiale est de 124,8 mg∙L-1. Pour accélérer la dégradation, l’intensité du courant d’électrolyse a été fixée à 50 mA et la concentration de l’électrolyte (NaCl) de 1 g∙L-1 avec une surface d’électrode de 7,15 cm2. Les résultats obtenus révèlent de toute évidence que l’électrode de Ti/IrO2-RuO2 possède un rendement épuratoire meilleur à celui de Ti/TiO2. On atteint environ 92 % et 83 % d’élimination de la DCO après 120 min de traitement respectivement pour Ti/IrO2-RuO2 et Ti/TiO2. Ce résultat était prévisible, car l’électrode de Ti/IrO2-RuO2 ayant la valeur de surtension de dégagement de l’oxygène la plus élevée favorise le plus la génération du radical hydroxyle OH• (ZHANG et al., 2014). Par conséquent, les composés organiques seront plus efficacement dégradés sur cette électrode que celle de Ti/TiO2. En outre, dans les deux cas la cinétique d’élimination de la charge polluante (DCO) suit une cinétique de premier ordre et les valeurs des constantes apparentes de vitesse de réaction qui sont de 0,0208 et 0,0161 min-1 respectivement pour Ti/IrO2-RuO2 et Ti/TiO2 confortent cette affirmation.
Figure 5
Évolution de la demande chimique en oxygène (DCO) au cours de l’électrolyse d’une solution de cristal violet de DCO initiale de 124,8 mg∙L-1; surface d’électrode 7,15 cm2 ; NaCl = 1 g∙L-1; I = 50 mA
Evolution of the chemical oxygen demand (COD) during the electrolysis of a crystal violet solution with an initial COD of 124.8 mg∙L-1; electrode area 7.15 cm2; NaCl = 1 g∙L-1; I = 50 mA
Cette cinétique d’évolution de la DCO d’ordre 1 (décroissance exponentielle) pour les deux électrodes est obtenue, car l’intensité du courant appliqué est supérieure au courant limite de diffusion (Tableau 3). Le régime est donc sous le contrôle du transport de matière à la surface de l’électrode comme signalé dans les travaux de PANIZZA et al. (2001).
Il faut également noter que même si on obtient une décoloration complète de la solution après 30 min de traitement, la DCO reste élevée ce qui traduit là, une dégradation partielle du cristal violet générant des produits intermédiaires. En effet, quelques intermédiaires réactionnels issus de la dégradation du cristal violet par le radical hydroxyle ont été identifiés dans la littérature. PALMA-GOYES et al. (2010) et FAN et al. (2009) ont identifié, dans leurs travaux respectifs, le 4-(N,N-dimethylamino)-4'-(N',N'-dimethylamino) benzo-phenone; N-methylaniline; le N,N-dimethylaniline; le 4-dimethylaminophenol; l’acide 4-dimethylamino benzoïque. Pour les deux électrodes, on obtient une diminution très rapide de la DCO dans la première heure d’électrolyse et un ralentissement de la vitesse de dégradation par la suite. Ceci est souvent attribué à ces intermédiaires formés qui seraient moins sensibles aux radicaux hydroxyles que la molécule initiale.
4. Conclusion
Les résultats de ce travail présentent les similitudes et les différences obtenues lors du traitement par oxydation électrochimique du cristal violet sur deux électrodes de nature différente telles que le Ti/TiO2 et le Ti/IrO2-RuO2. L’étude de l’effet des paramètres inhérents au procédé d’oxydation anodique révèle que ces paramètres n’influent pas de la même manière sur l’efficacité du traitement pour les deux électrodes. Les résultats montrent que pour les deux électrodes l’efficacité du traitement augmente avec la densité du courant appliqué, il existe une concentration optimale d’électrolyte qui est de 0,75 g∙L-1 pour Ti/TiO2 et de 1 g∙L-1 pour Ti/IrO2-RuO2. Pour la plage de surface d’électrode étudiée l’efficacité du traitement est beaucoup plus affectée par l’augmentation de la surface pour l’électrode Ti/TiO2 que pour celle de Ti/IrO2-RuO2. De plus, le suivi de la DCO résiduelle au cours de l’électrolyse montre que l’électrode de Ti/IrO2-RuO2 possède le rendement épuratoire le plus élevé avec un taux de réduction de 92 % en 2 h contre 83 % pour Ti/TiO2. Lors de l’électrolyse d’une solution de cristal violet de DCO initiale de 124,8 mg∙L-1, la surface d’électrode de 7,15 cm2, NaCl = 1 g∙L-1 et I = 50 mA, les constantes apparentes de vitesse obtenues, avec un modèle de cinétique de premier ordre sont de 0,0208 et 0,0161 min-1, respectivement pour Ti/IrO2-RuO2 et Ti/TiO2. Bien que, avec ces électrodes on parvient à avoir des taux d’abattement de la DCO supérieurs à 80 % il serait intéressant par la suite d’étudier les produits intermédiaires formés, les ions nitrites et nitrates, mais aussi d’appliquer ceci à des effluents réels et de faire l’étude de la consommation énergétique de ce procédé.
Appendices
Références bibliographiques
- ALAHIANE S., S. QOURZAL, M. EL OUARDI, M. BELMOUDEN, A. ASSABBANE et Y. AIT-ICHOU (2013). Adsorption et photodégradation du colorant indigo carmine en milieu aqueux en présence de TiO2/UV/O2. J. Mater. Environ. Sci., 4, 239-250.
- ANGLADA A., A. URTIAGA et I. ORTIZ (2009). Contributions of electrochemical oxidation to waste-water treatment: fundamentals and review of applications. J. Chem. Technol. Biotechnol., 84, 1747-1755.
- BANDALA E.R., M.A. PELAEZ, A. JAVIER GARCIA-LOPEZ, M.J. SALGADO et G.E. MOELLER CHAVEZ (2008). Photocatalytic decolorization of synthetic and real textile wastewater containing benzidine-based azo dyes. Chem. Eng. Process., 47, 169-176.
- CHEN G. (2004). Electrochemical technologies in wastewater treatment. Sep. Purif. Technol., 38, 11-41.
- CHEN Y., J.C. BAYGENTS et J. FARRELL (2017). Evaluating electrocoagulation and chemical coagulation for removing dissolved silica from high efficiency reverse osmosis (HERO) concentrate solutions. J. Water. Process. Eng., 16, 50-55.
- DE LA CRUZ N., L. ESQUIUS, D. GRANDJEAN, A. MAGNET, A. TUNGLER, L.F. DE ALENCASTRO et C. PULGARIN (2013). Degradation of emergent contaminants by UV, UV/H2O2 and neutral photo-Fenton at pilot scale in a domestic wastewater treatment plant. Water Res., 47, 5836-5845.
- DJANEYE-BOUNDJOU G., L.M. BAWA, Y. BOUKARI et K. DOVI (2001). Photodégradation de la rhodamine B et du bleu de méthylène en solution aqueuse. J. Soc. Ouest-Afr. Chim., 11, 75-94.
- DROGUI P., J.F. BLAIS et G. MERCIER (2007). Review of electrochemical technologies for environmental applications. Recent Pat. Eng., 1, 257-272.
- ERSEVER I., V. RAVINDRAN, H.H. TSAI et M. PIRBAZARI (2014). Modeling and design of anaerobic fluidized bed reactor with recycling for denitrification of reverse osmosis concentrates. Chem. Eng. Sci., 108, 111-122.
- FAN H.J., S.T. HUANG, W.H. CHUNG, J.L. JAN, W.Y. LIN et C.C. CHEN (2009). Degradation pathways of crystal violet by Fenton and Fenton-like systems: condition optimization and intermediate separation and identification. J. Hazard. Mater., 171, 1032-1044.
- FLORES N., I. SIRES, R.M. RODRIGUEZ, F. CENTELLAS, P.L. CABOT, J.A. GARRIDO et E. BRILLAS (2017). Removal of 4-hydroxyphenylacetic acid from aqueous medium by electrochemical oxidation with a BDD anode: Mineralization, kinetics and oxidation products. J. Electroanal. Chem., 793, 58-65.
- GARCIA-GOMEZ C., P. DROGUI, B. SEYHI, P. GORTARES-MOROYOQUI, G. BUELNA, M.I. ESTRADA-ALVGARADO et L.H. ÁLVAREZ (2016). Combined membrane bioreactor and electrochemical oxidation using Ti/PbO2 anode for the removal of carbamazepine. J. Taiwan Inst. Chem. E., 64, 211-219.
- GARCIA-SEGURA S., J. KELLER, E. BRILLAS et J. RADJENOVIC (2015). Removal of organic contaminants from secondary effluent by anodic oxidation with a boron-doped diamond anode as tertiary treatment. J. Hazard. Mater., 283, 551-557.
- GARCIA-SEGURA S., J.D. OCON et M.N. CHONG (2018). Electrochemical oxidation remediation of real wastewater effluents - A review. Process. Saf. Environ., 113, 48-67.
- HAMZA M., R. ABDELHEDI, E. BRILLAS et I. SIRÉS (2009). Comparative electrochemical degradation of the triphenylmethane dye Methyl Violet with boron-doped diamond and Pt anodes. J. Electroanal. Chem., 627, 41-50.
- HURWITZ G., E.M.V. HOEK, K. LIU, L. FAN et F.A. RODDICK (2014). Photo-assisted electrochemical treatment of municipal wastewater reverse osmosis concentrate. Chem. Eng. J., 249, 180-188.
- INDU M., S. PILLAI, A.K. GUPTA, et C. SAHOO (2011). Electrochemical oxidation of crystal violet dye (basic violet 3) using lead oxide electrodes. Proceedings of the IASTED International Conference, 4-6 juillet 2011, Calgary, AB, Canada, Environmental Management and Engineering, pp. 60-66.
- KAUR P., V.K. SANGAL et J.P. KUSHWAHA (2015). Modeling and evaluation of electro-oxidation of dye wastewater using artificial neural networks. RSC. Adv., 5, 34663-34671.
- KAUR P., V.K. SANGAL et J.P. KUSHWAHA (2017). Evaluation and disposability study of actual textile wastewater treatment by electro-oxidation method using Ti/RuO2 anode. Process. Saf. Environ., 111, 13-22.
- LESHEM E.N., D.S. PINES, S.J. ERGAS et D.A. RECHOW (2006). Electrochemical oxidation and ozonation for textile wastewater reuse. J. Environ. Eng., 132, 324-330.
- LI D., J. TANG, X. ZHOU, J. LI, X. SUN, J. SHEN, L. WANG et W. HAN (2016). Electrochemical degradation of pyridine by Ti/SnO2-Sb tubular porous electrode. Chemosphere, 149, 49-56.
- LI S.P., F. JING et H. ZHEN (2008). Preparation and characterization of Y doped Ti/Sb2O5-SnO2 electro-catalytic electrodes. J. Shandong Univ., 49, 22.
- LIAO C.H., S.F. KANG et F.A. WU (2001). Hydroxyl radical scavenging role of chloride and bicarbonate ions in the H2O2/UV process. Chemosphere, 44, 1193-1200.
- MOREIRA F.C., S. GARCIA-SEGURA, V.J.P. VILAR, R.A.R. BOAVENTURA et E. BRILLAS (2013). Decolorization and mineralization of Sunset Yellow FCF azo dye by anodic oxidation, electro-Fenton, UVA photoelectro-Fenton and solar photoelectro-Fenton processes. Appl. Catal. B-Environ., 142-143, 877-890.
- MOREIRA F.C., R.A.R. BOAVENTURA, E. BRILLAS et V.J.P. VILAR (2017). Electrochemical advanced oxidation processes: A review on their application to synthetic and real wastewaters. Appl. Catal. B-Environ., 202, 217-261.
- NIDHEESH P.V., M. ZHOU et M.A. OTURAN (2018). An overview on the removal of synthetic dyes from water by electrochemical advanced oxidation processes. Chemosphere, 197, 210-227.
- OROZCO S.L., E.R. BANDALA, C.A. ARANCIBIA-BULNES, B. SERRANO, R. SUAREZ-PARRA et I. HERNANDEZ-PEREZ (2008). Effect of iron salt on the color removal of water containing the azo-dye reactive blue 69 using photo-assisted Fe(II)/H2O2 and Fe(III)/H2O22 systems. J. Photochem. Photobiol. A, 198, 144-149.
- PAL A., K.Y.H. GIN, A.Y.C. LIN et M. REINHARD (2010). Impacts of emerging organic contaminants on freshwater resources: review of recent occurrences, sources, fate and effects. Sci. Total. Environ., 408, 6062-6069.
- PALMA-GOYES R.E., F.L. GUZMAN-DUQUE, G. PEÑUELA, I. GONZALEZ, J.L. NAVA et R.A. TORRES-PALMA (2010). Electrochemical degradation of crystal violet with BDD electrodes: Effect of electrochemical parameters and identification of organic by-products. Chemosphere, 81, 26-32.
- PALMA-GOYES R.E., J. SILVA-AGREDO, I. GONZALEZ, et R.A. TORRES-PALMA (2014). Comparative degradation of indigo carmine by electrochemical oxidation and advanced oxidation processes. Electrochim. Acta, 140, 427-433.
- PANIZZA M., P.A. MICHAUD, G. CERISOLA et C. COMNINELLIS (2001). Anodic oxidation of 2-naphthol at boron-doped diamond electrodes. J. Electroanal. Chem., 507, 206-214.
- PERALTA-HERNANDEZ J.M., M. MENDEZ-TOVAR, R. GUERRA-SANCHEZ, C.A. MARTINEZ-HUITLE et J.L. NAVA (2012). A brief review on environmental application of boron doped diamond electrodes as a new way for electrochemical incineration of synthetic dyes. Int. J. Electrochem., 2012, 1-18.
- PRIETO-RODRÍGUEZ L., D. SPASIANO, I. OLLER, I. FERNÁNDEZ-CALDERERO, A. AGÜERA et S. MALATO (2013). Solar photo-Fenton optimization for the treatment of MWTP effluents containing emerging contaminants. Catal. Today, 209, 188-194.
- SABLE S.S., P.P. GHUTE, P. ÁLVAREZ, F.J. BELTRÁN, F. MEDINA et S. CONTRERAS (2015). FeOOH and derived phases: Efficient heterogeneous catalysts for clofibric acid degradation by advanced oxidation processes (AOPs). Catal. Today, 240, 46-54.
- SIRES I., E. BRILLAS, M.A. OTURAN, M.A. RODRIGO et M. PANIZZA (2014). Electrochemical advanced oxidation processes: Today and tomorrow. A review. Environ. Sci. Pollut. Res., 21, 8336-8367.
- SUN Y., P. LI, H. ZHENG, C. ZHAO, X. XIAO, Y. XU, W. SUN, H. WU et M. REN (2017). Electrochemical treatment of chloramphenicol using Ti-Sn/γ-Al2O3 particle electrodes with a three-dimensional reactor. Chem. Eng. J., 308, 1233-1242.
- THIAM A., I. SIRES, F.A. CENTELLAS, P.L. CABOT et E. BRILLAS (2015). Decolorization and mineralization of Allura Red AC azo dye by solar photoelectro-Fenton: Identification of intermediates. Chemosphere, 136, 1-8.
- WANG J., T. ZHANG, Y. MEI et B. PAN (2018). Treatment of reverse-osmosis concentrate of printing and dyeing wastewater by electro-oxidation process with controlled oxidation-reduction potential (ORP). Chemosphere, 201, 621-626.
- WENG M et J. PEI (2016). Electrochemical oxidation of reverse osmosis concentrate using a novel electrode: Parameter optimization and kinetics study. Desalination, 399, 21-28.
- WU T., G. ZHAO, Y. LEI, et P. LI (2011). Distinctive tin dioxide anode fabricated by pulse electrodeposition: High oxygen evolution potential and efficient electrochemical degradation of fluorobenzene. J. Phys. Chem., 115, 3888-3898.
- ZAVISKA F., P. DROGUI, J.F. BLAIS et G. MERCIER (2009). In situ active chlorine generation for the treatment of dye-containing effluents. J. Appl. Electrochem., 39, 2397-2408.
- ZHANG L., L. XU, J. HE et J. ZHANG (2014). Preparation of Ti/SnO2-Sb electrodes modified by carbon nanotube for anodic oxidation of dye wastewater and combination with nanofiltration. Electrochim. Acta, 117, 192-201.
- ZHANG Y., Y. TINGTING, W. HAN, X. SUN, J. LI, J. SHEN et L. WANG (2016). Electrochemical treatment of anticancer drugs wastewater containing 5-Fluoro-2-Methoxypyrimidine using a tubular porous electrode electrocatalytic reactor. Electrochim. Acta, 220, 211-221.
List of figures
Figure 1
Structure du cristal violet
Cristal violet structure
Figure 2
Courbe de polarisation anodique des électrodes de Ti, Ti/TiO2 et de Ti/IrO2- RuO2 pour une solution de concentration en cristal violet de 7,5 x 10-5 M et de 1 g∙L-1 de NaCl; vitesse de balayage de 20 mV∙s-1
Anodic polarization curve of the Ti, Ti/TiO2 and Ti/IrO2-RuO2 electrodes for a solution of crystal violet (7.5 x 10-5 M) and NaCl (1 g∙L-1); scan rate of 20 mV∙s-1
Figure 3
Évolution de la concentration du colorant au cours de l’électrolyse en fonction de : a) la densité de courant (A1= Ti/IrO2-RuO2 et A2= Ti/TiO2), b) la concentration de l’électrolyte (B1= Ti/IrO2-RuO2 et B2= Ti/TiO2), c) la concentration initiale (C1= Ti/IrO2-RuO2 et C2= Ti/TiO2) et d) la surface d’électrode (D1= Ti/IrO2-RuO2 et D2= Ti/TiO2)
Evolution of the dye concentration during electrolysis depending on: a) current density (A1= Ti/IrO2-RuO2 and A2= Ti/TiO2), b) electrolyte concentration (B1= Ti/IrO2-RuO2 and B2= Ti/TiO2), c) initial concentration (C1= Ti/IrO2-RuO2 and C2= Ti/TiO2), and d) electrode surface (D1= Ti/IrO2-RuO2 and D2= Ti/TiO2)
Figure 4
Évolution de ln C0/C au cours de l’électrolyse en fonction de : a) la densité de courant (A1= Ti/IrO2-RuO2 et A2= Ti/TiO2) et b) la concentration de l’électrolyte (B1= Ti/IrO2-RuO2 et B2= Ti/TiO2)
Evolution of ln C0/C during electrolysis depending on: a) current density (A1= Ti/IrO2-RuO2 and A2= Ti/TiO2), and b) electrolyte concentration (B1= Ti/IrO2-RuO2 and B2= Ti/TiO2)
Figure 5
Évolution de la demande chimique en oxygène (DCO) au cours de l’électrolyse d’une solution de cristal violet de DCO initiale de 124,8 mg∙L-1; surface d’électrode 7,15 cm2 ; NaCl = 1 g∙L-1; I = 50 mA
Evolution of the chemical oxygen demand (COD) during the electrolysis of a crystal violet solution with an initial COD of 124.8 mg∙L-1; electrode area 7.15 cm2; NaCl = 1 g∙L-1; I = 50 mA
List of tables
Tableau 1
Variation du taux de décoloration après 10 min de traitement en fonction de la densité de courant
Variation of the fading rate after a treatment time of 10 min, as a function of the current density
Tableau 2
Variation de la constante apparente de vitesse en fonction de la densité de courant
Variation of the apparent rate constant as a function of current density
Tableau 3
Variation du courant limite en fonction de la concentration initiale du colorant et de la demande chimique en oxygène (DCO)
Variation of the limiting current as a function of the initial concentration of dye and the chemical oxygen demand (COD)
Tableau 4
Variation de la constante apparente de vitesse en fonction de la concentration de l’électrolyte
Variation of the apparent rate constant as a function of the electrolyte concentration
Tableau 5
Constantes apparentes de vitesse de la dégradation du cristal violet sur électrodes de Ti/IrO2-RuO2 et Ti/TiO2 pour différentes concentrations initiales
Apparent rate constants for crystal violet degradation on Ti/IrO2-RuO2 and Ti/TiO2 electrodes for different initial concentrations of dye